
- •Пути передачи биологической информации
- •Аминокислоты (АК)
- •Трехбуквенные и однобуквенные обозначения аминокислот
- •Кислотно-основные свойства аминокислот
- •Аминокислотный состав белков
- •Заменимые и незаменимые аминокислоты
- •Редкие аминокислоты, входящие в состав белков
- •Аминокислоты, не встречающиеся в белках
- •Что определило такой набор аминокислот в составе белков?
- •Пространственная организация белковой молекулы
- •Первичная структура белка
- •Анализ первичной структуры белковых молекул
- •Вторичная структура белка
- •Особенности пептидной связи, определяющие формирование регулярной пептидной структуры
- •Стерические ограничения, возникающие при формировании полипептидной цепи
- •Типы вторичной структуры белка
- •Альфа спираль
- •Свойства α-спирали (1)
- •Свойства α-спирали (2)
- •Коллагеновая спираль
- •Бета-структуры
- •Параллельный и антипараллельный β-слои
- •Бета-изгиб
- •Методы, применяемые для анализа вторичной структуры белковых молекул
- •Супервторичная структура (мотив)
- •Супервторичные структуры
- •Супервторичные структуры
- •Супервторичные структуры
- •Супервторичные структуры
- •Типы β-бочонков
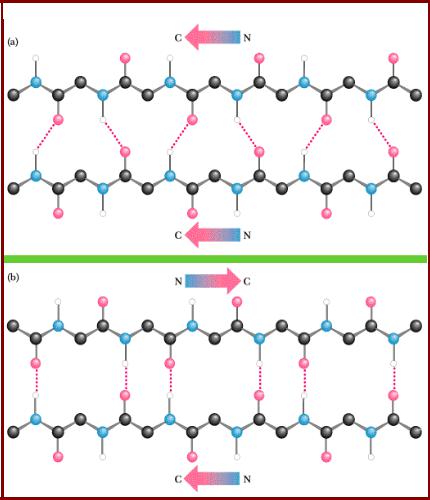
Параллельный и антипараллельный β-слои
• Два типа β-структур
- параллельный слой;
- антипараллельный слой
(энергетически более выгодный);
•В образовании водородных связей между двумя цепями задействована половина пептидных групп;
•Длина β-структур – 3-8 ак, а β-слой чаще всего составлен из 2-6 цепей (до 10);
•Характерно формирование поверхностей с однотипными R-группами;
• Поверхность редко бывает
плоской.
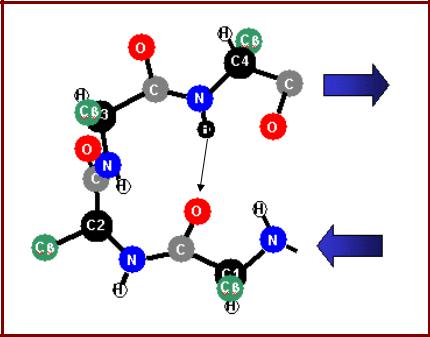
• Наиболее экономичный
структурный элемент, Бета-изгиб позволяющий повернуть полипептид на 1800;
•Используется три пептидных группировки;
•Стабилизируется одной водородной связью;
•Часто встречается Gly и Pro;
•Практически всегда оказывается на поверхности глобулы;
•Существует две возможные структуры бета-изгиба;
•Углы φ и ψ – разные.
Методы, применяемые для анализа вторичной структуры белковых молекул
•Рентгеноструктурный анализ;
•Метод ядерно-магнитного резонанса;
•Метод кругового дихроизма;
•Исследование дисперсии оптического вращения.
•Предсказание вторичной структуры:
•Glu, Met, Ala, Leu – чаще встречаются в α-спиралях, Pro –
крайне редко, только на конце;
•Val, Ile, Tyr, Phe - чаще встречаются в β- структурах, Asp, Glu – редко.
•Предсказать вторичную структуру глобулярных белков по ак последовательности можно с точностью около 70%.
Супервторичная структура (мотив)
•Супервторичной структурой называют специфичную комбинацию вторичных структур, имеющую особенную топологию и организованную в характерную трехмерную структуру;
•Наличие определенного мотива вторичной структуры в белке во многих случаях (но не всегда) связано с определенными функциями;
•Не все регулярные вторичные структуры формируют супервторичные структуры;
•Эволюционно консервативные структуры.
