
- •Механика.
- •§1. Механическое движение.
- •§2. Вектор перемещения точки.
- •§3. Вектор скорости.
- •§4. Вектор ускорения.
- •§5. Псевдовекторы.
- •§6. Классификация движения материальной точки.
- •§7. Кинематика твёрдого тела.
- •§8. Первый закон Ньютона. Инерциальная система отсчёта.
- •§9. Сила.
- •§10. Масса. Центр инерции. Импульс.
- •§11.Второй закон Ньютона.
- •§12. Третий закон Ньютона.
- •§13. Закон движения центра инерции.
- •§14. Закон сохранения импульса.
- •§15. Механическая работа.
- •§16.Кинетическая энергия.
- •§17.Потенциальная энергия.
- •§18.Закон сохранения механической энергии.
- •§19. Абсолютно упругий и абсолютно неупругий удары.
- •§20.Момент силы и момент импульса.
- •§21.Момент инерции.
- •Теорема Штейнера.
- •§22.Основной закон динамики вращательного движения.
- •§23.Закон сохранения момента импульса.
- •Термодинамика и молекулярная физика.
- •§24. Предмет молекулярной физики.
- •§25. Статистический, динамический и термодинамический методы исследования.
- •§26. Термодинамические параметры. Термодинамический процесс.
- •§ 27. Уравнение состояния идеального газа.
- •§ 28. Основное уравнение кинетической энергии газов.
- •§ 29. Закон распределения молекул идеального газа по скоростям Максвелла.
- •§ 30. Средняя длина свободного пробега молекул.
- •§ 31. Закон равномерного распределения энергии по степеням свободы молекул.
- •§32. Явления переноса в газах.
- •§33. Явление диффузии.
- •§34. Явление внутреннего трения (вязкости).
- •§35. Явление теплопроводности.
- •§36. Внутренняя энергия термодинамической системы.
- •§37. Количество теплоты и термодинамическая работа.
- •§38. Первое начало термодинамики.
- •§39. Теплоёмкость.
§ 27. Уравнение состояния идеального газа.
Определение:Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры.
Определение:Уравнением Клайперона
называется соотношение, справедливое
для постоянной массы идеального газа:
![]() .
.
Определение:Молярной массой любого тела называется физическая величина, равная отношению массы тела к количеству молей, которое в нём содержится: = m/, = m/ ; = 10 –3 m/mo , где m масса молекулы данного тела, mo масса одной двенадцатой массы атома углерода.
Определение:Молярным объёмом называется физическая величина, равная отношению объёма газа к числу молей, содержащихся в газе: V =V/ .
Уравнение состояния идеального газа одного моля p V = R T.
Rуниверсальная газовая постояннаяR = 8,31 Дж/(K моль).
Определение:Уравнением
МенделееваКлайперона
называется соотношение, справедливое
для любого идеального газа:
![]() .
.
Постоянная Больцмана
![]() .
.
Использование постоянной Больцмана,
молярного объёма в уравнении
МенделееваКлайперона
приведёт к следующему результату:![]() эта формула также
является уравнением состояния идеального
газа, гдеn0концентрация молекул идеального газа,
т.е. их число в единице объёма. Применяя
формулу плотности вещества получим ещё
один вариант уравнения состояния
идеального газа:
эта формула также
является уравнением состояния идеального
газа, гдеn0концентрация молекул идеального газа,
т.е. их число в единице объёма. Применяя
формулу плотности вещества получим ещё
один вариант уравнения состояния
идеального газа:
![]() .
.
§ 28. Основное уравнение кинетической энергии газов.
Определение:Основным уравнение кинетической
энергии газов есть соотношение:
![]() .
.
Это уравнение выполняется при N = constобщее число молекул в газе, то есть при отсутствии химических реакций; газ может состоять из разнородных молекул.
![]() суммарная энергия поступательного
движения молекул газа, находящихся в
сосуде, гдеmiмасса, аVi
скорость«i
ой» молекулы.
суммарная энергия поступательного
движения молекул газа, находящихся в
сосуде, гдеmiмасса, аVi
скорость«i
ой» молекулы.
Для однородного газа mi
=mo
, тогда ![]() .
.
Введём средне квадратичную скорость
Vквадр.
поступательного движения молекул
газа:![]() .
.
Тогда
![]()
Подставим данный результат в основное уравнение кинетической теории газов
![]() (*),mмасса всего газа.
(*),mмасса всего газа.
Сопоставим полученный результат с уравнением МенделееваКлайперона:

![]() ,
здесь использовалось полезное соотношение:
,
здесь использовалось полезное соотношение:![]() .
.
Связь давления, плотности газа и средней
квадратичной скорости следует (*):
![]()
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
![]() .
.
После подстановки явного выражения для
средней квадратичной скорости, получим:
![]() .
.
§ 29. Закон распределения молекул идеального газа по скоростям Максвелла.
Закон распределения молекул идеального
газа по скоростям определяет долевое
участие молекул однородного газа в
тепловом движении при данной температуре
со скоростями, заключёнными в интервале
от V доV
+V.
Он выведен теоретически: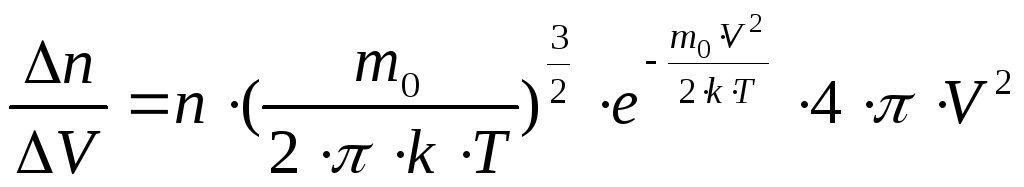 ,
,
где nчисло молекул в единице объёма (концентрация молекул),
n
число молекул из общего их числа,
скорости которых лежат в интервале
скоростей:![]() ,
,
m0масса одной молекулы,
kпостоянная Больцмана,
Tтемпература газа.
Чем меньше по величине выбирается интервал скоростей, тем более точный результат даёт данная формула.
Nв единицу объёма, которые[,+]
Графическая иллюстрация данной формулы приведена на графике зависимости относительной концентрации молекул n/Vидеального однородного газа от скорости

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Функцией распределения молекул идеального газа по скоростям Максвелла называется выражение:
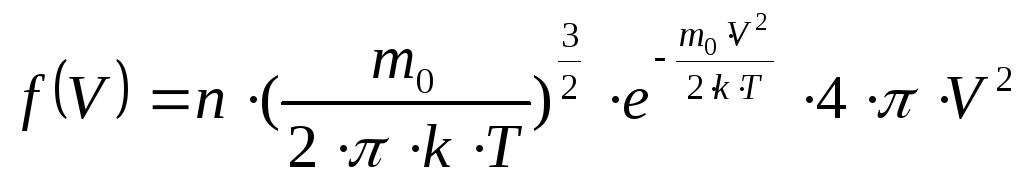 .
.
С помощью этой функции можно найти все статистически необходимые величины, характеризующие состояние идеального газа.
Вначале найдём наивероятнейшую скорость, т.е. значение скорости, соответствующее максимуму функции Максвелла. С точки зрения физики это такое значение скорости, к которому близки значения скорости большей части молекул. Воспользуемся методом нахождения экстремума функции, т.е. вначале возьмём производную от функции распределения Максвелла по скорости, а затем приравняем полученное выражение к нулю:
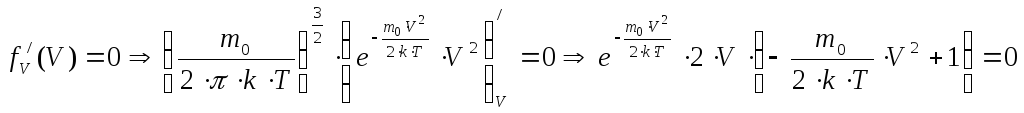 .
.
Последнее уравнение имеет три решения, т.к. необходимо равенство нулю каждого из множителей:
1.
![]() это не физический
случай;
это не физический
случай;
2.
![]() тривиальный случай;
тривиальный случай;
3.![]()
Средне квадратичную и средне арифметическую скорости находятся интегрированием:
![]() ,
,![]() .
.
