
- •1. Строение атома. Периодический закон
- •Количественные характеристики химических элементов
- •1.2. Модель Бора электронного строения атома водорода и водородоподобных ионов
- •1.3. Волны материи
- •1.4. Вероятностная модель строения атомов. Электронные и электронно-графические формулы атомов
- •1.5. Периодическая система химических элементов и закономерности изменения атомных характеристик элементов.
- •2. Химическая связь
- •Ионная модель химической связи. Поляризация ионов.
- •2.2 Теория кристаллического поля.
- •2.3. Метод валентных связей.
- •2.4. Метод молекулярных орбиталей
- •2.4.2. Металлическая связь. Зонная теория кристаллов.
- •2.5. Метод гипервалентных связей
- •2.6. Водородная связь
- •2.7. Межмолекулярное взаимодействие.
2.4. Метод молекулярных орбиталей
 Вметоде молекулярных
орбиталей (МО) химические соединения
рассматриваются как единая система,
состоящая из положительно
заряженных ядер и электронов атомов
химических элементов. Движение
каждого электрона в соединении в
эффективном электрическом
поле, создаваемом всеми ядрами и
электронами, описывается
одноэлектронными волновыми
функциями - молекулярными орбиталями,
имеющими многоцентровый (по числу
ядер) характер. Подобно
одноэлектронным АО в многоэлектронных
атомах, каждая МО характеризуется
индивидуальным набором квантовых
чисел, отражающих свойства электрона
в данном состоянии. Распределение
электронов по МО соответствует
принципам Паули – каждая МО может
содержать не более двух электронов
с противоположными спинами, минимума
энергии – в невозбужденном
соединении электроны заселяют МО
в последовательности повышения их
энергии и правила Хунда – минимальной
энергии соединения отвечает распределение
электронов по вырожденным МО,
соответствующее максимальному спину.
Вметоде молекулярных
орбиталей (МО) химические соединения
рассматриваются как единая система,
состоящая из положительно
заряженных ядер и электронов атомов
химических элементов. Движение
каждого электрона в соединении в
эффективном электрическом
поле, создаваемом всеми ядрами и
электронами, описывается
одноэлектронными волновыми
функциями - молекулярными орбиталями,
имеющими многоцентровый (по числу
ядер) характер. Подобно
одноэлектронным АО в многоэлектронных
атомах, каждая МО характеризуется
индивидуальным набором квантовых
чисел, отражающих свойства электрона
в данном состоянии. Распределение
электронов по МО соответствует
принципам Паули – каждая МО может
содержать не более двух электронов
с противоположными спинами, минимума
энергии – в невозбужденном
соединении электроны заселяют МО
в последовательности повышения их
энергии и правила Хунда – минимальной
энергии соединения отвечает распределение
электронов по вырожденным МО,
соответствующее максимальному спину.
При описании соединений методом МО используют следующие положения:
нахождение МО проводят на основе составления линейных комбинаций атомных орбиталей – приближение МО-ЛКАО. Число образующихся в соединении МО равно суммарному числу взаимодействующих АО;
при образовании МО учитывают только валентные АО составляющих соединение атомов – валентное приближение. Внутренние полностью заполненные электронами АО атомов локализованы вблизи своих ядер и не участвуют в образовании МO. В этом приближении число образующихся в соединении МО и заселяемых их электронов равно суммарному числу валентных АО и электронов, составляющих ее атомов с учетом общего электростатического заряда соединения;
в образовании МО участвуют АО, характеризующиеся с одной стороны – значительным перекрыванием своих электронных облаков (подходящие по симметрии), а с другой – не сильно отличающиеся по энергии;
в зависимости от характера распределения электронной различают МО: 1) по симметрии - на орбитали , и типа; 2) по энергии – на связывающие, разрыхляющие и несвязывающие. Связывающие МО характеризуются повышенной электронной плотностью в пространстве между ядрами и энергетически более выгодны, чем исходные АО. Электронная плотность разрыхляющих МО сконцентрирована за ядрами и понижена в пространстве между ними, что определяет повышение энергии таких МО по сравнению с АО. Энергия несвязывающих МО, в основном локализованных у того или иного атома, практически совпадает с энергией АО атома;
для отображения МО и характера распределения по ним электронов используют энергетические диаграммы и электронные молекулярные формулы соединений. Кратность многоцентровой химической связи данного атома с партнерами определяется соотношением: К = (Nсв.-Nразр.)/(2n), где Nсв. и Nразр. – число электронов на связывающих и разрыхляющих МО, n – число партнеров, взаимодействующих с атомом. Чем выше кратность связи, тем меньше длина и больше энергия разрыва связи.
Пример 1. Описать электронное строение, определить кратность связи и рассмотреть возможность существования следующих соединений элементов первого периода: H2+, H2, He2+ и He2.
Решение. Валентными орбиталями элементов 1 периода, участвующими в образовании МО, являются 1s-орбитали. В соответствии с приближением ЛКАО из двух исходных атомных волновых функций [s(1), s(2)] образуются 2 молекулярные волновые функции (+, -) и соответствующие им МО:

+ = c1s(1) + c2s(2) - = c3s*(1) - c4s(2)
Образование
МО +-
и --типа
приводит соответственно к
повышению и понижению
электронной плотностью в межъядерном
пространстве по сравнению с
исходными АО, что позволяет
отнести их к связывающей и разрыхляющей.
В тоже время, симметричное распределение
электронной плотности относительно
линии связи указывает на -тип
МО. Таким образом, образование
двухатомных гомоядерных соединений
из элементов I-го периода приводит
к образованию двух МО: -связывающей
(s),
заселение
электронами которой понижает
энергию (Е) системы, и -разрыхляющей
(*s),
п овышающей
энергию (Е*). Следует отметить, что,
несмотря на близость значений Е
и Е*, дестабилизация системы
[А2]z
(по сравнению с изолированными
атомами A) при заселении
электронами разрыхляющих
*s-орбиталей
несколько превышает выигрыш
в энергии при заселении связывающих
s-орбиталей,
то есть Е*>Е.
овышающей
энергию (Е*). Следует отметить, что,
несмотря на близость значений Е
и Е*, дестабилизация системы
[А2]z
(по сравнению с изолированными
атомами A) при заселении
электронами разрыхляющих
*s-орбиталей
несколько превышает выигрыш
в энергии при заселении связывающих
s-орбиталей,
то есть Е*>Е.
Электронное строение и основные характеристики химической связи для [A2]z соединений элементов I-го периода определяется распределением электронов в соответствии с принципами минимума энергии и Паули по двум МО - s, *s, число которых указывается в правом верхнем индексе МО при записи электронной формулы соединения: s)x(*s)y (x, y = 1, 2):
|
Соединение |
Электронная формула |
Кратность связи |
|
H2+ |
s)1(*s)0 |
0.5 |
|
H2 |
s)2(*s)0 |
1 |
|
He2+ |
s)2(*s)1 |
0.5 |
|
He2 |
s)2(*s)2 |
0 |
Таким образом, метод МО показывает существование не только молекулярного диводорода Н2 с единичной кратностью связи, но и менее устойчивых (К = 0.5) молекулярных ионов H2+ и Не2+. В тоже время, для молекулярного дигелия Не2 с одинаковым числом электронов на связывающих и разрыхляющих орбиталях (К = 0), выигрыш в энергии за счет заселения связывающих орбиталей меньше затрат энергии в результате заселения разрыхляющих орбиталей, что приводит к отрицательному значению энергии химической связи и указывает на самопроизвольный распад дигелия на атомарный гелий.
Пример 2. Описать электронное строение и определить кратность связи в двухатомных гомоядерных молекулах элементов 2 периода.
Решение. Валентными орбиталями элементов 2 периода, участвующими в образовании восьми МО, являются 2s и 2p (px, py, pz) орбитали. С точки зрения требований симметрии образование МО возможно при взаимодействии 2s-2s, 2s-2px, 2px-2px, 2py-2py, 2pz-2pz орбиталей:

Однако эффективность взаимодействия 2s-2px АО зависит от энергетического зазора между ними, величина которого увеличивается при увеличении заряда ядра химического элемента по периоду.
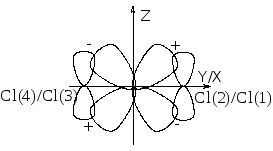
Для соединений элементов конца 2 периода (Ne, F, O), взаимодействием 2s-2px орбиталей можно пренебречь в результате существенного энергетического различия между ними. Взаимодействие 2s-2s и 2px-2px орбиталей партнеров приводит к образованию МО -типа (s, *s и x, *x), тогда как эквивалентные взаимодействия 2py-2py, 2pz-2pz орбиталей - к образованию двухкратно вырожденной МО -типа (y,z, *y,z).

Схема 3. Диаграмма МО двухатомных соединений
элементов начала (А) и конца (B) второго периода.
Для элементов начала периода (Li - N) уменьшение энергетического зазора между 2s-2p орбиталями приводит к соответствующему уменьшению энергетического различия между молекулярными *s и x орбиталями, распределение электронной плотности на которых сконцентрировано в одном и том же объеме пространства - по линии химической связи. Это определяет межэлектронное отталкивание, в результате которого энергия x орбиталей повышается и становится выше, чем энергия двухкратно вырожденных y,z орбиталей. Таким образом, различие в электронном строении соединений элементов начала и конца 2 периода связано с различием в энергетическом положении x и y,z орбиталей.
Характер распределения электронов по связывающим и разрыхляющим орбиталям определяет закономерное изменение кратности связи в соединениях:
|
Соединение |
Электронная формула |
Кратность связи |
|
Li2 |
s)2(*s)0(y,z)0(x)0(*y,z)0(*x)0 |
1 |
|
Be2 |
s)2(*s)2(y,z)0(x)0(*y,z)0(*x)0 |
0 |
|
B2 |
s)2(*s)2(y,z)2(x)0(*y,z)0(*x)0 |
1 |
|
C2 |
s)2(*s)2(y,z)4(x)0(*y,z)0(*x)0 |
2 |
|
N2 |
s)2(*s)2(y,z)4(x)2(*y,z)0(*x)0 |
3 |
|
O2 |
s)2(*s)2(x)2(y,z)4(*y,z)2(*x)0 |
2 |
|
F2 |
s)2(*s)2(x)2(y,z)4(*y,z)4(*x)0 |
1 |
|
Ne2 |
s)2(*s)2(x)2(y,z)4(*y,z)4(*x)2 |
0 |
Наряду с кратностью и энергией химической связи, метод МО позволяет охарактеризовать и другие важные характеристики химических соединений – например, энергию ионизации, оптические и магнитные свойства.
Пример 3. Обосновать характер изменения энергии ионизации (кДж/моль) при переходе от свободных атомов к двухатомным молекулам: а) О (1314) > O2 (1164); б) N (1402) < N2 (1503).
Решение. Величина энергия ионизации отражает энергетические затраты на удаление электрона с высшей заполненной молекулярной орбитали (ВЗМО) соединения. Повышение или понижение энергии ионизации в молекуле по сравнению со свободным атомом определяется связывающей или разрыхляющей природой ВЗМО. Поскольку энергия связывающих МО в химическом соединении ниже по сравнению с энергией исходных АО, то и энергия ионизации соединения, ВЗМО которого является связывающей, выше таковой для сводного атома. Если же ВЗМО является разрыхляющей, то энергия ионизация химического соединения меньше, чем атома.
Электронное строение молекул О2 (s)2(*s)2(x)2(y,z)4(*y,z)2 и N2 (s)2(*s)2(x)2(y,z)4 характеризуется разрыхляющей (*y,z)2 и связывающей (y,z)4 природой ВЗМО, что и приводит к соответствующему повышению и понижению энергии ионизации молекул по сравнению со свободными атомами.
Пример 4. Обосновать изменение окраски в ряду газообразных молекулярных галогенов: F2 – светло желтый, Cl2 – желто-зеленый, Br2 – красный, I2 – фиолетовый.
Решение. Окраску молекулярных галогенов, связанную с селективным поглощением квантов электромагнитного излучения видимой части спектра 400 750 нм, определяет энергетическое различие E между ВЗМО и низшей свободной молекулярной орбитали (НСМО). Если соединение в результате перехода электрона с ВЗМО на НСМО поглощает кванты определенной длины волны (hc/ = E), то визуально наблюдаемая окраска соединения соответствует квантам видимого света, оставшимися не поглощенными.
Молекулы галогенов Hal2, имеют подобное электронное строение (s)2(*s)2(x)2(y,z)4(*y,z)4(*x)0 и в результате увеличения главного квантового числа АО характеризуются закономерным уменьшением энергетического зазора между ВЗМО (*y,z) и НСМО (*x) в ряду: F2Cl2Br2I2. Это определяет увеличение длины волны поглощаемых молекулами галогенов квантов электромагнитного излучения и к соответствующему изменению окраски:
|
Цветовой круг | ||
|
Поглощение; , нм |
Окраска | |
|
Каждый (красный) |
750 – 650 |
Голубовато-зеленый |
|
Охотник (оранжевый) |
650 - 600 |
Зелено-голубой |
|
Желает (желтый) |
600 - 550 |
Фиолетово-голубой |
|
Знать (зеленый) |
550 -500 |
Пурпурный |
|
Где (голубой) |
500 - 470 |
Оранжево-красный |
|
Сидит (синий) |
470 - 440 |
Желтый |
|
Фазан (фиолетовый) |
440 - 400 |
Желто-зеленый |
Пример 5. Определить спиновую мультиплетность и охарактеризовать магнитные свойства соединений кислорода: О2, О2+ и О22+ в основном состоянии. При каком распределении электронов в возбужденном состоянии О2 характеризуется синглетной спиновой мультиплетностью?
Решение. В соответствии с правилом Хунда основному состоянию О2 (s)2(*s)2(x)2(y,z)4(*y,z)2(*x)0 отвечает наличие двух электронов с параллельными спинами на двухкратно вырожденных *y,z орбиталях, что определяет триплетный характер (2S+1) = 3 и парамагнитные свойства молекулы в основном состоянии. Синглетному (2S+1) = 1 возбужденному состоянию О2* (s)2(*s)2(x)2(y,z)4(*y,z)1(*x)1 соответствует распределение двух неспаренных электронов с антипараллельными спинами на (*y,z)1 и (*x)1 орбиталях.
Молекулярный ион О2+ (s)2(*s)2(x)2(y,z)4(*y,z)1(*x)0 характеризуется наличием одного неспаренного электрона на *y,z орбиталях и, следовательно, также обладает парамагнитными свойствами и дублетной (2S+1) = 2 спиновой мультиплетностью. Для иона О22+ (s)2(*s)2(x)2(y,z)4(*y,z)1(*x)0 все электроны спарены, что определяет его диамагнитные свойства и синглетную спиновую мультиплетность.
Специфической особенностью электронного строения гетероядерных соединений является смещение электронной плотности к более электроотрицательному партнеру АВ. Это приводит к появлению наряду с ковалентной составляющей определенной степени ионности химической связи. В отличие от гомоядерных соединений, валентные атомные орбитали атомов А и В, участвующие в образовании МО, имеют разную энергию – валентные орбитали более электроотрицательного атома (В) характеризуются повышенной стабильностью и, следовательно, являются более низкоэнергетическими по сравнению с орбиталями атома А. Это приводит к различному вкладу атомных орбиталей партнеров в связывающие и разрыхляющие молекулярные волновые функции и соответствующие им МО:
+ = c1А + c2В (с1<c2)
- = c3А – c4В (с3>c4)
Пример 6. Описать электронное строение гидрида лития и фтороводорода.
Решение. LiH - значения относительных электроотрицательностей: 1.0 (Li) и 2.1 (H) указывают на смещение электронной плотности в этом соединении от лития к водороду. Валентными орбиталями, которые по симметрии могут принимать участие в образовании МО, являются: 2s и 2px орбитали Li и 1s-орбиталь H; 2py и 2pz орбитали Li не перекрываются с 1s орбиталью атома H и образуют несвязывающие (ny,z) МО. Поскольку 1s орбиталь атома H энергетически более стабильна по сравнению с 2s орбиталью Li, то с учетом энергетического зазора между 2s и 2p орбиталями атома Li взаимодействием 2px(Li)-1s(H) можно пренебречь. Таким образом, 2px АО Li также является несвязывающей (nx) МО и в образовании -связывающей и *-разрыхляющей МО принимают участие в основном 2s орбиталь Li и 1s орбиталь H:
+() = c12s(Li) + c21s(H) (с1<c2)
-(*) = c32s(Li) – c41s(H) (с3>c4)
Различное значение коэффициентов перед атомными волновыми функциями показывает смещение электронной плотности на связывающей МО к атому H и на разрыхляющей МО к атому Li. Вклад ионной (Е1) и ковалентной (Е2) составляющих в общую энергию химической связи определяется энергетическим зазором между исходными АО и относительным понижением связывающей МО по сравнению с атомной орбиталью более электроотрицательного партнера.

Схема 4. Качественная диаграмма МО гидрида лития (A) и фтороводорода (B).
Таким образом, электронное строение гидрида лития характеризуется наличием 5 МО (схема 4А), на которых и распределяются два валентных электрона: (s)2(*s)0(nx,y,z)0. Кратность связи Li-H равна единице.
В отличие от LiH, в соединении водорода с более электроотрицательным (ЭО = 4.0) фтором HF - энергия валентных 2s и 2p орбиталей атомов F ниже по сравнению с энергией валентных 1s орбиталей атомов H. Это определяет существенное различие в энергетическом положении 1s(Н) и 2s(F) орбиталей и указывает на незначительное взаимодействие между ними. Таким образом, для HF в образовании -связывающей и *-разрыхляющей МО принимают участие 2px орбиталь F и 1s орбиталь H:
+() = c11s(Н) + c22p(F) (с1<c2)
-(*) = c31s(H) – c42p(F) (с3>c4)
Электронное строение фтороводорода (Схема 4B) описывается электронной формулой: (ns)2(s,px)2(ny,z)4(*s,px)0 с единичной кратностью связи Н-F и наличием трех несвязывающих электронных пар, преимущественно локализованных на 1s, 2py и 2pz АО фтора.
При построении системы МО и их наглядного представления в виде энергетических диаграмм для полиатомных [ALn]z (n > 2) химических соединений используется методический прием, основанный на рассмотрении взаимодействия валентных орбиталей центрального атома А не с валентными орбиталями лигандов L, а с эквивалентным им набором групповых орбиталей лигандов, которые наиболее эффективно взаимодействуют с орбиталями центрального атома. Это позволяет использовать для описания электронного строения многоатомных [ALn]z соединений двухфрагментную [AХ]z модель, содержащую центральный атомом А со своими валентными орбиталями и гипотетическую частицу X, характеризующуюся групповыми орбиталями. Групповые орбитали образуют в результате линейной комбинации валентных орбиталей лигандов в количестве, соответствующем числу орбиталей лигандов. Заселение электронами МО многоатомных соединений, полученных в результате взаимодействия валентных орбиталей центрального атома и групповых орбиталей лигандов, производят также как и для двухатомных [AB]z соединений.
Пример 7. Описать электронное строение линейных молекул гидрида бериллия и диоксида углерода и определить кратность связи Be-H, C-O.
Решение. В качестве координационного центра в BeH2 выступает атом Be с 2s и 2p валентными орбиталями; лигандами, участвующими в образовании групповых орбиталей, являются два атома водорода (H1 и H2) с 1s валентными орбиталями. Линейная комбинация двух 1s орбиталей H1 и H2 лигандов определяет образование двух эквивалентных им групповых орбиталей:
‘= 1s(H1) + 1s(H2)
‘’= 1s(H1) - 1s(H2)
В результате перекрывания 2s и 2px валентных орбиталей Be с ’- и ’’-групповыми орбиталями лигандов происходит образование двух связывающих и двух разрыхляющих трехцентровых МО -типа; 2py, и 2pz атомные орбитали бериллия образуют двухкратно вырожденную ny,z-несвязывающую МО:
![]()

(x)=c1(2px)+c2’’ (x*)=c3(2px)–c4’’

(s)=c1(2s)+c2’’ (s*)=c3(2s)–c4’’
(ny,z) = (py,z)
Схема 5. Качественная диаграмма МО гидрида бериллия.
Заполнение двух трехцентровых -связывающих МО BeH2 валентными электронами системы определяет (s)2(x)2(ny,z)0((*s)0(*x)0 электронную формулу соединения и единичную кратность [K = (4-0)/(22)] индивидуальной связи Be-H.
Молекула CO2 также является линейным трехатомным соединением. Однако, в отличие от BeH2, между центральным атомом C и двумя атомами О возможно образование МО не только , но и типа. Это связано с наличием у атомов О валентных 2py и 2pz орбиталей, способных к перекрыванию с 2py, 2pz орбиталями атома С и приводящих к образованию МО -типа.
Восемь валентных 2s и 2p орбиталей двух атомов О образуют два типа групповых орбиталей – двухкратно вырожденные (s):
’(s) = s(1) + s(2)
’’(s) = s(1) - s(2)
и шестикратно вырожденные (p):
’(p) = px,py,pz(1) + px,py,pz(2)
’’(p) = px,py,pz(1) - px,py,pz(2)
С точки зрения симметрии 12 МО молекулы СО2 могут быть образованы в результате следующих взаимодействий: 2s(C)-(s), 2px(C)-(s), 2s(C)-(p), 2px(C)-(p), 2py(C)-(p), 2pz(C)-(p). Однако, в результате существенного различия в энергетическом положении валентных 2s орбиталей атомов О и 2s, 2р орбиталей атома С взаимодействием с участием (s)-орбиталей можно пренебречь. Как следствие этого, 2s орбитали атомов О в молекуле CO2 остаются преимущественно локализованными на лигандах и образуют двухкратно вырожденную несвязывающую (ns) МО.
Взаимодействие групповых орбиталей атомов О (р)-типа с 2s и 2p валентными орбиталями атома С приводит к образованию трехцентровых МО - и -типа: s, *s, x, *x, y,z, *y,z, а также двухцентровых несвязывающих ny,z-МО, преимущественно локализованных на атомах кислорода:

Схема 6. Качественная диаграмма МО диоксида углерода.
Распределение 16 электронов по МО приводит к молекулярной электронной формуле СО2 (ns)4((s)2(x)2(y,z)4(ny,z)4(*y,z)0(*s)0 и определяет двухкратность [K = (8-0)/(22) = 2] отдельной связи C=O.
Пример 9. Описать электронное строение молекул бороводорода BH3 и фторида бора BF3 и определить кратность связей B-H и B-F.
Решение. Молекула BH3 имеет структуру плоского треугольника. В результате взаимодействия 2s и 2p орбиталей центрального атома бора с тремя групповыми орбитали атомов водорода:
’ = (H1) + (H2) + (H3),
’’ = (H1) - (H2) - (H3),
’’’ = (H2) - (H3)
образуются семь МО:
(s) = c1(2s) + c2’,
(*s) = c3(2s) – c4’,
(x,y) = c5(2px,y) + c6’’,
(*x,y) = c7(2px,y) – c8’,
(n) = (2pz),
6 из которых являются четырехцентровыми орбиталями -типа и 1 несвязывающая орбиталь, локализованная на атоме бора (схема 8А).
Заполнение 3 четырехцентровых -связывающих МО бороводорода 6 валентными электронами системы определяет электронную формулу (s)2(x,y)4(nz)0((*x,y)0(*s)0 BH3 и единичную кратность индивидуальной связи B-H [K = (6-0)/(22)].

Схема 8. Качественная диаграмма МО гидрида бора (А) и фторида бора (B).
Подобно BH3, молекула BF3 также имеет структуру плоского треугольника. Однако присутствие у атомов фтора 2р орбиталей определяет наличие в молекуле BF3 МО не только -, но и -типа. Значительное энергетическое различие между валентными 2s и 2р орбиталями B и 2s орбиталями атомов F позволяет пренебречь их взаимодействием и рассматривать 2s орбитали F в качестве несвязывающих (ns) трехкратно вырожденных МО. Оставшиеся 2р-орбитали трех атомов F образуют девятикратно вырожденные (p) групповые орбитали лигандов, взаимодействие которых с 2s и 2p орбиталями бора приводит к образованию восьми четырехцентровых связывающих и разрыхляющих МО: s, s*, x, x*, y, y*, z, z* и пяти несвязывающих (np) МО, локализованных на атомах фтора (схема 8B). Распределение 24 электронов (3 от атома В и по 7 от каждого из атомов F) по МО определяет (ns)6(s)2(x,y)4(z)2(np)10(z*)0(*x,y)0(*s)0 электронную формулу BF3 с дробным значением кратности индивидуальной связи B-F: K = (8-0)/(23) = 11/3.
Пример 10. Описать электронное строение молекул метана CH4, аммиака NH3 и воды H2O. Охарактеризовать природу ВЗМО и определить кратность связей C-H, N-H и O-H.
Решение. Молекула CH4 имеет тетраэдрическое строение: центральный атом углерода находится в центре куба, а атомы водорода – в его противолежащих вершинах. Начало координат совместим с центром куба, а оси x, y, z направим перпендикулярно его граням.
Взаимодействие 2s и 2р валентных орбиталей углерода с четырьмя (s)групповыми орбиталями атомов водорода:
’ = (H1) + (H2) + (H3) + (H4),
’’ = (H1) + (H2) - (H3) - (H4),
’’’ = (H1) - (H2) + (H3) - (H4),
’’’’ = (H1) - (H2) - (H3) + (H4)
приводит к образованию восьми делокализованных по всей молекуле пятицентровых МО: s-связывающей, *s-разрыхляющей и трехкратно вырожденных x,y,z-связывающей и *x,y,z-разрыхляющей:



Наличие 8 валентных электронов определяет электронную формулу (s)2(x,y,z)4(*x,y,z)0(*s)0 метана с однократной связью C-H [K = (4-0)/(24) = 1]. Делокализованный пятицентровый характер всех МО в молекуле метана указывает как на эквивалентность всех атомов водорода, так и на повышенную устойчивость соединения. В тоже время, поскольку валентные электроны располагаются как на x,y,z, выступающих в качестве ВЗМО, так и на более энергетически стабильных s орбиталях, то молекула метана характеризуется наличием двух различных по величине первых потенциалов ионизации, соответствующих удалению электрона с x,y,z и s МО.
Уменьшение числа атомов водорода в составе молекул CH4NH3H2O с одной стороны приводит к закономерному изменению структуры молекул: тетраэдрическаятригонально-пирамидальнаяугловая, а с другой - к уменьшению числа групповых орбиталей атомов водорода (432), взаимодействующих с валентными 2s и 2р орбиталями центрального атома, и, следовательно, к уменьшению как общего числа молекулярных орбиталей (876), так и орбиталей (864). Различие в общем числе молекулярных орбиталей и орбиталей -типа указывает на наличие у молекул NH3 и H2O соответственно одной и двух несвязывающих МО, локализованных на р-орбиталях центрального атома (схема 10).
С учетом 8 валентных электронов электронное строение молекул аммиака и воды описывается электронными формулами: NH3 (s)2(x,y)4(nz)2(*x,y)0(*s)0 и H2O (s)2(x)2(nz,y)4(*x)0(*s)0. Обе молекулы характеризуются - единичной кратностью индивидуальных связей N-H (K = (6-0)/(23) = 1) и O-H (K = (6-0)/(23) = 1), несвязывающим характером ВЗМО, преимущественно локализованных на центральном атоме азота и кислорода, и многоцентровыми делокализованными по всей молекуле МО -типа.

А Б
Схема 10. Диаграмма МО молекул аммиака (А) и воды (Б).
У пражнения:
пражнения:
Привести молекулярные электронные формулы, определить – кратность связи, спиновую мультиплетность и магнитные свойства, и установить какие из следующих молекулярных ионов не могут существовать с позиций метода МО: а) Н2+, б) Н2-, в) Не2+, г) Не2- , д) ННе+, е) ННе-?
Описать электронное строение, определить - кратность связи, спиновую мультиплетность и магнитные свойства, а также характер изменения энергии и длины связи в ряду соединений кислорода: а) O22-, б) О2-, в) О2.
Как и почему изменяется энергия и длина химической связи при переходе от молекулы С2 к ацетиленид-иону C22-? Какие из двухатомных молекул элементов 2 периода являются изоэлектронными с С22--ионом?
Сопоставьте описание электронного строения молекулы О2 методами ВС и МО. Какой из методов согласуется с экспериментальными данными о магнитных свойствах О2? Какому состоянию – основному или возбужденному – соответствует триплетное и синглетное состояние молекулы кислорода? Приведите энергетические диаграммы МО для триплетного и синглетного молекулярного кислорода.
Обосновать характер изменения энергии ионизации (эВ) при переходе от свободных атомов к двухатомным молекулам: а) F (17.4) > F2 (15.7); б) N (14.5) < N2 (15.6).
Сгруппируйте перечисленные частицы - B2, C2, N2, O2, BС, BN, BO, BF, CO, CN, СО, NO - а) на изоэлектронные системы, б) парамагнитные в) диамагнитные.
Как и почему изменяется кратность и энергия связи Э-Н в ряду: а) LiH+ LiH LiH-; б) HF+ HF HF-? Приведите энергетические диаграммы МО молекул LiH и HF и отобразите на них ионную и ковалентную составляющую химической связи. Вклад какой из взаимодействующих атомных орбиталей - а) 2s орбитали Li и 1s H, б) 2p орбитали F и 1s H – больше в молекулярные волновые функции для связывающих и разрыхляющих МО?
Постройте и обоснуйте различие в энергетических диаграммах МО для следующих изоэлектронных двухатомных молекул: BF, CO, N2.
Опишите электронное строение линейной молекулы BeF2 – определите групповые орбитали лигандов и изобразите их взаимодействие с валентными орбиталями бериллия с образованием МО; приведите энергетическую диаграмму МО, молекулярную электронную формулу и определите кратность индивидуальной связи Be–F.
Как и почему изменяется кратность и энергия связи для молекулярных ионов CO2+ и СО2- по сравнению с молекулой СО2?
Опишите электронное строение изоэлектронных с молекулой BF3 – карбонат- и нитрат-ионов; приведите качественную энергетическую диаграмму их МО, электронную формулу и охарактеризуйте кратность индивидуальных связей C-O и N-O.
Обоснуйте увеличение средней энергии связи при переходе от BH3 (389 кДж/моль) к BF3 (644 кДж/моль).
Опишите электронное строение тетраэдрического иона [BH4]- - определите групповые орбитали лигандов и изобразите их взаимодействие с валентными орбиталями бора с образованием МО; приведите энергетическую диаграмму МО, молекулярную электронную формулу и определите кратность индивидуальной связи B –Н.
4.1. Теория поля лигандов
 Специфической
особенностью электронного строения
комплексных соединений переходных
элементов является участие в
образовании химических связей не
только валентных сферически
симметричных s- и локализованных
по осям координат гантелеобразных
p-орбиталей, но и трехмерно
делокализованных d-орбиталей. Это
определяет преимущества
описания электронного строения
комплексных соединений на
основе метода МО по сравнению с
другими моделями химической связи
– метода ВС, ионной модели, ТКП.
Специфической
особенностью электронного строения
комплексных соединений переходных
элементов является участие в
образовании химических связей не
только валентных сферически
симметричных s- и локализованных
по осям координат гантелеобразных
p-орбиталей, но и трехмерно
делокализованных d-орбиталей. Это
определяет преимущества
описания электронного строения
комплексных соединений на
основе метода МО по сравнению с
другими моделями химической связи
– метода ВС, ионной модели, ТКП.
Рассмотрим электронное строение октаэдрических комплексов d-переходных металлов с -связями метал-лиганд – например, аммиакатов [M(NH3)6]z+. Валентными орбиталями центрального иона металла Mz+ являются (n-1)d-, ns- и np-орбитали, содержащие q электронов (q = 1-9). Шесть молекул NH3, выступающих в качестве -донорных лигандов, характеризуется наличием электронной пары на sp3-гибридной орбитали донорного атома азота. Таким образом, в образовании МО комплекса участвуют 15 [9(Mz+) + 6(NH3)] исходных орбиталей, содержащих (q+12) электронов.
Октаэдрическое строение комплекса определяет расположение лигандов на осях декартовой системы координат и образование из 6 sp3-гибридных орбиталей атомов азота (1, 2, 3, 4, 5, 6) в результате их линейных комбинаций эквивалентных 6 групповых орбиталей (I, II, III, IV, V, VI), наиболее эффективно перекрывающихся с валентными орбиталями иона металла.
 Сферически
симметричная ns-орбиталь металла
эффективно перекрывается со всеми
шестью -орбиталями
лигандов, приводя к образованию
связывающей и разрыхлящей МО (s,
s):
Сферически
симметричная ns-орбиталь металла
эффективно перекрывается со всеми
шестью -орбиталями
лигандов, приводя к образованию
связывающей и разрыхлящей МО (s,
s):
s) = c1(4s) + c2I *s) = c3(4s) – c4I
I =1+2+3+4+5+6
 Ориентированные
вдоль осей координат nр-орбитали
взаимодействуют только
с орбиталями лигандов, находящимися
на соответствующих осях x, y
и z, что приводит к образованию
трехкратно вырожденных
связывающих и разрыхляющих МО
(x,
x,
y,
y,
z,
z):
Ориентированные
вдоль осей координат nр-орбитали
взаимодействуют только
с орбиталями лигандов, находящимися
на соответствующих осях x, y
и z, что приводит к образованию
трехкратно вырожденных
связывающих и разрыхляющих МО
(x,
x,
y,
y,
z,
z):
y) = c5(4py) + c6II
*y) = c7(4py) – c8II
II = 2 - 4
x) = c5(4px) + c6III
*x) = c7(4px) – c8III
III = 1 - 3

z) = c5(4pz) + c6IV
*z) = c7(4px) – c8IV
IV = 5 - 6
 Среди пятикратно
вырожденных (n-1)d-валентных орбиталей
иона металла перекрываются с орбиталями
лигандов только dz2
и dx2-y2
орбитали, приводя к образованию
двухкратно вырожденных связывающих
и разрыхляющих МО (dz2,
*dz2,
dx2-y2,
*dx2-y2):
Среди пятикратно
вырожденных (n-1)d-валентных орбиталей
иона металла перекрываются с орбиталями
лигандов только dz2
и dx2-y2
орбитали, приводя к образованию
двухкратно вырожденных связывающих
и разрыхляющих МО (dz2,
*dz2,
dx2-y2,
*dx2-y2):
dz2) = c9(4dz2) + c10V
*dz2) = c11(4dx2) – c12V
V=25+26-1-23-4

(dx2-y2) = c11(4dx2-y2) + c12VI
(dx2-y2) = c13(4dx2-y2) - c14VI
VI = 1 + 2 3 - 4
Три d-орбитали (dxy, dzy, dzx), не перекрывающиеся с орбиталями лигандов, образуют трехкратно вырожденные несвязывающие МО (nxy, nzy, nzx):

(nzy) = (dzy) (nzx) = (dzx) (nxy) = (dxy)
 Таким образом,
электронное строение октаэдрических
[M(NH3)6]z+
комплексов
описывается системой из 12
делокализованных семицентровых
МО и 3 несвязывающих МО, локализованных
на Mz+
ионе. Различие в энергетическом
положении валентных орбиталей
центрального иона металла и
групповых орбиталей лигандов
определяет различный вклад исходных
волновых функций в МО и, следовательно,
преимущественную локализацию
МО на металле или лигандах. Как
видно из схемы 11, -связывающие
МО преимущественно локализованы
на лигандах, тогда как
*-разрыхляющие
– на металле.
Таким образом,
электронное строение октаэдрических
[M(NH3)6]z+
комплексов
описывается системой из 12
делокализованных семицентровых
МО и 3 несвязывающих МО, локализованных
на Mz+
ионе. Различие в энергетическом
положении валентных орбиталей
центрального иона металла и
групповых орбиталей лигандов
определяет различный вклад исходных
волновых функций в МО и, следовательно,
преимущественную локализацию
МО на металле или лигандах. Как
видно из схемы 11, -связывающие
МО преимущественно локализованы
на лигандах, тогда как
*-разрыхляющие
– на металле.
Схема 11. Диаграмма МО октаэдрических
комплексов с с связями метал-лиганд.
Как и в ТКП (раздел 2.2), для обозначения молекулярных орбиталей комплексных соединений часто используют символы, указывающие на степень вырождения и симметрию МО. Для обозначения невырожденных, двухкратно и трехкратно вырожденных МО используют символы – «a», «e» и «t». Для симметричных и антисимметричных относительно главной оси симметрии комплекса МО используют нижние индексы – «g» и «u». Симметрию МО относительно других осей симметрии комплекса указывают цифрами – «1» и «2» в нижнем индексе. Так, связывающая и разрыхляющая s МО относятся к «a1g» и «a*1g» типу, двухкратно вырожденные x2-y2,z2, x2-y2,z2 образуют МО «eg, e*g» типа, а трехкратно вырожденные x,y,z, *x,y,z и nxy,xz,yz орбитали - «t1u, t*1u» и «t2g» типа.
Распределение (12 + q) электронов по МО комплекса в соответcтвии с принципом Паули и минимума энергии определяет общую электронную формулу октаэдрических комплексов [M(NH3)6]3+: (a1g)2(t1u)6(eg)4(t2g)x(e*g)y (x+y = q). Таким образом, электронное строение комплексов независимо от природы центрального иона металла характеризуется наличием 12 электронов на -связывающих орбиталях, преимущественно локализованных на лигандах. В тоже время, заполнение более высоколежащих – несвязывающих (t2g) и разрыхляющих (e*g) орбиталей, преимущественно локализованных на металле, зависит как от числа электронов иона металла, так и от энергетического зазора между t2g и e*g орбиталями. Так, для q = 1, 2, 3 минимальной энергии комплекса соответствуют электронные конфигурации, отвечающие последовательному заполнению электронами несвязывающих t2g орбиталей в соответствии с правилом Хунда – (t2g)1, (t2g)2, (t2g)3. Однако, при q = 4, 5, 6, 7 в зависимости от соотношения величины энергетического зазора и энергии межэлектронного отталкивания (E) минимуму энергии системы отвечают две различные электронные конфигурации, соответствующие низкоспиновым и высокоспиновым комплексам. Если > E, то происходит дальнейшее заполнение электронами t2g орбиталей до их полного насыщения – (t2g)4, (t2g)5, (t2g)6 и только после этого заселение разрыхляющих e*g орбиталей, приводя для q = 7 к электронной конфигурации (t2g)6(e*g)1. При обратном соотношении: < E, для q = 4, 5 в соответствии с правилом Хунда происходит последовательное заполнение электронами разрыхляющих e*g орбиталей – (t2g)3(e*g)1, (t2g)3(e*g)2 и только для q = 6, 7 происходит дальнейшее заполнение t2g орбиталей – (t2g)4(e*g)2, (t2g)5(e*g)2. Для q = 8 и 9 минимальной энергии комплекса соответствуют электронные конфигурации – (t2g)6(e*g)2 и (t2g)6(e*g)3.
 Сравнение
полученных результатов с описанием
электронного строения
октаэдрических комплексов в
рамках метода ВС и ТКП
показывает, что метод МО дает
наиболее общий подход, включая
метод ВС и ТКП как частные случаи.
Шести электронным парам
на связывающих s,
x,y,z
и x2-y2,z2
МО в рамках метода ВС отвечает
шесть донорно-акцепторных
-связей
с участием d2sp3
гибридных орбиталей
металла. В тоже время, несвязывающие
nxy,xz,yz
и разрыхляющие *x2-y2,z2
МО соответствуют расщепленным
в октаэдрическом поле
лигандов dxy,xz,yz
(t2g)
и dx2-y2,z2
(eg)
орбиталям металла.
Сравнение
полученных результатов с описанием
электронного строения
октаэдрических комплексов в
рамках метода ВС и ТКП
показывает, что метод МО дает
наиболее общий подход, включая
метод ВС и ТКП как частные случаи.
Шести электронным парам
на связывающих s,
x,y,z
и x2-y2,z2
МО в рамках метода ВС отвечает
шесть донорно-акцепторных
-связей
с участием d2sp3
гибридных орбиталей
металла. В тоже время, несвязывающие
nxy,xz,yz
и разрыхляющие *x2-y2,z2
МО соответствуют расщепленным
в октаэдрическом поле
лигандов dxy,xz,yz
(t2g)
и dx2-y2,z2
(eg)
орбиталям металла.
Пример 1. Описать электронное строение, определить кратность индивидуальной связи метал-лиганд и спиновую мультиплетность для октаэдрических аквакомплексов Cr(III) и Co(II). Какой комплекс более устойчив?
Решение. Валентные орбитали Cr(III) 3d34s04p0 и Co(II) 3d74s04p0 соответственно 3 и 7 электронов. Шесть молекул воды, выступающих в качестве -донорных лигандов, предоставляют 6 электронных пар на sp3-гибридной орбитали донорного атома кислорода. Таким образом, в образовании МО аквакомплексов [M(H2O)6]z+ участвуют 15 [9(Mz+) + 6(H2O)] исходных орбиталей, содержащих 12+3 и 12+7 электронов соответственно для Mz+ = Cr(III) и Co(III).
Поскольку вода является лигандом слабого поля, то аквакомплексы Cr(III) и Co(III) являются высокоспиновыми и распределение электронов по 12 делокализованным МО -типа (s, *s, x,y,z, *x,y,z, x2-y2,z2, x2-y2,z2) и 3 локализованным на металле несвязывающим (nxy,xz,yz)МО происходит в соответствии с правилом Хунда: [Cr(H2O)6]3+ (s)2(x,y,z)6(x2-y2,z2)4(nxy,xz,yz)3(*s)(*x,y,z)0, [Co(H2O)6]2+ (s)2(x,y,z)6(x2-y2,z2)4(nxy,xz,yz)5(x2-y2,z2)2(*s)(*x,y,z)0. Оба комплекса содержат 3 неспаренных электрона, характеризуются величиной спиновой мультиплетности (2S+1) равной 4 и являются парамагнитными. Величина кратности связи Cr-OH2 составляет К=(12-0)/(26) = 1, тогда как для Co-OH2 в результате заселения x2-y2,z2 разрыхляющих МО кратность связи понижена К = (12-2)/ (26) = 5/6, что указывает на более низкую устойчивость [Co(H2O)6]2+ по сравнению с [Cr(H2O)6]3+.
Качественное согласие как характера «расщепления» пятикратно вырожденных 3d-орбиталей центрального иона металла на t2g и eg орбитали, разделенных энергетическим зазором , так и распределения электронов между ними, приводящим к существованию низкоспиновых и высокоспиновых комплексов показывает, что в рамках метода МО могут быть использованы основные параметры ТКП (параметр расщепления кристаллическим полем, энергия стабилизации кристаллическим полем, спектрохимический ряд лигандов), а также справедливость ранее рассмотренных приложений ТКП для описания свойств комплексов. Такой подход, основанный на сочетании метода МО и ТКП для описания электронного строения комплексов, получил название теория поля лигандов (ТПЛ). Сохраняя все достоинства ТКП, теория поля лигандов позволяет получить более строгое и полное описание электронного строения комплексов. Так, ТПЛ показывает, что характер химической связи в комплексных соединениях связан не только с ион-ионным или ион-дипольным взаимодействием между центральным ионом и лигандами, но и с определенной ковалентной составляющей. Это приводит к перераспределению электронной плотности между ионом металла и лигандами и образованию связывающих и разрыхляющих МО. Как следствие этого, «расщепленные» в рамках ТКП d-орбитали металла, в ТПЛ являются молекулярными орбиталями и имеют смешанный металл-лигандный характер – dx2-y2,z2 орбитали металла участвуют в образовании МО -типа, а dxy,xz,yz могут участвовать в образовании MO -типа.
В комплексных соединениях между лигандами и центральным ионом металла, наряду с донорно-акцепторным взаимодействием ML, возможны два типа взаимодействия с участием dxy,xz,yz орбиталей металла:

донорно-акцепторное и дативное.
В этом случае к МО-
и *-типа
(схема 11) добавляются МО -
и *-типа.
Лиганды -доноры
характеризуются наличием низкоэнергетических
заполненных электронами орбиталей
-типа,
которые в результате взаимодействия
с более высокоэнергетическими
dxy,xz,yz
орбиталями металла приводят к
образованию трехкратно вырожденных
связывающих t2g
МО, преимущественно локализованных
на лигандах, и разрыхляющих t*2g
МО, в основном локализованных на
металле. Наоборот, -акцепторные
лиганды, характеризуются наличием
свободных орбиталей
-типа,
взаимодействие которых с более
низкоэнергетическими dxy,xz,yz
орбиталями металла приводит к образованию
связывающих t2g
МО, преимущественно локализованных
на металле, и разрыхляющих t*2g
МО, в основном локализованных
на лигандах.
этом случае к МО-
и *-типа
(схема 11) добавляются МО -
и *-типа.
Лиганды -доноры
характеризуются наличием низкоэнергетических
заполненных электронами орбиталей
-типа,
которые в результате взаимодействия
с более высокоэнергетическими
dxy,xz,yz
орбиталями металла приводят к
образованию трехкратно вырожденных
связывающих t2g
МО, преимущественно локализованных
на лигандах, и разрыхляющих t*2g
МО, в основном локализованных на
металле. Наоборот, -акцепторные
лиганды, характеризуются наличием
свободных орбиталей
-типа,
взаимодействие которых с более
низкоэнергетическими dxy,xz,yz
орбиталями металла приводит к образованию
связывающих t2g
МО, преимущественно локализованных
на металле, и разрыхляющих t*2g
МО, в основном локализованных
на лигандах.
-доноры -акцепторы
Схема 13. Влияние -связывания на величину в октаэдрических комплексах
 Таким
образом, ТПЛ показывает, что влияние
лигандов на величину
и, следовательно, их положение в
спектрохимическом ряду определяется
как ,
так и -свойствами
лигандов: -донорные
свойства лигандов определяют положение
e*g
орбиталей (схема 11), тогда как
-донорно-акцепторные
свойства – положение t2g
орбиталей (схема 13). Если лиганды обладают
только -донорными
свойствами dxy,xz,yz
орбитали центрального атома не
перекрываются с орбиталями
лигандов и образуют несвязывающие t2g
МО. Однако лиганды, характеризующиеся,
наряду с -донорными
свойствами, наличием заполненных,
или свободных орбиталей -типа,
эффективно взаимодействуют
с dxy,xz,yz
орбиталями центрального атома,
в результате чего несвязывающие
t2g
орбитали металла трансформируются либо
в разрыхляющие более высоко лежащие
t*2g
орбитали для -донорных
лигандов, либо в связывающие более
низко лежащие t2g
орбитали для -акцепторных
лигандов. Именно совместный характер
-
и -взаимодействия
лигандов с металлом определяет их
положение в спектрохимическом
ряду:
Таким
образом, ТПЛ показывает, что влияние
лигандов на величину
и, следовательно, их положение в
спектрохимическом ряду определяется
как ,
так и -свойствами
лигандов: -донорные
свойства лигандов определяют положение
e*g
орбиталей (схема 11), тогда как
-донорно-акцепторные
свойства – положение t2g
орбиталей (схема 13). Если лиганды обладают
только -донорными
свойствами dxy,xz,yz
орбитали центрального атома не
перекрываются с орбиталями
лигандов и образуют несвязывающие t2g
МО. Однако лиганды, характеризующиеся,
наряду с -донорными
свойствами, наличием заполненных,
или свободных орбиталей -типа,
эффективно взаимодействуют
с dxy,xz,yz
орбиталями центрального атома,
в результате чего несвязывающие
t2g
орбитали металла трансформируются либо
в разрыхляющие более высоко лежащие
t*2g
орбитали для -донорных
лигандов, либо в связывающие более
низко лежащие t2g
орбитали для -акцепторных
лигандов. Именно совместный характер
-
и -взаимодействия
лигандов с металлом определяет их
положение в спектрохимическом
ряду:

-доноры, -доноры -доноры,
-акцепторы -доноры
Пример 2. Описать электронное строение, определить кратность связи метал-лиганд и охарактеризовать магнитные свойства комплексов Co(III): а) [CoF6]3-, б) [Co(CN)6]3-.
Решение. А) образование МО комплекса [CoF6]3- происходит в результате взаимодействия 9 валентных орбиталей иона Co(III) 3d64s04p0 и 18 валентных 2р6 орбиталей ионов F-. Вследствие значительного энергетического различия между валентными орбиталями Co(III) и 2s орбиталями F- их участием в образовании МО можно пренебречь. Таким образом, электронное строение [CoF6]3- характеризуется наличием 27 МО, на которых распределены 42 электрона.
 Октаэдрическое
строение комплекса определяет расположение
лигандов на осях декартовой системы
координат и образование из 18 2р-валентных
орбиталей ионов F-
двух типов групповых орбиталей – 6
орбиталей -типа,
ориентированных по осям координат
и наиболее эффективно перекрывающихся
с 4s, 4p, 3dx2-y2
и 3dz2
орбиталями иона Co(III), и 12 групповых
орбиталей -типа,
ориентированных перпендикулярно
осям координат и взаимодействующих
с 3dxy,xz,yz
орбиталями Co(III). Перекрывание 6
групповых орбиталей лигандов -типа
с 6 валентными орбиталями (4s, 4p, 3dx2-y2,
3dz2)
Co(III) приводит к образованию 12
МО (s,
*s,
x,y,z,
*x,y,z,
x2-y2,z2,
x2-y2,z2)
-типа.
Поскольку каждая из 3dxy,xz,yz
орбиталей иона Co(III) перекрывается
с четырьмя АО лигандов -типа,
то в результате взаимодействия 12
групповых
орбиталей лигандов с 3dxy,xz,yz
орбиталями
Co(III) образуются 15 МО – две
делокализованных трехкратно
вырожденных xy,xz,yz-связывающих,
*xy,xz,yz-разрыхляющих
и 9 несвязывающих np
МО, локализованных на лигандах.
Октаэдрическое
строение комплекса определяет расположение
лигандов на осях декартовой системы
координат и образование из 18 2р-валентных
орбиталей ионов F-
двух типов групповых орбиталей – 6
орбиталей -типа,
ориентированных по осям координат
и наиболее эффективно перекрывающихся
с 4s, 4p, 3dx2-y2
и 3dz2
орбиталями иона Co(III), и 12 групповых
орбиталей -типа,
ориентированных перпендикулярно
осям координат и взаимодействующих
с 3dxy,xz,yz
орбиталями Co(III). Перекрывание 6
групповых орбиталей лигандов -типа
с 6 валентными орбиталями (4s, 4p, 3dx2-y2,
3dz2)
Co(III) приводит к образованию 12
МО (s,
*s,
x,y,z,
*x,y,z,
x2-y2,z2,
x2-y2,z2)
-типа.
Поскольку каждая из 3dxy,xz,yz
орбиталей иона Co(III) перекрывается
с четырьмя АО лигандов -типа,
то в результате взаимодействия 12
групповых
орбиталей лигандов с 3dxy,xz,yz
орбиталями
Co(III) образуются 15 МО – две
делокализованных трехкратно
вырожденных xy,xz,yz-связывающих,
*xy,xz,yz-разрыхляющих
и 9 несвязывающих np
МО, локализованных на лигандах.
В результате небольшого значения распределение 42 электронов по МО происходит в соответствии с правилом Хунда, что определяет высокоспиновый характер и парамагнитные свойства комплекса [CoF6]3- (s)2(x,y,z)6(x2-y2,z2)4 (xy,xz,yz)6(np)18(*xy,xz,yz)4(x2-y2,z2)2(*s)0(*x,y,z)0. В соответствии с числом электронов на связывающих и разрыхляющих МО кратность отдельной Co-F связи К=(18-8)/(26)=5/6.

Схема 14. Качественная диаграмма МО комплексов [CoF6]3- и [Co(CN)6]3-.
Б ).
В отличие от фторидных лигандов,
характеризующихся-
и -донорными
свойствами, CN-
ионы являются -донорными
и -акцепторными
лигандами. Это связано с наличием
у CN-
[(s)2(*s)2(x)2(y,z)4
(*yz)0(*x)0]
относительно низкоэнергетических
свободных *yz-орбиталей,
способных к перекрыванию с dxy,xz,yz
орбиталями иона металла. Из шести
*yz-орбиталей
лигандов образуются 6 групповых
орбиталей -типа,
взаимодействие которых с dxy,xz,yz
орбиталями иона Co(III) определяет
образование 9 МО: трехкратно
вырожденных xy,xz,yz-связывающих,
*xy,xz,yz-разрыхляющих
и несвязывающих np.
).
В отличие от фторидных лигандов,
характеризующихся-
и -донорными
свойствами, CN-
ионы являются -донорными
и -акцепторными
лигандами. Это связано с наличием
у CN-
[(s)2(*s)2(x)2(y,z)4
(*yz)0(*x)0]
относительно низкоэнергетических
свободных *yz-орбиталей,
способных к перекрыванию с dxy,xz,yz
орбиталями иона металла. Из шести
*yz-орбиталей
лигандов образуются 6 групповых
орбиталей -типа,
взаимодействие которых с dxy,xz,yz
орбиталями иона Co(III) определяет
образование 9 МО: трехкратно
вырожденных xy,xz,yz-связывающих,
*xy,xz,yz-разрыхляющих
и несвязывающих np.
Подобно комплексу [CoF6]3-, образование 12 МО (s, *s, x,y,z, *x,y,z, x2-y2,z2, x2-y2,z2) -типа происходит в результате взаимодействия 6 групповых орбиталей лигандов -типа с 3dx2-y2,z2-, 4s- и 4p-орбиталями иона Co(III). Таким образом, электронное строение комплекса [Co(CN)6]3- характеризуется образованием 21 МО (схема 14), на которых распределены 18 электронов – 6 от иона Co(III) и по 2 от каждого из шести лигандов. Дативное CoCN -взаимодействие определяет увеличение параметра что приводит к низкоспиновому характеру распределения электронов на xy,xz,yz- и x2-y2,z2-орбиталях [Co(CN)6]3- комплекса: (s)2(x,y,z)6(x2-y2,z2)4(xy,xz,yz)6(x2-y2,z2)0(np)0 (*xy,xz,yz)0(*s)0(*x,y,z)0 и его диамагнитным свойствам. В соответствии с числом электронов на связывающих и разрыхляющих МО кратность индивидуальной связи Co-CN равна К = (18-0)/(26) = 11/2.
Наряду с октаэдрическими, для переходных металлов характерно также образование тетраэдрических и плоскоквадратных комплексов. Причем, тетраэдрические комплексы являются высокоспиновыми и характерны для 3d-металлов с лигандами слабого поля, характеризующихся донорными -свойствами.
 В
тетраэдрическихкомплексах 3d-металлов
типа TiCl4,
VCl4,
[CrO4]2-
[MnO4]-
в образовании химических связей принимают
участие 21 атомная орбиталь:
3d-, 4s- и 4p-орбитали иона металла,
содержащие q электронов, и 12 АО
лигандов (по 3 р-орбитали от каждого
из лигандов), содержащие 24 электрона.
По симметрии для образования
-MO
пригодны - 4s- и 4p-орбитали металла,
взаимодействие которых с 4
групповыми орбиталями
лигандов приводит к образованию
8 МО: s,
*s
и трехкратно вырожденных -
x,y,z,
*x,y,z.
Орбитали 3dxy,xz,yz
и
3dx2-y2,z2
взаимодействуют с
тремя и двумя групповыми
орбиталями лигандов и
образуют 10 МО -типа:
трехкратно вырожденные xy,xz,yz,
*xy,xz,yz,
и двухкратно вырожденные
x2-y2,z2,
*x2-y2,z2.
Три групповые орбитали
лигандов образуют трехкратно
вырожденные np-несвязывающие
МО. Схема 15. Диаграмма МО
В
тетраэдрическихкомплексах 3d-металлов
типа TiCl4,
VCl4,
[CrO4]2-
[MnO4]-
в образовании химических связей принимают
участие 21 атомная орбиталь:
3d-, 4s- и 4p-орбитали иона металла,
содержащие q электронов, и 12 АО
лигандов (по 3 р-орбитали от каждого
из лигандов), содержащие 24 электрона.
По симметрии для образования
-MO
пригодны - 4s- и 4p-орбитали металла,
взаимодействие которых с 4
групповыми орбиталями
лигандов приводит к образованию
8 МО: s,
*s
и трехкратно вырожденных -
x,y,z,
*x,y,z.
Орбитали 3dxy,xz,yz
и
3dx2-y2,z2
взаимодействуют с
тремя и двумя групповыми
орбиталями лигандов и
образуют 10 МО -типа:
трехкратно вырожденные xy,xz,yz,
*xy,xz,yz,
и двухкратно вырожденные
x2-y2,z2,
*x2-y2,z2.
Три групповые орбитали
лигандов образуют трехкратно
вырожденные np-несвязывающие
МО. Схема 15. Диаграмма МО
тетраэдрических комплексов.
Размещение (24+q) электронов по 21 МО определяет общую электронную формулу тетраэдрических комплексов: (s)2(x,y,z)6(xy,xz,yz)6(x2-y2,z2)4(np)6(*x2-y2,z2)x(*xy,xzy,yz)y(*s)0(x,y,z)0 (x + y = q).
Таким образом, электронное строение тетраэдрических комплексов независимо от природы центрального иона металла характеризуется наличием 24 электронов на /-связывающих и несвязывающих МО, преимущественно локализованных на лигандах. В тоже время, заполнение более высоколежащих – разрыхляющих *x2-y2,z2 и *xy,xzy,yz МО, преимущественно локализованных на металле, зависит от числа электронов иона металла.
Пример 3. Описать электронное строение тетраэдрического иона CrO42- и определить кратность связи Cr-O.
Решение. В состав оксокомплекса CrO42- входит центральный ион комплексообразователь Cr(VI), характеризующийся свободными 3d-, 4s- и 4p-валентными орбиталями, и 4 лиганда О2-, содержащие на своих валентных 2р-орбиталях 24 электрона. Распределение 24 электронов по 21 МО определяет электронную формулу оксокомплекса CrO42- - (s)2(x,y,z)6(xy,xz,yz)6(x2-y2,z2)4(np)6(*x2-y2,z2)0 (*xy,xzy,yz)0(*s)0(*x,y,z)0 и кратность индивидуальной связи Cr-O: K = (18-0)/(24) = 21/4.
В соответствии с ТКП оптические свойства комплексов определяются поглощением квантов электромагнитного излучения, энергия которых соответствует энергетическому зазору 10Dq между «расщепленными» d-орбиталями иона металла. Оптические полосы поглощения, связанные с перераспределением электронов между t2g и eg орбиталями, называют полосами d-d типа. В тоже время, ТПЛ показывает, что в результате поглощения квантов света соответствующей энергии возможны и другие переходы между заполненными и свободными МО комплекса – например, для тетраэдрических комплексов между np-несвязывающими и *x2-y2,z2-разрыхляющими орбиталями, преимущественно локализованных соответственно на лигандах и ионе металла. Такие переходы приводят к перераспределению электронной плотности между лигандами и ионом металла и соответствующие полосы поглощения называют «полосы переноса заряда». Таким образом, в согласии с экспериментальными данными ТПЛ обосновывает существование для комплексных соединений оптических полос поглощения не только d-d типа, но и переноса заряда.
Пример 4. Почему, несмотря на отсутствие электронов на d-орбиталях Cr(VI), оксокомплекс CrO42- характеризуется желтой окраской?
Решение. В соответствии с “цветовым кругом” (раздел 2.4, стр. 79) желтая окраска оксокомплекса CrO42- соответствует поглощению “синих” (нм) квантов электромагнитного излучения в видимой области спектра. Электронное строение комплекса CrO42- - (s)2(x,y,z)6(xy,xz,yz)6(x2-y2,z2)4 (np)6(*x2-y2,z2)0(*xy,xzy,yz)0(*x,y,z)0(*s)0 показывает, что, несмотря на отсутствие электронов на *x2-y2,z2 и *xy,xzy,yz МО, преимущественно локализованных на металле, и, следовательно, невозможностью d-d переходов, поглощение квантов видимого света, соответствующих энергетическому зазору между заполненной np и свободной *x2-y2,z2, определяет наличие полос переноса заряда лиганд метал и соответствующую окраску комплекса.
Образование низкоспиновых плоскоквадратных комплексов характерно либо для 3d-переходных металлов с лигандами сильного поля, либо для комплексов тяжелых 4d- и 5d-переходных металлов. В качестве примера типичного плоскоквадратного комплекса рассмотрим электронное строение [PtCl4]2-.
В соответствии с расположением лигандов на х и у осях координат валентными орбиталями металла, способными для образования МО -типа, являются 5dx2-y2, 5dz2, 6s, 6px и 6py:



![]()
![]()
Следует отметить, что валентная 5dx2-y2-орбиталь более эффективно взаимодействует с групповыми -орбиталями лигандов, чем ориентированная главным образом по оси z 5dz2-орбиталь. Валентная 6рz АО металла не взаимодействует с орбиталями лигандов и образует несвязывающую МО.

 Орбитали
5dxy,
5dxz,
5dyz
участвуют в образовании
-МО.
Причем, 5dxy,-орбиталь
перекрывается с четырьмя валентными
орбиталями лигандов, а эквивалентные
друг другу 5dxz-
и 5dyz-орбитали
только с двумя орбиталями лигандов.
Орбитали
5dxy,
5dxz,
5dyz
участвуют в образовании
-МО.
Причем, 5dxy,-орбиталь
перекрывается с четырьмя валентными
орбиталями лигандов, а эквивалентные
друг другу 5dxz-
и 5dyz-орбитали
только с двумя орбиталями лигандов.
![]()

Из 12 групповых орбиталей лигандов в образовании МО - и -типа принимают участие 8 орбиталей. Оставшиеся 4 групповые орбитали образуют несвязывающие МО, локализованные на лигандах.
Таким образом, в результате взаимодействия 9 АО металла и 12 групповых орбиталей лигандов образуются 21 МО, заселение которых 32 электронами (24 электрона лигандов и 8 металла) приводит к электронной формуле комплекса [PtCl4]2-: (s)2(x,y)4 (x2-y2)2(z2)2(xy)2(xz,yz)4(np)8 (*xz,yz)4(*z2)2(*xy)2(*x2-y2)0 (npz)0(*s)0(x,y)0. Комплекс диамагнитен и в соответствии с числом электронов на связывающих и разрыхляющих МО характеризуется единичной кратностью индивидуальной связи Pt-Cl (К = (16-8)/(24) = 1).
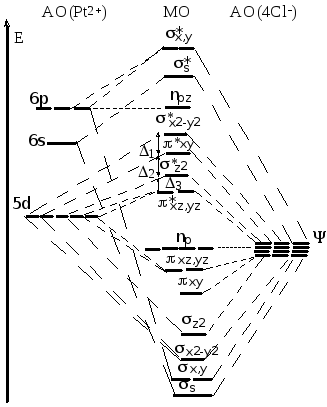
Схема 16. Диаграмма МО [PtCl4]2-.
У пражнения:
пражнения:
Опишите электронное строение, определите спиновую мультиплетность и кратность связи метал-лиганд для аква- и цианидных комплексов кобальта: а) [Co(H2O)6]2+, [Co(H2O)6]3+, [Co(H2O)6]4+; б) [Co(СN)6]4-, [Co(СN)6]3-, [Co(СN)6]2-. В какой степени окисления кобальта наиболее устойчивы октаэдрические низкоспиновые комплексы?
Обосновать различное положение полярных молекул СО ( = 0.10 D) и H2O (= 1.83 D) в спектрохимическом ряду лигандов.
Опишите электронное строение, определите спиновую мультиплетность и кратность связи метал-лиганд для оксокомплексов марганца: [MnO4]-, [MnO4]2-, [MnO4]3-. Как и почему изменяется устойчивость в ряду оксокомплексов Mn(VII), Mn(VI) и Mn(V)?
Определите природу низших по энергии оптических полос поглощения, определяющих окраску комплексов: [V(H2O)6]3+ - зеленый, [VF6]- - бесцветный, [VO4]3- - светло-желтый.
Сопоставьте электронное строение, спиновую мультиплетность, кратность связи Au-Cl и устойчивость комплексов [AuCl4]- и [AuCl4]2-.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств следующих комплексов: [Cr(NH3)6]3+, [Cr(CN)6]3-, [CrO4]2-. Какая из моделей дает более адекватное экспериментальным данным описание свойств комплексов?
