
- •1. Строение атома. Периодический закон
- •Количественные характеристики химических элементов
- •1.2. Модель Бора электронного строения атома водорода и водородоподобных ионов
- •1.3. Волны материи
- •1.4. Вероятностная модель строения атомов. Электронные и электронно-графические формулы атомов
- •1.5. Периодическая система химических элементов и закономерности изменения атомных характеристик элементов.
- •2. Химическая связь
- •Ионная модель химической связи. Поляризация ионов.
- •2.2 Теория кристаллического поля.
- •2.3. Метод валентных связей.
- •2.4. Метод молекулярных орбиталей
- •2.4.2. Металлическая связь. Зонная теория кристаллов.
- •2.5. Метод гипервалентных связей
- •2.6. Водородная связь
- •2.7. Межмолекулярное взаимодействие.
2.7. Межмолекулярное взаимодействие.
 Существование
молекулярных химических соединений,
как в газообразном, так и конденсированном
(жидком и твердом) состояниях
обусловлено действием сил межмолекулярного
взаимодействия двух типов –
электростатических
(Ван-дер-Ваальсовских
сил5)
между валентно-насыщенными
молекулами и донорно-акцепторным
межмолекулярным
взаимодействием с образованием
межмолекулярных комплексов.
Существование
молекулярных химических соединений,
как в газообразном, так и конденсированном
(жидком и твердом) состояниях
обусловлено действием сил межмолекулярного
взаимодействия двух типов –
электростатических
(Ван-дер-Ваальсовских
сил5)
между валентно-насыщенными
молекулами и донорно-акцепторным
межмолекулярным
взаимодействием с образованием
межмолекулярных комплексов.
 Электростатическое
взаимодействие молекул подразделяют
на ориентационное,
индукционное и дисперсионное.
Ориентационное
(диполь-дипольное) взаимодействие6
проявляется для полярных молекул
с постоянным дипольным моментом
.
В результате кулоновского
взаимодействия при сближении полярные
молекулы ориентируются так, чтобы
энергия системы стала минимальной.
Энергия такого взаимодействия
пропорциональна 4/r6,
где r – расстояние между центрами
диполей. Поскольку взаимная
ориентация двух диполей мешает им
ориентироваться относительно
третьего, то ориентационное
взаимодействие в общем случае не
аддитивно. Притяжение диполь-диполь
сильно зависит от расстояния
между молекулами и осуществляется,
только если энергия притяжения
превышает тепловую энергию
молекул (RT = 2.5 кДж/моль при комнатной
температуре), что соответствует
конденсированному состоянию
веществ. При повышении температуры,
а также в газовой фазе преобладает
энергия теплового движения
и эффект диполь-дипольного
взаимодействия резко
уменьшается. Таким образом,
для полярных молекул с близкими
значениями молекулярных масс
с ростом дипольного момента
температура кипения соединений
возрастает:
Электростатическое
взаимодействие молекул подразделяют
на ориентационное,
индукционное и дисперсионное.
Ориентационное
(диполь-дипольное) взаимодействие6
проявляется для полярных молекул
с постоянным дипольным моментом
.
В результате кулоновского
взаимодействия при сближении полярные
молекулы ориентируются так, чтобы
энергия системы стала минимальной.
Энергия такого взаимодействия
пропорциональна 4/r6,
где r – расстояние между центрами
диполей. Поскольку взаимная
ориентация двух диполей мешает им
ориентироваться относительно
третьего, то ориентационное
взаимодействие в общем случае не
аддитивно. Притяжение диполь-диполь
сильно зависит от расстояния
между молекулами и осуществляется,
только если энергия притяжения
превышает тепловую энергию
молекул (RT = 2.5 кДж/моль при комнатной
температуре), что соответствует
конденсированному состоянию
веществ. При повышении температуры,
а также в газовой фазе преобладает
энергия теплового движения
и эффект диполь-дипольного
взаимодействия резко
уменьшается. Таким образом,
для полярных молекул с близкими
значениями молекулярных масс
с ростом дипольного момента
температура кипения соединений
возрастает:
|
Соединение |
М, а.е.м. |
, D |
Tкип. К |
|
CH3CH2CH3 |
44 |
0.1 |
231 |
|
CH3OCH3 |
46 |
1.3 |
249 |
|
CH3CHO |
44 |
2.7 |
293 |
|
CH3CN |
41 |
3.9 |
355 |
Индукционное (диполь – наведенный диполь) взаимодействие7 осуществляется благодаря поляризации молекул под действием электрического поля диполей окружающей среды и возникновению у неполярных молекул наведенного или индуцированного диполя. Подобное взаимодействие может возникать и для полярных молекул. Тогда индукционный эффект добавляется к диполь-дипольному взаимодействию и усиливает взаимное притяжение молекул. Энергия индукционного взаимодействия возрастает с ростом дипольного момента и поляризуемости () молекул и быстро падает при увеличении расстояния E ~ 2/r6. Поскольку поляризация происходит при любом пространственном расположении молекул, то эффективность индукционного взаимодействия не зависит от температуры. Индукционное взаимодействие обычно достаточно слабое (в 10 – 20 раз меньше ориентационного эффекта) и заметно проявляется для молекул с высокой поляризуемостью.
Дисперсионное взаимодействие8 является универсальным и возникает при взаимодействии любых молекул независимо от их строения и полярности. Дисперсионный эффект возникает в результате наличия у молекул в каждый момент времени мгновенных микродиполей, взаимодействие между которыми приводит к синхронизации их движения. Несмотря на среднее, сферически симметричное распределение электронного заряда по отношению к положительному заряду ядра атома, в любой момент времени вследствие значительного различия в массах центры положительного и отрицательного заряда не совпадают, что и приводит к появлению мгновенного диполя. Электрическое поле мгновенных диполей атомов и молекул индуцирует возникновение мгновенных диполей в соседних частицах. При этом в результате взаимной ориентации микродиполей движение частиц перестает быть независимым и становится синхронным – возникновение и исчезновение микродиполей в частицах происходит в такт друг к другу. Это определяет притяжение соседних частиц и понижение энергии системы.
Энергия дисперсионного взаимодействия E ~ 2I/r6, где и I – поляризуемость и потенциал ионизации взаимодействующих молекул. Так как потенциалы ионизации молекул колеблются в нешироких пределах вблизи 10 эВ, то различие в дисперсионном взаимодействии определяется, главным образом, поляризуемостью молекул, которая возрастает с ростом их размеров. Поскольку размеры и масса молекул обычно взаимосвязаны, то дисперсионные силы в целом тем больше, чем больше молекулярная масса вещества, что и определяет закономерное увеличение температуры кипения и плавления – например, в ряду благородных газов:
|
|
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|
М, а.е.м. |
4 |
20 |
40 |
84 |
131 |
222 |
|
Ткип., К |
4 |
27 |
87 |
121 |
164 |
211 |
|
Tпл., К |
1 |
24 |
90 |
117 |
160 |
222 |
Для многоатомных молекул определенную роль в эффективности дисперсионного взаимодействия играет также форма молекул – например, пентан и изопентан имеют одинаковую молекулярную массу 72, но различные температуры кипения 309.4 К и 282.7 К соответственно. Молекулы пентана СH3(CH2)3CH3 обладают большим числом центров для дисперсионного взаимодействия и способны вступать в контакт друг с другом по всей длине молекулы, что и обеспечивает их более сильное притяжение друг к другу по сравнению с молекулами изопентана (CH3)4C, поверхность контакта между которыми меньше.
Таким образом, энергия межмолекулярного электростатического взаимодействия в общем случае складывается из энергии ориентационного, индукционного и дисперсионного взаимодействий, вклады каждого из которых зависят от полярности и поляризуемости молекул. Чем выше полярность, тем значительнее роль ориентационных сил, тогда как с ростом поляризуемости молекул возрастает дисперсионный эффект. Индукционный эффект зависит от обоих факторов, но по величине значительно меньше по сравнению с дисперсионным и ориентационным взаимодействием. В целом Ван-дер-Ваальсовские силы намного слабее внутримолекулярных – например, энергия испарения жидкого HCl составляет 16 кДж/моль, тогда как энергия химической связи – 431 кДж/моль. Поэтому именно межмолекулярные силы в первую очередь определяют физические характеристики молекулярных соединений в конденсированном состоянии – температуры плавления и кипения, твердость, плотность, тепловое расширение.
Донорно-акцепторное межмолекулярное взаимодействие возникает за счет наличия электронной пары у одной молекулы (донора) и свободной орбитали у другой молекулы (акцептора), что приводит к образованию межмолекулярных комплексов. Например, акцепторные свойства соединений бора BХ3 определяет их эффективное взаимодействие с различными донорами - аминами, фосфинами, эфирами – с образованием соответствующих межмолекулярных комплексов (аддуктов) - (CH3)3NBCl3, (CH3)3PBH3, (C2H5)2OBF3. Донорно-акцепторное взаимодействие возможно и между одинаковыми молекулами – например, линейные молекулы фторида бериллия BeF2 в газовой фазе характеризуются наличием как свободных орбиталей атомов бериллия, так и неподеленных электронных пар атомов фтора. Это приводит к ассоциации молекул при понижении температуры с образованием полимерных молекул (BeF2)n. Энергия межмолекулярного донорно-акцепторного взаимодействия колеблется в достаточно широких пределах: от 6 – 12 кДж/моль, что близко к энергии Ван-дер-Ваальсова взаимодействия, до 200 – 250 кДж/моль – значений, сопоставимых с энергией ковалентных химических связей.
У пражнения:
пражнения:
Укажите межмолекулярные силы, действующие между молекулами: HCl-HCl, HF-HF, O2-H2, CH4-CH3Cl, CH3NH2-H2O, NF3-BF3.
Укажите природу межмолекулярных сил и расположите следующие соединения в порядке увеличения их температур кипения: H2S, CH3OH, C2H6, Ar.
Определить для какого вещества характерно наибольшее ориентационное, индукционное и дисперсионное взаимодействие:
|
|
He |
Ar |
CO |
HCl |
NH3 |
H2O |
|
, D |
0 |
0 |
0.12 |
1.03 |
1.50 |
1.84 |
|
Поляризуемость, Å3 |
0.20 |
1.63 |
1.99 |
2.63 |
2.21 |
1.48 |
Как и почему изменяются температуры кипения и плавления в ряду: а) галогенов, б) галогеноводородов, в) водородных соединений р-элементов 4 группы?
Обоснуйте характер изменения температур (oC) кипения фторидов элементов второго периода: LiF 1717, BeF2 1175, BF3 -101, CF4 -128, NF3 -120, OF2 -145, F2 -188.
Исходя из величин температур плавления, определить вещества с молекулярной кристаллической решеткой и какие силы действуют между их молекулами:
|
|
CH4 |
HI |
P4 |
H2O |
SiO2 |
PdCl2 |
Si |
NaCl |
|
Тпл. К |
89 |
222 |
317 |
273 |
~2000 |
1200 |
1700 |
1073 |

Индивидуальные задания по теме “Химическая связь”
Вариант 1.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [MnO4]-, [Mn(CN)6]3-и [Mn(H2O)6]2+.
Методом ВС опишите электронное строение, определите геометрическую структуру и кратность связи в следующих соединениях: NF3, CO32-, SO2Cl2, ClO3-, PF5, SiF62-.
Сопоставьте в рамках методов ВС и МО описание электронного строения HF и LiH.
В рамках ионной модели обоснуйте характер изменения термической устойчивости в ряду гидроксидов: а) Be(OH)2Mg(OH)2Ca(OH)2Sr(OH)2 Ba(OH)2; б) Zn(OH)2Cd(OH)2Hg(OH)2.
В рамках метода ГВС обоснуйте применимость эмпирического правила «N-2» для наиболее устойчивых степеней окисления галогенов в их соединениях. С чем связано исключение из этого правила для соединений фтора?
Объясните различие в температурах плавления 4d-металлов: Y (1528 oC), Mo (2620 оС), Cd (321 oC).
Вариант 2.
Сопоставьте в рамках методов ВС и МО описание электронного строения BeH2 и BeF2.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [FeCl4]-, [Fe(CN)6]3-, [Fe(H2O)6]3+.
Методом ВС опишите электронное строение, определите геометрическую структуру и кратность связи в следующих соединениях: CO2, COF2, SO2, NO3-, PF6-, AsF5.
В рамках ионной модели обоснуйте характер изменения кислотно-основных свойств в ряду: а) HIOHIO2HIO3HIO4H5IO6; б) HClOHBrOHIO.
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: KrF2, PF5, SeF4, ClF4+.
Определите энергию кристаллической решетки NaBr, если ионные радиусы натрия и брома составляют 0.095 нм и 0.195 нм. Обоснуйте, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул.
Вариант 3.
В рамках метода ВС опишите электронное строение, определите геометрическую структуру и кратность связи в соединениях: BeCl2, BO33-, ClO2-, SO42-OF2, IF5.
Методом МО опишите электронное строение, определите кратность связи и магнитные свойства двухатомных молекул элементов II периода.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [NiCl4]2-, [Ni(CN)4]2-, [Ni(H2O)6]2+.
Методом ГВС опишите электронное строение и определите геометрическую структуру фторидов ксенона: XeF+, XeF2, XeF3-, XeF4, XeF5+, XeF6.
В рамках зонной модели обоснуйте характер изменения удельного сопротивления () для простых веществ р-элементов 4 группы с алмазоподобной кристаллической решеткой:
|
Элемент |
C |
Si |
Ge |
Sn |
|
Омсм |
106 |
6104 |
50 |
1 |
Определите величину энергии процессов гетеролитического и гомолитического разрыва связи в молекуле NaI, если величина ионных радиусов Na и I составляют 0.095 нм и 0.216 нм, потенциал ионизации Na 5.14 эВ и энергия сродства к электрону I 3.06 эВ.
Вариант 4.
От каких факторов зависит эффективность гибридизации атомных орбиталей центрального атома? В рамках метода ВС опишите электронное строение, определите геометрическую структуру и кратность связи в оксоанионах: SiO44-, PO43-, SO42-, ClO4-. Как и почему изменяется устойчивость этих оксоанионов?
Сопоставьте в рамках методов ВС и МО описание электронного строения СН4. Объясните наличие двух первых потенциалов ионизации (1274 кДж/моль и 2132 кДж/моль) молекулы метана.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [VCl4]-, [V(H2O)6]3+, [V(CN)6]3-.
Почему химия благородных газов ограничена с одной стороны элементами подгруппы криптона, а с другой их соединениями со фтором, кислородом и хлором? Опишите электронное строение и обоснуйте характер изменения устойчивости в ряду: а) KrF2, XeF2, RnF2; б) XeF4, XeCl4.
От каких факторов зависит поляризуемость и поляризующее действие ионов? Как и почему изменяется поляризующее действие и поляризуемость в ряду следующих ионов: а) Be2+Mg2+Ca2+Sr2+Ba2+; б) Zn2+Cd2+ Hg2+; в) Al3+Sc3+Y3+La3+; г) O2- S2-Se2-Te2-; д) Mg2+Na+F-O2-?
Объясните характер изменения температур кипения (oC) в ряду соединений: а) CH4 (-162), NH3 (-33), H2O (0), HF (19.5); б) BF3 (-101), CF4 (-128), NF3 (-120), OF2 (-145); в) СCl4 (-23), SiCl4 (-69), TiCl4 (-30).
Вариант 5.
Сопоставьте в рамках методов ВС и МО описание электронного строения О2, О2+, О2-, О22-.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, оптических и магнитных свойств комплексов: TiCl4, [TiCl6]4-, [TiF6]3-.
Обоснуйте различный характер продуктов обменных реакций в водных растворах: а) Cu(NO)2 + KI и Сu(NO3)2 + KF; б) Zn(NO3)2 + NaOH и Hg(NO3)2 + NaOH.
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: XeF6, PF3, IF7, TeF3-.
Объясните различие в температурах плавления 5d-металлов: La (920 оС), W (3420 oC), Hg (-38.9 oC).
Объясните характер изменения констант диссоциации в водных растворах производных бензойной кислоты: бензойная C7H6O2 (610-5), орто-оксибензойная C7H6O3 (110-3), мета-оксибензойная C7H6O3 (810-5), пара-оксибензойная C7H6O3 (310-5), 2,6-диоксибензойная С7Н6О4 (510-2), 3,5-диоксибензойная С7Н6О4 (910-5).
Вариант 6.
Сопоставьте в рамках методов ВС и МО описание электронного строения BH3 и BF3.

Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [Ni(NH3)6]2+, [Pt(NH3)6]4+, [Pt(NH3)4]2+.
От каких факторов зависит эффективность гибридизации атомных орбиталей центрального атома? Как и почему изменяется величина валентного угла НЭН и энергия связи Э-Н в ряду водородных соединений халькогенов?
Как и почему изменяется термическая устойчивость в ряду: а) NaClO4, AgClO4, HClO4; б) AgF, AgCl, AgBr, AgI?
Методом ГВС опишите электронное строение и объясните характер изменения устойчивости в ряду: а) Cl3-, Br3-, I3-; б) IF3, BrF3, ClF3.
Постройте и объясните зависимость температуры кипения и плавления халькогеноводородов от величины их молекулярной массы.
|
|
H2O |
H2S |
H2Se |
H2Te |
|
Tпл., оС |
0 |
-85.6 |
-65.7 |
-51 |
|
Tкип., оС |
100 |
-60.4 |
-41.4 |
-2 |
На основании графической экстраполяции определите - какую температуру кипения и плавления имела бы вода в неассоциированном состоянии?
Вариант 7.
Сопоставьте в рамках методов ВС и МО описание электронного строения перманганат-иона MnO4-. С чема связана характерная фиолетовая окраска перманганат-ионов?
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [FeF6]3-, [RuF6]3-, [FeO4]2-.
Как и почему изменяется термическая устойчивость и окислительные свойства в ряду: HClO, HClO2, HClO3, HClO4?
Опишите электронное строение фторидов ксенона и обоснуйте применимость эмпирического правила «N-2» для наиболее устойчивых степеней окисления ксенона. Для каких р-элементов 8 группы и почему связаны исключения из этого правила?
Объясните различие в температурах плавления 3d-металлов: Sc (1541 oC), Cr (1890 оС), Zn (420 oC).
Обоснуйте спиралеобразную форму белков и двойную спираль молекул нуклеиновых кислот ДНК и РНК. С чем связана прочность и эластичность волокон синтетических полиамидов (например, найлона), имеющих в своем составе пептидные –NH-CO- связи?
Вариант 8.
Как и почему изменяются кислотные и окислительные свойства в ряду гидроксидов хлора: HClO – HClO2 – HClO3 – HClO4?
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [CoF6]3-, [RhF6]3-, [IrF6]2-.
Опишите электронное строение и определите валентность атома бора в молекуле BCl3 в рамках методов ВС и МО.
С чем связана эластичность живых тканей?
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: XeF8, SF3, IF4+, PF4-.
Постройте и объясните зависимость температуры кипения и плавления галогеноводородов от величины их молекулярной массы.
|
|
HF |
HCl |
HBr |
HI |
|
Tпл., оС |
-83.4 |
-114.2 |
-86.9 |
-50.9 |
|
Tкип., оС |
19.5 |
-85.1 |
-66.8 |
-35.4 |
Какую температуру кипения и плавления имел бы фтороводород в неассоциированном состоянии?
Вариант 9.
Как и почему изменяется устойчивость в водных растворах в ряду следующих комплексных ионов: а) [TiCl6]2-, [ZrCl6]2-, [HfCl6]2-; б) [NiCl4]2-, [PdCl4]2-, [PtCl4]2-?
В рамках метода ВС опишите электронное строение и определите тип гибридизации атомных орбиталей, геометрическое строение содинения и кратность связи следующих соединений: SO2, SO32-, SO42-, SF6, SCl4.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [CuF6]3-, [AuCl4]3-, [Cu(H2O)6]2+. Какой из этих комплексов и почему имеет искаженное строение?
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: XeF5+, PF6-, SF2, ClF5.
И
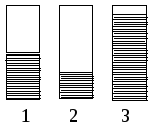 спользуя
качественную диаграмму заселенности
электронамиs-d
зоны для металлов Cu,
Cr
и Sc:
спользуя
качественную диаграмму заселенности
электронамиs-d
зоны для металлов Cu,
Cr
и Sc:
определите: а) какая диаграмма соответствует каждому из металлов, б) как и почему изменяется температура плавления в ряду этих металлов, в) почему хром характеризуется высокой твердостью, а медь является “мягким” металлом?
Изобразите и обоснуйте: а) димерное строение молекул муравьиной кислоты в жидком и газообразном состоянии и зигзагообразную структуру в твердом состоянии; б) зигзагообразное строение карбоната натрия в твердом состоянии.
Вариант 10.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [PtBr4]2-, [PtCl6]2-, PtF6.
Методом МВС и МО опишите электронное строение и определите магнитные свойства молекулы O2. Какой из методов согласуется с парамагнитизмом молекулярного кислорода?
Как и почему изеняется термическая устойчивость и растворимость в водных растворах галогенидов серебра: AgF, AgCl, AgBr, AgI ?
Объясните различие в температурах плавления 5d-металлов: La (920 оС), W (3420 oC), Hg (-38.9 oC).
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: ClF2+, PF4-, XeF3+, SF6.
Объясните немонотонную зависимость температуры кипения и плавления водородных соединений р-элементов 5 группы от величины их молекулярной массы.
|
|
NH3 |
PH3 |
AsH3 |
SbH3 |
|
Tпл., оС |
-77.8 |
-133.8 |
-116 |
-88 |
|
Tкип., оС |
-33 |
-87.7 |
-62 |
-18 |
На основании графической экстраполяции определите - какую температуру кипения и плавления имел бы аммиак в неассоциированном состоянии?
Вариант 11.
В рамках метода ВС опишите электронное строение и определите тип гибридизации атомных орбиталей, геометрическое строение содинения и кратность связи следующих соединений: NH3, NO2-, NO3-, NF3, N2.
Как изменяются кислотно-основные и окислительно-восстановительные свойства в ряду HClO4, HBrO4, HIO4, H6IO6 ?
В рамках метода МО опишите электронное строение и определите кратность связи следующих соединений: N2,
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [CoF6]4-, [CoF6]3-, [CoF6]2-. Обоснуйте окислительно-восстановительные свойства фторидных комплексов Co(II), Co(III) и Co(IV).
Какие факторы и почему влияют на устойчивость гипервалентных связей? Опишите электронное строение и сравните термическую устойчивость соединений: а) ClF и ClF3; б) IF7 и IF5; в) PF5 и PCl5; г) KrF2 и XeF2.
Изобразите и обоснуйте плоскостную структуру формамида HCONH2 в твердом состоянии. Будет ли диметилформамид HCON(CH3)2 иметь подобную структуру?
Вариант 12.
Сопоставьте в рамках методов ВС и МО описание электронного строения О2, О2+, О2-, О22-.
Как и почему изменяется термическая устойчивость в ряду: а) NaClO4, AgClO4, HClO4; б) AgF, AgCl, AgBr, AgI?
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [PdF6]2-, [PdF6]3-, [PdF4]-, [PdF4]2-. Объясните, почему, как октаэдрические, так и плоскоквадратные комплексы Pd(III) неуйстойчивы?
Объясните различие в температурах плавления 3d-металлов: Sc (1541 oC), Cr (1890 оС), Zn (420 oC).
Для описания электронного строения каких элементов и почему применим метод ГВС? Опишите электронное строение и определите какие из следующих соединений являются полярными: XeF2, ClF3, PF5, SF6?
Укажите природу межмолекулярных сил и объясните характер изменения температур кипения для следующих соединений: а) диэтиловый эфир (C2H5)2O (34.6 oC) и бутанол C4H9OH (117.5 oC), б) ацетон (CH3)2CO (56.5 oC) и пропанол C3H7OH (97.8 oC), в) этанол C2H5OH (78.4 oC) и этиленгликоль HOC2H4OH (197.3 oC).
Вариант 13.
Методом ВС опишите электронное строение, определите геометрическую структуру и кратность связи в следующих соединениях: NF3, CO32-, SO2Cl2, ClO3-, PF5, SiF62-.
Обоснуйте различный характер продуктов обменных реакций в водных растворах: а) Cu(NO)2 + KI и Сu(NO3)2 + KF; б) Zn(NO3)2 + NaOH и Hg(NO3)2 + NaOH.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [NiCl4]2-, [AuCl4]-, [HgCl4]2-.
Объясните различие в температурах плавления 5d-металлов: La (920 оС), W (3420 oC), Hg (-38.9 oC).
Обоснуйте понятия: «орбитально-избыточные» и «орбитально-дефицитные» связи, гипервалентные-1 (HV-1) и гипервалентные-2 (HV-2) связи, ковалентные (CV) связи. Приведите примеры соединений с химическими связями CV-типа, HV-1, HV-2 и орбитально-избыточными. Как и почему изменяется энергия химических связей CV, HV-1 и HV-2 типа?
В дихлорметане CH2Cl2 ( = 1.6 D, вклад дисперсионных сил в межмолекулярные силы приблизительно в пять раз больше, чем вклад ориентационных сил. Каково соотношение между относительными вкладами этих сил можно ожидать для дибромметана СН2Br2 (= 1.43 D) и дифторметана CH2F2 ( = 1.93 D)?
Вариант 14.
Как и почему изменяются кислотные и окислительные свойства в ряду гидроксидов хлора: HClO – HClO2 – HClO3 – HClO4?
Сопоставьте в рамках методов ВС и МО описание электронного строения перманганат-иона MnO4-. С чема связана характерная фиолетовая окраска перманганат-ионов?
Методом ГВС опишите электронное строение и определите геометрическую структуру соединений: XeF8, SF3, IF4+, PF4-.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [MnCl4]2-, [AuCl4]-, [HgCl4]2-.
И
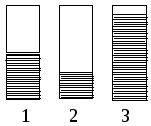 спользуя
качественную диаграмму заселенности
электронамиs-d
зоны для металлов Ag,
Mo
и Y:
спользуя
качественную диаграмму заселенности
электронамиs-d
зоны для металлов Ag,
Mo
и Y:
определите: а) какая диаграмма соответствует каждому из металлов, б) как и почему изменяется температура плавления в ряду этих металлов, в) почему молибден характеризуется высокой твердостью, а серебро является относительно “мягким” металлом?
Получены два химических соединения А и Б с общей формулой С4Н10О, но различными характеристиками:
|
Соединение |
Ткип. оС |
Тпл. оС |
Растворимость в воде |
|
А |
117.5 |
-79.9 |
Хорошая |
|
Б |
34.6 |
-116.3 |
Не растворим |
Определите и обоснуйте, какие это соединения?
Вариант 15.
Сопоставьте в рамках метода ВС, ТКП и ТПЛ описание электронного строения, характеристику - кратности связи метал-лиганд, магнитных и оптических свойств комплексов: [Co(CN)6]4-, [Co(CN)6]3-, [Co(CN)6]2-. Обоснуйте окислительно-восстановительные свойства цианидных комплексов Co(II), Co(III) и Co(IV).
Методом ВС опишите электронное строение, определите геометрическую структуру и кратность связи в следующих соединениях: NF3, CO32-, SO2Cl2, ClO3-, PF5, SiF62-.
Как и почему изеняется термическая устойчивость и растворимость в водных растворах галогенидов серебра: AgF, AgCl, AgBr, AgI ?
Объясните различие в температурах плавления 5d-металлов: La (920 оС), W (3420 oC), Hg (-38.9 oC).
Почему разница в температурах кипения метанола СН3ОН (65 оС) и метана СН4 (-164 оС) составляет 229 оС, тогда как разница в температурах кипения деканола С10Н21ОН (229 оС) и декана (174 оС) только 55 оС?
Используя значения ионных радиусов: r(Na+) = 0.095 нм, r(Cs+) = 0.169 нм, r(Ti4+) = 0.074 нм, r(Th4+) = 0.102 нм, r(Cl-) = 0.181 нм, r (F-) = 0.136 нм, r(O2-) = 0.14 нм, определите координационные числа катиона и аниона, а также структуру кристаллической решетки следующих соединений: а) NaCl, б) CsCl, в) TiO2, г) ThO2.
1Уравнения приведены для системы единиц СГС, для которой заряд электрона - е = 4.810-10см3.2г1.2с-1, а энергия измеряется в эрг/молекулу. 1 эрг/молекулу = 6.2421021эВ/молекулу = 6.0231016Дж/моль. Для системы единиц СИ уравнения имеют вид:E= [(ze)2/(4r0)][1-(1/n)] иEAB= [(ze)2/(4r0)][1-(1/n)] +I–Ae, где- диэлектрическая проницаемость вакуума.
2Согласно другой точке зрения меньшая устойчивость молекулыF2по сравнениюcCl2связана с эффектом межэлектронного отталкивания в молекуле фтора в результате аномально малого радиуса взаимодействующих атомов фтора.
3Дипольные моменты обычно измеряют в дебаях (D); 1D= 3.3410-30Клм.
4Образование таких зон обусловлено особенностми симметрии кристаллической решетки алмаза.
5Голландский исследователь Ван-дер-Ваальс (1873) постулировал, что «неидеальное» поведение газов при сжатии связано с существованием между атомами и молекулами в газовой фазе общих сил притяжения и для учета этого взаимодействия ввел поправочный член в уравнение состояния идеального газа.
6Эффект Кеезома.
7Эффект Дебая.
8Эффект Лондона.
