
- •9. Генетические и негенетич.Взаимодействия вирусов. Генетические взаимодействия между вирусами:
- •Негенетические взаимодействия вирусов:
- •23. Методы экспресс диагностики вирусных инфекций. Серологические, риа и тд, ответы ниже
- •27. Профилактика вирусных заболеваний.
- •29 Лаб. Животные и их использование
- •33. Действие на вирусов физико-химических факторов Влияние физических факторов.
- •42. Методы определения титра антител и их практическое значение.
- •48. Борьба с вирусами с-х животных.
- •49. Лечение вирусных болезней.
- •51. Принципы, техника и практическое значение ртга Настоящие методические указания преднаяначены для серо-
- •59. Феномен гемадсорбции и ее задержки
- •61. Частная вирусология
- •35. Ларинготрахеит кур.
- •36. Оспа кур.
- •37. Ящур.
- •38. Болезнь Ньюкасла.
- •39. Болезнь Тешена.
- •40. Чума плотоядных.
- •41. Парагрипп крс.
- •43. Аденовирус крс.
- •44. Болезнь Марека.
- •45. Болезнь Ауески.
- •46. Чума крс.
- •47. Диарея крс.
- •48. Ринотрахеит крс.
- •49. Бешенство.
- •50. Грипп кур.
- •51. Классическая чума свиней.
- •52. Африканская чума свиней.
- •55. Гастроэнтерит свиней.
- •56. Бронхит кур.
1. Этапы развития вирусологии. Впервые существование вируса (как нового типа возбудителя болезней) доказал в 1892 году русский учёныйД. И. Ивановский. После многолетних исследований заболеваний табачных растений, в работе, датированной 1892 годом, Д. И. Ивановский приходит к выводу, что мозаичная болезнь табака вызывается «бактериями, проходящими через фильтр Шамберлана, которые, однако, не способны расти на искусственных субстратах». На основании этих данных были определены критерии, по которым возбудителей заболеваний относили к этой новой группе: фильтруемость через «бактериальные» фильтры, неспособность расти на искусственных средах, воспроизведения картины заболевания фильтратом, освобождённым от бактерий и грибов. Возбудитель мозаичной болезни называется Д. И. Ивановским по-разному, термин «вирус» ещё не был введён, иносказательно их называли то «фильтрующимися бактериями», то просто «микроорганизмами».
Пять лет спустя, при изучении заболеваний крупного рогатого скота, а именно — ящура, был выделен аналогичный фильтрующийся микроорганизм. А в 1898 году, при воспроизведении опытов Д. Ивановского голландским ботаникомМ. Бейеринком, он назвал такие микроорганизмы «фильтрующимися вирусами». В сокращённом виде это название и стало обозначать данную группу микроорганизмов.
В 1901 году было обнаружено первое вирусное заболевание человека — жёлтая лихорадка. Это открытие было сделано американским военным хирургом У. Ридом и его коллегами.
В 1911 году Фрэнсис Раус доказал вирусную природу рака — саркомы Рауса
2. История развития вирусов. Вирусами (от лат. слова вирус – яд) новые существа были впервые названы голландским микробиологом Бейеринком в 1899 году. Бейеринк впервые описал принципиальные различия между бактериями и вирусом табачной мозаики. Однако увидеть их было в то время невозможно – не позволяла разрешающая способность оптического микроскопа.
В конце 19 века было также обнаружено заразное (инфицирующее) действие фильтратов пораженных болезнями тканей животных, но ученые считали, что это токсин.
В 1915 году Творт описал стекловидные колонии микрококков, которые были поражены каким-то невидимым агентом (бактериофагом). Позже, в1919 году, Д´Эрель подсчитал их частицы по бляшкам, которые появляются на колониях.
В 1933 году Шлезингер впервые наблюдал и подсчитал в темном поле частицы бактериофагов капустной палочки.
В 1941 Руска опубликовал первые снимки вирусов, сделанные с помощью электронного микроскопа. С этого времени вирусология как наука стала быстро развиваться.
В 50-е годы 20 века было изучено явление лизогении, а также было обнаружено, что фаги способны захватывать часть генетической информации бактериальной клетки. Это было в дальнейшем использовано в генетической инженерии.
В настоящее время изучены тысячи различных вирусов, особенно патогенных. Их даже научились использовать (в генетической инженерии как векторы – переносчики генов, в медицине – кишечный бактериофаг). Лечить вирусные заболевания трудно (обычно только симптоматически), антибиотики не действуют. Чем опасны? Вирус проникает в клетку, захватывает управляющие центры (ДНК) клетки и перестраивает ее работу на синтез нужных ему веществ – РНК, белков. У вируса простенькая программа, записанная в нескольких десятках генов, однако он способен заставить клетку работать на себя.
3. основные св-ва вирусов (и плазмид), по которым они отличаются от остального живого мира.1.Ультрамикроскопические размеры (измеряются в нанометрах). Крупные вирусы (вирус оспы) могут достигать размеров 300 нм, мелкие- от 20 до 40 нм. 1мм=1000мкм, 1мкм=1000нм.
2.Вирусы содержат нуклеиновую кислоту только одного типа- или ДНК (ДНК- вирусы) или РНК (РНК- вирусы).У всех остальных организмов геном представлен ДНК, в них содержится как ДНК, так и РНК.
3.Вирусы не способны к росту и бинарному делению.
4.Вирусы размножаются путем воспроизводства себя в инфицированной клетке хозяина за счет собственной геномной нуклеиновой кислоты.
5.У вирусов нет собственных систем мобилизации энергии и белок- синтензирующих систем, в связи с чем вирусы являются абсолютными внутриклеточными паразитами.
6.Средой обитания вирусов являются живые клетки- бактерии (это вирусы бактерий или бактериофаги), клетки растений, животных и человека.
 Все
вирусы существуют в двух качественно
разных формах: внеклеточной- вирион
и внутриклеточной-вирус.
Таксономия этих представителей микромира
основана на характеристике вирионов-
конечной фазы развития вирусов.
Все
вирусы существуют в двух качественно
разных формах: внеклеточной- вирион
и внутриклеточной-вирус.
Таксономия этих представителей микромира
основана на характеристике вирионов-
конечной фазы развития вирусов.
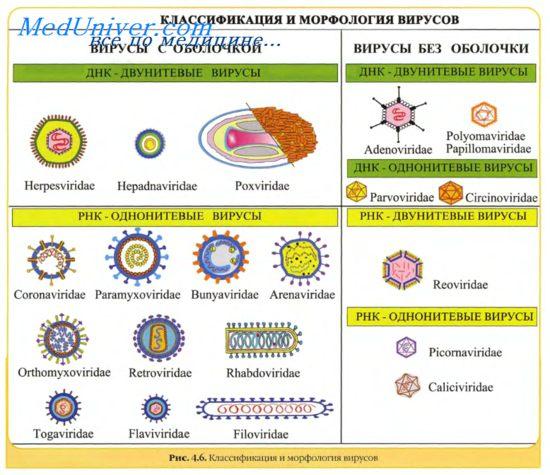
4.Принципы систематики вирусов. Систематика Вирусы Общепринятой классификации и обозначения Вирусы ещё нет. Им дают, как и другим животным и растениям, родовые и видовые названия, пользуются народными обозначениями, различными сокращениями или ставят родовое название организма, поражаемого Вирусы, и номер.Поэтому каждый Вирусы может иметь несколько названий. Основополагающий принцип систематики – тип нуклеиновой кислоты вирионов. По данному признаку выделяют две группы: 1) ДНК-содержащие 2) РНК-содержащие. Каждая из них подразделяется на семейства (-viridae), подсемейства (-virinae), роды, виды, варианты (типы – по антигенной структуре – серотипы, по генотипу)(-virus)
5.физич.структура вирусов и хим.состав. Основным структурным компонентом вирионов (полных вирусных частиц) является нуклеокапсид, т.е. белковый чехол (капсид) в котором заключен вирусный геном (ДНК или РНК). Нуклеокапсид большинства семейств вирусов окружен липопротеиновой оболочкой. Между оболочкой и нуклеокапсидом у некоторых вирусов (орто-, парамиксо-, рабдо-, фило- и ретровирусов) находится негликозилированный матриксный белок, придающий дополнительную жесткость вирионам. Вирусы большинства семейств имеют оболочку, которая играет важную роль в инфекционности. Наружный слой оболочки вирионы приобретают, когда нуклеокапсид проникает через клеточную мембрану почкованием. Белки оболочки кодируются вирусом, а липиды заимствуются из мембраны клетки. Гликопротеины обычно в виде димеров и тримеров образуют пепломеры (выступы) на поверхности вирионов (орто-, парамиксовирусы, рабдо-, фило-, корона-, бунья-, арена-, ретровирусы). Гликозилированные белки слияния связаны с пепломерами и выполняют ключевую роль в проникновении вируса в клетку. Капсиды и оболочки вирионов образуются множеством копий одного или нескольких видов белковых субъединиц в результате процесса самосборки. Взаимодействие в системе белок-белок, благодаря слабым химическим связям, ведет к объединению симметричных капсидов. Различия вирусов по форме и размеру вирионов зависят от формы, размера и количества структурных белковых субъединиц и природы взаимодействия между ними. Капсид состоит из множества морфологически выраженных субъединиц (капсомеров), собранных из вирусных полипептидов строго определенным образом, в соответствии с относительно простыми геометрическими принципами. Белковые субъединицы, соединяясь друг с другом, образуют капсиды двух видов симметрии: изометрические и спиральные. Структура нуклеокапсида оболочечных вирусов сходна со структурой нуклеокапсида безоболочечных вирусов. На поверхности оболочки вирусов различают морфологически выраженные гликопротеиновые структуры — пепломеры. В состав суперкапсидной оболочки входят липиды (до 20—35%) и углеводы (до 7—8%), имеющие клеточное происхождение. Она состоит из двойного слоя клеточных липидов и вирусспецифических белков, расположенных снаружи и изнутри липидного биослоя. Наружный слой суперкапсидной оболочки представляют пепломеры (выступы) одного или более типов, состоящие из одной или нескольких молекул гликопротеинов. Нуклеокапсид у оболочечных вирусов часто называют сердцевиной (core), а центральную часть вирионов, содержащую нуклеиновую кислоту, называют нуклеоидом. Капсомеры (пепломеры) состоят из структурных единиц, построенных из одной либо из нескольких гомологичных или гетерологичных полипептидных цепей (белковых субъединиц).Изометрические капсиды представляют собой не сферы, а правильные многогранники (икосаэдры). Их линейные размеры идентичны по осям симметрии. Согласно Каспару и Клугу (1962), капсомеры в капсидах расположены в соответствии с икосаэдрической симметрией. Такие капсиды состоят из идентичных субъединиц, образующих икосаэдр. Они имеют 12 вершин (углов), 30 граней и 20 поверхностей в виде равнобедренных треугольников. В соответствии с этим правилом капсид полиовируса и вируса ящура образован 60 белковыми структурными единицами, каждая из которых состоит из четырех полипептидных цепей. Икосаэдр оптимально решает проблему укладки повторяющихся субъединиц в строгую компактную структуру при минимальном объеме. Только некоторые конфигурации структурных субъединиц могут сформировать поверхности, образовать вершины и грани вирусного икосаэдра. Например, структурные субъединицы аденовируса на поверхностях и гранях формируют шестигранные капсомеры (гексоны), а на вершинах - пятигранные капсомеры (пептоны). У одних вирусов оба вида капсомеров образуются одними и теми же полипептидами, у других — разными полипептидами. Так как структурные субъединицы разных вирусов различаются между собой, то одни вирусы кажутся более гексагональными, другие — более сферическими. Все известные ДНК-содержащие вирусы позвоночных, за исключением вирусов оспы, а также многие РНК-содержащие вирусы (7 семейств) имеют кубический тип симметрии капсида. Реовирусы, в отличие от других вирусов позвоночных, имеют двойной кап-сид (наружный и внутренний), причем каждый состоит из морфологических единиц. Вирусы, обладающие спиральным типом симметрии, имеют вид цилиндрической нитевидной структуры, их геномная РНК имеет вид спирали и находится внутри капсида. Все вирусы животных спиральной симметрии окружены липопротеиновой оболочкой. Спиральные нуклеокапсиды характеризуются длиной, диаметром, шагом спирали и числом капсомеров, приходящихся на один оборот спирали. Так, у вируса Сендай (парамиксовирус) нуклеокапсид представляет собой спираль длиной около 1 мкм, диаметром 20 нм и шагом спирали 5 нм. Капсид состоит примерно из 2400 структурных единиц, каждая из которых является белком с молекулярной массой 60 кД. На каждый виток спирали приходится 11—13 субъединиц. У вирусов со спиральным типом симметрии нуклеокапсида укладка белковых молекул в спираль обеспечивает максимальное взаимодействие между нуклеиновой кислотой и белковыми субъединицами. У икосаэдрических вирусов нуклеиновая кислота находится внутри вирионов в скрученном состоянии и взаимодействует с одним или несколькими полипептидами, расположенными внутри капсида.
6. репродукция вирусов. Вирусы не способны размножаться на питательных средах - это строгие внутриклеточные паразиты. Более того, в отличие от риккетсий и хламидий, вирусы в клетке хозяина не растут и не размножаются путем деления. Составные части вируса - нуклеиновые кислоты и бел ковые молекулы синтезируются в клетке хозяина раздельно, в разных частях клетки - в ядре и в цитоплазме. При этом клеточные белоксинтезирующие системы подчиняются вирусному геному, его НК.
Репродукция вируса в клетке происходит в несколько фаз:
Первая фаза - адсорбция вируса на поверхности клетки, чувстви тельной к данному вирусу.
Вторая фаза - проникновение вируса в клетку хозяина путем виропексиса.
Третья фаза - «раздевание» вирионов, освобождение нуклеи новой кислоты вируса от суперкапсида и капсида. У ряда вирусов проникновение нуклеиновой кислоты в клетку происходит путем сли яния оболочки вириона и клетки-хозяина. В этом случае вторая и тре тья фазы объединяются в одну.
Четвертая фаза - синтез компонентов вириона. Нуклеиновая кис лота вируса образуется путем репликации. На рибосомы клетки транс лируется информация вирусной иРНК, и в них синтезируется вирус-специфический белок.
Пятая фаза - сборка вириона. Путем самосборки образуются нуклеокапсиды.
Шестая фаза - выход вирионов из клетки. Простые вирусы, на пример, вирус полиомиелита, при выходе из клетки разрушают ее. Сложноорганизованные вирусы, например, вирус гриппа, выходят из клетки путем почкования. Внешняя оболочка вируса (суперкапсид) формируется в процессе выхода вируса из клетки. Клетка при таком процессе на какое-то время остается живой
Культивирование вирусов. ДЛЯ культивирования вирусов используют ряд методов. Это культивирование в организме экспериментальных животных, развивающихся куриных вибрионах и культурах тканей (чаще — эмбриональные ткани или опухолевые клетки). Для выращивания клеток тканевых культур используют многокомпонентные питательные среды (среда 199, среда Игла и др.). Они содержат индикатор измерения рН среды и антибиотики для подавления возможного бактериального загрязнения.Культуры тканей могут быть переживающими, в которых жизнеспособность клеток удается сохранить лишь временно, и растущими, в которых клетки не только сохраняют жизнедеятельность, но и активно делятся.В роллерных культурах клетки ткани фиксированы на плотной основе (стекло) — чаще в один слой (однослойные), а в суспензированных —взвешены в жидкой среде. По количеству пассажей, выдерживаемых растущей культурой тканей, среди них различают:• первичные (первично-трипсинизированные) культуры тканей, которые выдерживают не более 5—10 пассажей;• полуперевиваемые культуры тканей, которые поддерживаются не более чем в 100 генерациях;• перевиваемые культуры тканей, которые поддерживаются в течение неопределенно длительного срока в многочисленных генерациях
8. Мутация вирусов. Нуклеиновые кислоты вирусов подвержены мутациям, то есть внезапным наследуемым изменениям. Сущность этих процессов заключается в нарушениях генетического кода в виде изменений нуклеотидных последовательностей, их выпадений (делеций), вставок либо перестановок нуклеотидов или пар в одно- и двухнитевых молекулах нуклеиновых кислот. Указанные нарушения могут ограничиваться отдельными нуклеотидами или же распространяться на более значительные участки. У вирусов выделяют спонтанные и индуцированные мутации. Их биологическое значение может быть связано с приобретением или потерей патогенных свойств, а также с приобретением свойств, лишающих их чувствительности к действию защитных механизмов организма-хозяина. Мутации, полностью нарушающие синтез или функцию жизненно важных белков, приводят к утрате способности к репродукции и иначе известны как летальные мутации. В их основе лежат изменения, приводящие к возникновению бессмысленных кодонов (с нарушением синтеза белковой цепочки) либо к появлению вставок или делеций (с глубокими нарушениями генетического кода). Мутации с потерей способности синтезировать определённый белок или с нарушением его функций, что в определённых условиях может привести к утрате способности к репродукции называют условно-летальными
9. Генетические и негенетич.Взаимодействия вирусов. Генетические взаимодействия между вирусами:
Комплеметация – если 1 вирус дефектен по к.-л. гену, или оба вируса дефектны по разным генам, то они продолжают расти в ассоциации в клетке. Если же оба вируса дефектны по одному и тому же гену, то комплементации нет.
Рекомбинация – вз-вие между вирусными геномами в смешанно-зараженных клетках, в рез-те чего дочерние геномы содержат генетический материал в комбинациях, отсутствующих у родителей.
Генетич. реактивация – частный случай рекомбинации, когда 1 или оба вируса неинфекционны, но при смешанном заражении дают потомство, которое несет инфекц. признаки.
Негенетические взаимодействия вирусов:
Гетерозиготность – состояние, при котором диплоидные хромосомы различаются по аллельным маркерам в 1 или нескольких локусах.
Интерференция бывает неск. типов:
а) гомологичная интерференция – хотя дефектный интерферирующий вирус конкурирует за компоненты репликационного аппарата с полными вирусами, они необязательно мешают репродукции полного вируса
б) супрессия – подавление мутантного феномена супрессорной мутацией. Фенотип вирусной мутации подавляется второй мутацией либо в вирусе, либоб в клетке, проиводя к реверсии фенотипа вируса, содержащего исходную мутацию
10.Патогенез вирусных инфекций.В основе патогенеза вирусных инфекций лежит взаимодействие генома вируса с генетическим аппаратом чувствительной клетки. Исключая поражения, вызываемые вирусами, распространяющимися по нервной ткани, патогенез вирусных инфекций сопровождает вирусемия (виремия)— циркуляция возбудителя в крови. В кровоток возбудитель проникает прямым путем или из лимфатической системы. Многие вирусы (например, ВИЧ, вирусы гриппа, кори, герпеса) поражают иммунокомпетентные клетки, что чаще проявляется в нарушении функций и уменьшении числа Т-хелперов, увеличении содержания и активации Т-супрессоров или В-клеток. Некоторые возбудители образуют внутриядерные или цитоплазматические тельца включений (например, тельца Бабеша~Нёгри). имеющие диагностическое значение.Основные этапы патогенеза вирусных инфекций Проникновение вируса в организм. Основные входные ворота для возбудителей вирусных инфекции человека — дыхательные пути и ЖКТ, реже — кожные покровы. В некоторых случаях развиваются локальные поражения, но чаще в месте проникновения не возникает каких-либо проявлений или они носят стёртый характер, а возбудитель мигрирует в чувствительные ткани. Распространение возбудителя в организме может носить локальный или системный характер. Локальные поражения вирусами типичны для возбудителей респираторных и кишечных инфекций, а также для некоторых кожных заболеваний. Продолжительность инкубационного периода большинства подобных инфекций составляет 2-3 сут. Первичную репликацию часто сопровождает вирусемия. Она обычно протекает бессимптомно или по типу продромальных явлений, но может возникать и на фоне выраженной клинической картины, не вызывая развития дополнительной симптоматики. Для подобных заболеваний характерно повторное заражение, так как циркулирующие AT не проявляют протективный эффект, а секреторный иммуноглобулин А (IgA) оказывает лишь кратковременное нейтрализующее действие на слизистой оболочке. Системные поражения. Из места проникновения возбудители попадают в кровоток, вызывая вирусемию, и постепенно фиксируются в чувствительных тканях. Первичное распространение обычно вызывает продромальные явления. Поскольку вирусемия предшествует поражению чувствительных тканей, то продолжительность инкубационного и продромального периодов подобных инфекций могут увеличиваться до 2-3 нед. Вирусемия при системных инфекциях обычно носит двухэтапный характер. Первый этап заканчивается поглощением циркулирующих вирусов клетками ретикулоэндотелиальной системы. В дальнейшем возможно несколько вариантов: • полная элиминация возбудителя (абортивная инфекция); • размножение вирусов в фагоцитах с последующим выходом и развитием выраженной вторичной вирусемии, сопровождающейся появлением характерных клинических признаков заболевания (например, энцефалитов)
11.Типы симметрии вирусов. Комплекс капсида и вирусного генома называют нуклеокапсидом. Он повторяет симметрию капсида, то есть обладает спиральной либо кубической симметрией соответственно (рис. 2-2). Спиральная симметрия. В нуклеокапсиде взаимодействие нуклеиновой кислоты и белка осуществляется по одной оси вращения. Каждый вирус со спиральной симметрией обладает характерной длиной, шириной и периодичностью нуклеокапсида. Нуклеокапсиды большинства патогенных для человека вирусов имеют спиральную симметрию (например, коронавирусы, рабдовирусы, пара- и ортомиксовирусы, буньявирусы и ареновирусы). К этой группе относят и вирус табачной мозаики. Организация по принципу спиральной симметрии придаёт вирусам палочковидную форму. При спиральной симметрии белковый чехол лучше защищает наследственную информацию, но требует большого количества белка, так как покрытие состоит из сравнительно крупных блоков.Кубическая симметрия. У подобных вирусов нуклеиновая кислота окружена капсомерами, образующими фигуру икосаэдра— многогранника с 12 вершинами, 20 треугольными гранями и 30 углами. К вирусам с подобной структурой относят аденовирусы, реовирусы, иридови-русы, герпесвирусы и пикорнавирусы. Организация по принципу кубической симметрии придаёт вирусам сферическую форму. Принцип кубической симметрии — самый экономичный для формирования замкнутого капсида, так как для его организации используются сравнительно небольшие белковые блоки, образующие большое внутреннее пространство, в которое свободно укладывается нуклеиновая кислота. Двойная симметрия. Некоторые бактериофаги (вирусы бактерий) имеют двойную симметрию: головка организована по принципу кубической симметрии, отросток — по принципу спиральной симметрии. Отсутствие постоянной симметрии. Для вирусов больших размеров (например, для поксвирусов) характерно отсутствие постоянной симметрии
12. реакции противовирусного иммунитета. НЕСПЕЦИФИЧЕСКИЕ КЛЕТОЧНЫЕ И ОБЩЕФИЗИОЛОГИЧЕСКИЕ РЕАКЦИИ Защитная роль температуры. При высокой температуре вырабатывается интерферон, который не позволяет размножатся вирусу. ВЛИЯНИЕ ГОРМНОВОВ-подавленеие вирусной репродукции. Гормоны кортизон и саматотропный. К неспецифическим факторам противовирусного иммунитета относится функция выделительной системы. Так, вирусы герпеса, введенные в организм естественно невосприимчивых и иммунных животных, могут выделяться со слюной, с секретом респираторного тракта, молоком и через кишечник. Гуморальные факторы неспецифической резистентности.
Ингибиторы сывороток крови. Помимо антител - специфического фактора противовирусного иммунитета - организм вырабатывает особые вирусотропные вещества - ингибиторы, способные взаимодействовать с вирусами и подавлять их активность. Сывороточные ингибиторы имеют широкий диапазон действия: одни подавляют гемаглютинирующие свойства вирусов, другие - их цитопатогенное действие, третьи - их инфекционную активность. Роль фагоцитоза в противовирусном иммунитете. Ранее считалось, что роль фагоцитоза в противовирусном иммунитете не имеет существенного значения. Однако, в защите организма от вирусных инфекций фагоцитоз играет важную роль, но оказывается фагоцитозом НЕ вирионов, а инфицированных ним чувствительных клеток, эритроцитов, тромбоцитов и других клеток, доступных для фагоцитоза.
13. СПЕЦИФИЧЕСКИЙ ПРИОБРЕТЕННИЙ ИММУНИТЕТПриобретенный иммунитет строго специфичен и по наследству не передается. Различают активно и пассивно приобретенный иммунитет. Первый из них развивается в результате естественного (клинически выраженного или бессимптомного) инфицирования или после вакцинации живыми или убитыми вакцинами. Пассивно приобретенный иммунитет может быть создан искусственно путем введения в организм иммунных сывороток, гамма-глобулинов, имунолактона, а также при введении эффекторных клеток, полученных от сингенного иммунного донора, передается от матери плоду через плаценту, желток яйца и при употреблении ребенком молозива в первые дни жизни .Пассивно приобретенный иммунитет, который создается введением иммунных сывороток (гамма-глобулинов), непродолжительный - 10-15 дней, при употреблении молозива от иммунных матерей зависит от напряженности иммунитета у матери.Продолжительность активно приобретенного иммунитета в результате инфицирования зависит от таких факторов, как имуногенная активность вируса, способа введения его в организм и возраста человека.
неспецифические факторы противовирусного иммунитета....(12)
Правила взятия, пересылки и подготовки пат.мат-ла. Для вирусологических исследований желательно направлять пробы от животных в трех стадиях болезни:
·от свежих трупов (кровь, кость, лимфоузел и пораженные органы);
·от убитых в агонии животных (кровь, кость, лимфоузлы и пораженные органы);
·от выздоравливающих животных (кровь).
Пробы необходимо брать асептически, не допуская их загрязнения, в стерильные флаконы (обычно из-под антибиотиков). Каждую пробу необходимо брать в отдельный флакон. Масса каждой пробы должна быть достаточной для исследования - не менее 5-10 мл, или грамм. Все флаконы должны герметически закрываться пробками (обычно резиновыми), продезинфицированы снаружи, высушены и маркированы. Надписи необходимо делать простым карандашом с указанием вида и номера животного, названия органа и даты взятия материала. Дополнительные данные, относящиеся к анамнезу, заболеваемости, размеру очага или вспышки, симптоматике, применявшимся вакцинам, препаратам и т.п., отражают в специальной карте или сопроводительном письме. Лучшие условия для сохранения проб материалов - замораживание.
Для пересылки образцы должны быть помещены в термосы со льдом или изотермические ящики, приспособленные для пересылки. Если образцы можно доставить в лабораторию в течение суток после отбора, то их не замораживают и не консервируют. Образцы, которые не могут быть доставлена в лабораторию в течение суток или в замороженном виде, необходимо консервировать глицерином. Он должен полностью покрывать кусочки взятых органов. Даже консервированные образцы желательно хранить в холодильнике.
Успешная и точная диагностика зависит от быстроты доставки материалов в лабораторию.
Правила работы с вируссодержпщим материалом. При работе с вируссодержащим материалом необходимо выполнять следующие требования: 1) не допускать рассеивания вирусов во внешней среде; 2) предотвратить контаминацию (загрязнение) вируссодержащего материала посторонней микрофлорой; 3) обеспечить личную безопасность. Работу с вируссодержащим материалом в лаборатории проводят только в спецодежде, выход за пределы лаборатории в спецодежде; вынос оборудования, инвентаря и т. д. без дезинфекции запрещен. Весь материал, поступающий в лабораторию на исследование, должен рассматриваться как инфицированный. При распаковке поступившего материала банки обтирают снаружи дезинфицирующим средством, ставят в кюветы. Рабочее место на столе покрывают марлей, увлажненной 5 % раствором хлорамина. Переливание жидкостей, содержащих вирусы, - только над кюветой с дезередством. Использованные пипетки, предметные покровные стекла, резиновые перчатки и т. д., бывшие в употреблении, помещают в 5 % раствор хлорамина, лизола, серной кислоты. Вируссодержащий материал тщательно маркируется, хранится в холодильнике и опечатывается. На этикетке указывают вирус, штамм, дату получения, объем и др. сведения, соответствующие записям в журнале. Вирусологическая лаборатория имеет основную документацию: - журнал вирусологических исследований; - журнал учета выделенных вирусов и их уничтожения; - журнал учета зараженных животных; - журнал учета движения производственных или музейных штаммов вирусов.
17. Факторы противовирусного иммунитета. Иммунную защиту макроорганизма при вирусных инфекциях осуществляет противовирусный иммунитет. Его особенности обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, интерферон и сывороточные ингибиторы вирусных частиц. Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, внутриклеточные структуры прижизненно для них недоступны. Антитела нейтрализуют вирусную частицу, препятствуя ее адсорбции на клетке-мишени, инфицированию и генерализации процесса, и обеспечивают иммунный фагоцитоз «маркированных» вирусных частиц. Специфические антитела также связывают вирусные белки и нуклеиновые кислоты, которые попадают в межклеточную среду и секреты после разрушения зараженных вирусами клеток.
18. Интерферон, его св-ва и роль в противовирусном иммунитете. Интерферон - особый противовирусный белок, продуцируемый зараженными клетками или целым организмом Свойства интерферона Природа интерферона. Интерферон представляет собой белок, обладающий противовирусным,
противоопухолевым и иммуно-модулирующим свойствами, вырабатываемый многими клетками в
ответ на внедрение вируса или сложных биополимеров. Интерферон гетерогенен по своему
составу, его молекулярная масса колеблется от 15 до 70 кД. Открыт в 1957 г. А. Айзексом
и Ж. Лин-деманом при изучении явления интерференции вирусов.
Семейство интерферонов включает более 20 белков, различающихся по физико-химическим
свойствам. Все они объединены в три группы по источнику происхождения: а, р, у. а-
Интерферон вырабатывается В-лимфоцитами; его получают из лейкоцитов крови, поэтому
называют лейкоцитарным. р-Интерфе-рон получают при заражении вирусами культуры клеток
фиб-робластов человека; его называют фибробластным. у-Интерферон получают из иммунных Т-
лимфоцитов, сенсибилизированных антигенами, поэтому его называют иммунным. Интерфероны
обладают видовой специфичностью, т.е. интерферон человека менее эффективен для животных
и наоборот.
Механизм действия. Противовирусное, антипролиферативное и иммуномодулирующее действие
интерферонов не связано с непосредственным влиянием на вирусы или клетки, т.е.
интерферон не действует вне клетки. Абсорбируясь на поверхности клетки или проникая
внутрь клетки, он через геном клетки влияет на процессы репродукции вируса или
пролиферацию клетки. Поэтому действие интерферона в основном профилактическое, но его
используют и в лечебных целях.
Значение интерферонов. Интерферон играет большую роль в поддержании резистентносте к
вирусам, поэтому его применяют для профилактики и лечения многих вирусных инфекций
(грипп, аденовирусы, герпес, вирусный гепатит и др.). Антипролиферативное действие,
особенно у-интерферона, используют для лечения злокачественных опухолей, а
иммуномодулирующее свойство . для коррекции работы иммунной системы с целью ее
нормализации при различных иммунодефицитах.
Разработан и производится ряд препаратов а-, р- и у-интерфе-ронов. Современные препараты
получают методами биотехнологии, основанными на принципах генетической инженерии
19.неспецифические ингибиторы вирусов их роль в противовирусном иммунитете.Ингибиторы, способные нейтрализовать активность вирусов, содержатся в плазме крови, секретах, тканях животных и человека; они действуют как на ДНК, так и на РНК-содержащие вирусы. Наряду с качественными и количественными различиями в содержании сывороточных ингибиторов у различных видов животных существуют индивидуальные, а также колебания в количестве ингибиторов у одного и того же животного в разные периоды жизни. Ингибиторы делятся на: 1) термолабильные (рингибиторы), разрушающиеся при температуре 62—65 °С в течение часа, 2) термостабильные: умеренно термостабильные (аингибиторы), разрушающиеся при температуре 75 °С, и высокотермостабильные (уингибиторы), выдерживающие нагревание до 100 °С.
Термолабильные рингибиторы, являющиеся липопротеинами, обычно очень активны и способны нейтрализовать инфекционную активность ряда вирусов: гриппа (типов А и В), парагриппозных, аденовирусов, энтеровирусов, вируса кори и др.
Умеренно термостабильные «ингибиторы (ингибитор Френсиса) являются мукопротеинами. Высокотермостабильный уингибитор обнаружен в сыворотке крови многих животных и человека. Активность его очень велика: он способен нейтрализовать сотни и тысячи инфекционных доз вируса гриппа. По химическому составу ингибитор является нерастворимым эйглобулином, соединенным с белком. Количество ингибиторов в организме животных при заболевании или иммунизации изменяется.
Механизм действия вирусных ингибиторов и антител сходен. При взаимодействии с вирусами ингибиторы оседают на поверхности вириона, блокируя его, в результате чего вирус теряет способность адсорбироваться чувствительной клеткой, не может в нее проникнуть и репродуцироваться. Поскольку ингибиторы обладают довольно широким спектром активности в отношении различных вирусов, их можно считать факторами неспецифического иммунитета. Однако некоторая специфичность действия ингибиторов все же имеется. Она связана с общими химическими группами у вирусных частиц, которые и взаимодействуют с ингибиторами. Так, ингибиторы, относящиеся к категории мукополисахаридов и имеющие в составе нейраминовую кислоту, нейтрализуют миксовирусы, а ингибиторы, относящиеся к категории липопротеинов, подавляют активность вирусов полиомиелита, клещевого энцефалита и др.
Одним из основных факторов неспецифического иммунитета является интерферон, открытый в 1957 г. Айзексом и Линдеманом, которые обнаружили его в клетках хорион-аллантоисной оболочки (ХАО) куриного эмбриона, зараженного вирусом гриппа.
20.принцип диагностики вирусных заболеваний.Для постановки диагноза требуется сбор, изучение, анализ и сопоставление целого комплекса различных данных. Поэтому диагноз — результат кропотливой и вдумчивой работы.
На первом этапе диагностики используют данные, которые можно быстро собрать непосредственно в хозяйстве. К таковым относятся:
l эпизоотологические данные, включающие свои сведения об охвате болезнью данного поголовья животных, скорости и территориальном распространении болезни, видах заболевших животных, динамике выявления больных и т,д. ;
l клинические признаки болезни. Они включают определение (по сравнению с нормой) температуы тела, частоты и формы дыхания, частоты пульса, нарушение аппетита, поведение, состояния кожных покровов и слизистых оболочек, функционирования органов пищеварения, выделения т.д. ;
l патологоанатомические изменения, которые обычно устанавливают при вскрытии павших животных. Различают макроскопические изменения (по сравнению с нормой) формы, размера, цвета, консистенции, появление узелков, кровоизлияний, везикул и другие образования, не встречающиеся в норме, а также микроскопические изменения в клетках и тканях, обнаруживаемые гистологическими методами.
Чаще всего на основании этих данных можно поставить предварительный диагноз, так как многие вирусные болезни имеют сходные эпизоотологические данные, клинические признаки и патологоанатомические изменения
21. Живые противовирусные вакцины. Получения, св-ва, отличие от инактивированных вакцин. Почти все эффективные противовирусные вакцины, применяемые в медицине и ветеринарии,— это живые невирулентные вирусы. Все они обладают явными преимуществами по сравнению с инактивированными вакцинами. Размножение в организме хозяина, дающее длительный иммуногенный стимул, аналогичный наблюдаемому при спонтанной субклинической инфекции, создает выраженный иммунитет. Живые вакцины изготовляют на основе ослабленных штаммов микроорганизма со стойко закрепленнойавирулентностью (безвредностью). Вакцинный штамм после введения размножается в организме привитого и вызывает вакцинальный инфекционный процесс. У большинства привитых вакцинальная инфекция протекает без выраженных клинических симптомов и приводит к формированию, как правило, стойкого иммунитета. Примером живых вакцин могут служить вакцины для профилактики краснухи, кори, полиомиелита, туберкулеза, паротита.
22. инактивированные вакцины. Инактивированные вакцины - это иммунопрепараты, в которых содержатся микроорганизмы, обработанные таким образом, что потеряли способность к размножению. Понятие «инактивированный следовательно, относится к жизнеспособности микроорганизмов, входящих в состав данной вакцины. Инактивированные вакцины имеют особенно сложный состав. Они содержат не только иммунизирующие компоненты, но и в форме составных частей сред, инактивирующих веществ, адъювантов и т. д. Целый ряд сопутствующих соединений, обладающих антигенным, аллергенным и отчасти даже токсическим действием. Вызываемые ими непреднамеренно побочные явления, особенно в форме аллергических реакций, нередко сказываются отрицательно как на самих привитых животных, так и на экономике их содержания. Поэтому для изготовления инактивированных вакцин стремятся применять очищенные антигены, получаемые путем адсорбции, фильтрации, осаждения, экстрагирования, электрофоретического разделения и т.п. кроме того, изучение структуры возбудителя позволяет применять для производства вакцин инактивированные микроорганизмы уже не в цельном виде, а только в виде их иммуногенных компонентов. Уже апробируются так называемые расщепленные вакцины (субъединичные вакцины), которые в принципе содержат только концентрированный иммуногенный частичный антиген данного возбудителя. Несмотря па все меры, инактивированные вакцины далеко не обеспечивают обычно такой напряженной и длительной защиты, как живые вакцины. К тому же и наступает она гораздо позднее, так как инактивированные вакцины обеспечивают удовлетворительный иммунитет обычно как минимум после одной ревакцинации с интервалом 1-3 недели. Пожалуй, по этим причинам инактивированные вакцины и утратили свое значение, хотя это ни в коем случае не относится к ветеринарии. И в ближайшем будущем они будут использоваться для борьбы с инфекционными болезнями, например в профилактике ящура
