
obschaya_mikrobiologia_metodicheskie_ukazania
.pdf7. Положительный контроль – образец ДНК выделяемой биологической системы.
Оборудование. Важным фактором воспроизводимости реакции амплификации является приборное обеспечение. Основным прибором для проведения ПЦР является амплификатор (термоциклер), представляющий собой аппарат, в гнезда которого устанавливаются специальные амплификационные пробирки, изготовленные из особого термопроводимого пластика, с реакционной смесью или предметные стекла с образцами тканей. Различными фирмами выпускается большое количество разнообразных моделей амплификаторов. Модели отличаются друг от друга системами охлаждения (водяное, воздушное, фреоном и более надежное и современное – на полупроводниковых кристаллах), способами обогрева (передача тепла через пробирки с жидкостью и воздушная передача тепла в микроколориметр для обогрева срезов тканей, мазков и т.д.), объемом памяти при программировании, режимами регулирования смены температуры (по матрице, активное), количеством платформ (от 1 до 4). Последние модели осуществляют амплификацию по одной и той же программе на нескольких платформах сразу, что позволяет увеличивать число анализируемых одновременно проб или проводить амплификацию на разных платформах по нескольким разным программам для одновременного анализа проб на наличие нескольких типов возбудителей.
Если в анализируемом образце присутствует искомая ДНК, то в ходе реакции амплификации с ней происходит ряд процессов, обеспечиваемых определенными температурными циклами. Параметры температурного режима играют исключительно важную роль для успешного проведения реакции.
Описанный метод «классической» направленной полимеразной цепной реакции, который используется в тест-системах первого поколения, претерпевает в настоящее время значительные изменения, связанные с разработкой и внедрением различных тест-систем (в том числе отечественных) для ПЦР-диагностики второго (применяемых для количественного анализа ДНКРНК) и третьего («сухих» тест-систем, находящихся в стадии разработки) поколений, а также различных модификаций ПЦР (лонг-ПЦР, гнездная ПЦР, РТ-ПЦР, LIPA-ПЦР-технология, ПЦР in situ, мультиплексная ПЦР) и альтернативных методов амплификации нуклеиновых кислот.
Основное отличие тест-систем ПЦР второго поколения (ген-гем-тест НС) от первого – наличие внутреннего стандарта, который представляет собой ДНК или РНК выявляемого возбудителя в концентрации от 10 до 100 молекул, которая амплифицируется одновременно с фрагментом гена инфекционного агента, но детектируется при этом в виде отдельных сигналов. При этом гарантируется достоверность «отрицательного» результата ПЦРопределения инфекционного агента и своевременного выявления ложноположительных результатов. Наличие внутреннего стандарта при использовании системы видеокомпьютерной детекции позволяет рассчитать концентрацию возбудителя в пробе, т. е. оценить нагрузку (вирусную, бактериальную или иной природы) – количество возбудителя в единице биологического
61
материала. Повысить чувствительность и специфичность тест-системы второго поколения можно при использовании модификации ПЦР, такой как nested-PCR («гнездная» ПЦР) с использованием внутреннего стандарта, что нашло применение в тест-системах второго поколения, рекомендованных для диагностики ВИЧ-инфекции.
Для удобства транспортировки и хранения систем генотестирования, а также для обеспечения стандартности проведения анализов произведена разработка «сухих» тест-систем третьего поколения. Их несомненными преимуществами по сравнению с аналогичными «жидкими» тест-системами являются возможность хранения и транспортировки при любой температуре (от –40 °С до +30 °С), ускорение и упрощение работы исполнителя. При этом тест-системы третьего поколения позволяют использовать все преимущества тест-систем первого и второго поколений в различных модификациях.
Мультиплексная ПЦР (multi-PCR – multi-polymerase chain reaction).
Например, позволяет проводить ПЦР с двумя-четырьмя и более неперекрещивающимися праймерами нескольких возбудителей. Это дает возможность определить в одной пробе нуклеиновые кислоты сразу нескольких возбудителей, что особенно актуально, так как часто при диагностике обнаруживаются смешанные формы инфицирования.
В последнее время для выявления ДНК-мишени используются альтернативные методы, не уступающие по чувствительности и специфичности методикам, основанным на методе ПЦР, но существенно более быстрые по времени выполнения. Принципы этих методов несколько отличны от классического варианта ПЦР.
Детекция продуктов амплификации методом гель-электрофореза.
Выявление или детекцию наработанного продукта ПЦР (амплификата) чаще всего проводят при помощи его электрофореза в 2–3% геле агарозы или полиакриламидном геле (ПААГ), содержащем бромид этидия (специфический интеркалирующий флуоресцентный ДНК(РНК)-краситель). Поглощая ультрафиолетовый свет с максимальной длиной волны 256 нм, бромид этидия, связанный с участком ДНК (ампликоном), способен в соответствии с правилом Стокса флюоресцировать, что регистрируется в видимом спектре (610– 620 нм) в виде оранжевой полоски. Получаемые результаты электрофореза ампликонов оценивают в проходящем ультрафиолетовом свете на специальных приборах – трансиллюминаторах и сравнивают с положительным контролем (ДНК выявляемого микроорганизма или известная ДНК). При положительном результате светящаяся полоска ДНК находится на том же уровне, что и положительный контроль, вследствие одинаковой относительной молекулярной массы наработанных ампликонов в контроле и изучаемом положительном образце.
Методы повышения количества амплифицированной ДНК (усиле-
ния ПЦР-сигнала) при низкой концентрации ДНК-матрицы (вируса, бактерии, мутантных и иных генов):
1 – усиление денатурации ДНК-матрицы: денатурировать ДНК при +94…–99°С до начала ПЦР или удлинить начальную денатурацию до 3–5 мин;
62
2 – увеличение специфичности праймеров: при длине 20–30 пар содержание Г + Ц должно составлять около 50 %;
3 – применение «горячего старта» – прогревание пробирок с ПЦРамплификационной смесью (без фермента и магния) при температуре +95 °С в течение 3–5 мин (предупреждение амплификации неспецифических ДНКфрагментов вследствие низкотемпературного неспецифического спаривания праймеров). Суть подхода, получившего название «горячий старт» (Hot-start), состоит в предотвращении возможности начала реакции до момента достижения в пробирке условий, обеспечивающих специфический отжиг.
4– применение метода «гнездной» амплификации. Суть его заключается в последовательном использовании двух пар праймеров – внешней и внутренней. После использования первой пары праймеров продукт амплификации переносят в другую пробирку с внутренней парой праймеров. Иногда вместо «гнездной» амплификации используют процесс реамплификации. В этом случае проводят дополнительный раунд амплификации, в котором используют прежнюю пару праймеров, а в качестве ДНК-мишени – продукт первой реакции амплификации. Такая схема постановки амплификации более трудоемка и требует особенно тщательного обустройства лабораторных помещений, позволяющих гарантированно избегать контаминации продуктами реакции после использования внешней пары праймеров. К «гнездной» амплификации или реамплификации прибегают лишь в особых случаях, так как современные ПЦР-тест-системы позволяют добиваться тех же результатов иными средствами.
5– увеличение продолжительности ПЦР до 40 циклов.
6– применение более чувствительных методов детекции амплифицированной ДНК (компьютерная видеодетекция гельэлектрофореграмм; дотгибридизация и использование меченных флуорохромами, лантаноидами, химическими веществами, вызывающими хемилюминесценцию, моноклональных антител).
Потенциально высокая чувствительность полимеразной цепной реакции делает совершенно необходимым особенно тщательное устройство ПЦРлаборатории, что связано с наиболее острой проблемой метода – контаминацией.
Контаминация – попадание из внешней среды в реакционную смесь молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные результаты. Такими мишенями могут быть продукты реакции, попадающие во внешнюю среду на этапе электрофореза из пробирок, в которых успешно прошла амплификация, либо специфическая ДНК из образцов на этапе пробоподготовки.
Для уверенности в отсутствии контаминации необходимо каждую серию экспериментов сопровождать отрицательными контролями.
Преимущества ПЦР.
1. Полимеразная цепная реакция в настоящее время является наиболее совершенным диагностическим методом, позволяющим выявлять единичные клетки возбудителей многих инфекционных заболеваний за счет многократ-
63
ного увеличения количества копий тестируемых специфических последовательностей ДНК.
2.Тест-системы, основанные на принципе амплификации ДНК, позволяют обнаруживать патогенные для человека бактерии и вирусы даже в тех случаях, когда другими способами (иммунологическим, бактериологическим, микроскопическим) их выявление невозможно. Это преимущество достигается за счет высокой чувствительности ПЦР-системы, которая составляет около 10 бактериальных клеток, в то время как чувствительность других тестов колеблется в пределах 103–106 клеток.
3.Тест-системы на основе ПЦР эффективны при диагностике труднокультивируемых, некультивируемых и персистирующих форм патогенных бактерий. ПЦР-диагностикумы позволяют избежать основной трудности, связанной с неспособностью таких бактерий размножаться в лабораторных условиях. При ПЦР-диагностике размножению подвергается не бактерия, а только ее ДНК, причем не вся молекула ДНК, а только определенный фрагмент, являющийся маркером данного возбудителя.
4.ПЦР-диагностикумы, в отличие от иммунологических тест-систем, позволяют избежать проблем, связанных с перекрестно-реагирующими антигенами, тем самым обеспечивая абсолютную специфичность.
5.Определение можно проводить непосредственно в клиническом материале (кровь, сыворотка, лаважные массы, мокрота, слюна, желудочный сок, биопсийный материал, мазки, смывы) и в материале, получаемом из объектов внешней среды (вода, почва).
ПЦР длительное время являлась лишь качественным методом диагно-
стики, но сегодня существует количественная ПЦР в реальном времени
(Quantitative real-time PCR). В этом методе используют флуоресцентно меченные реагенты для точного измерения количества продукта реакции по мере его накопления.
Устройство ПЦР-лаборатории. ПЦР-лаборатория должна быть разделена на три зоны по числу технологических операций:
1 – зона подготовки реакционной смеси («чистая зона»); 2 – зона пробоподготовки;
3– электрофоретическая комната.
Все три зоны должны быть изолированными комнатами, снабженными предбоксниками. Полезно иметь устройство фильтрации воздуха. Если первую и вторую зоны в крайнем случае допускается объединить (при наличии специальных боксов), то комната для электрофореза должна размещаться как можно дальше от двух других зон (другой этаж, другое здание) и иметь не связанную с другими зонами систему вентиляции. Это является одним из наиболее важных требований при организации ПЦР-лаборатории.
Необходимо предусмотреть отдельные помещения для переодевания и хранения верхней одежды, приема пищи персоналом, складское помещение для лабораторных материалов.
64
Все производственные комнаты должны быть снабжены коротковолновыми УФ-лампами. Перемещение пробирок, штативов и прочего должно производиться только в одном направлении, при этом потоки не должны пересекаться.
Клинический материал, поступивший в лабораторию, должен быть как можно быстрее обработан в комнате пробоподготовки. В эту же комнату должны поступать пробирки с реакционной смесью из «чистой зоны» для внесения в них препаратов ДНК. После этого пробирки помещают в амплификатор и по окончании термоциклирования, не открывая крышек, переносят в комнату для электрофореза.
В идеале все операции (пробоподготовка, подготовка реакционной смеси, электрофорез) должны выполнять разные люди.
При работе необходимо соблюдать такие же строгие меры предосторожности, как и используемые в микробиологической лаборатории.
Для обработки клинических образцов должны быть установлены ламинарные шкафы, обеспечивающие вертикальный поток воздуха для безопасности персонала при работе с инфекционным материалом, а также предусматривающие возможность работы без ламинарного потока и длительное облучение внутренних поверхностей бокса УФ-светом.
Инактивацию биологического материала проводят в автоклаве в течение 1 ч при 1,5 атм. Допускается использование настольных автоклавов.
Запрещается внесение пробирок с положительными контролями или клиническими образцами как до, так и после обработки в комнату подготовки реакционной смеси («чистую зону»).
Все производственные комнаты должны быть снабжены необходимым оборудованием и расходными материалами, в том числе халатами, закрепленными за соответствующими помещениями.
Оформление лабораторной тетради
Зарисовать схемы постановки методов по трансформации, конъюгации и выявлению Col-плазмид, записать результаты.
ЗАНЯТИЕ 10
Тема: БАКТЕРИОФАГ. ВЗАИМОДЕЙСТВИЕ ФАГА С БАКТЕРИАЛЬНОЙ КЛЕТКОЙ. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
ЯВЛЕНИЯ БАКТЕРИОФАГИИ
Цель занятия: изучить строение и свойства вирулентных и умеренных бактериофагов, их взаимодействие с бактериальной клеткой, освоить качественные и количественные методы определения фагов.
65
План занятия
1.Строение и свойства бактериофага.
2.Вирулентные и умеренные фаги. Их отличия, типы взаимодействия с микробной клеткой.
3.Взаимодействие вирулентного фага с бактериальной клеткой.
4.Умеренный бактериофаг. Явление лизогении и фаговой конверсии.
5.Применение бактериофага в практической медицине. Методы выделения фага из объектов окружающей среды.
6.Качественные и количественные методы определения фагов.
7.Фаготипирование бактерий.
Задания для выполнения лабораторной работы
1. Провести опыт титрования бактериофага методом Аппельмана. Учесть результат по демонстрационным препаратам.
Титрование бактериофага на жидких средах (метод Аппельмана).
В десять пробирок помещают по 4,5 МПБ. В первую вносят 0,5 мл фага (разведение 10–1), затем берут 0,5 мл и переносят во вторую (разведение 10–2) и т.д. до десятой пробирки (разведение 10–10). Далее в них вносят по 1 капле культуры кишечной палочки, помещают в термостат и через сутки проводят учет результатов. В пробирках, где оказался хотя бы один фаг, роста культуры не будет. Титр фага – то последнее разведение, в котором произошел лизис микроорганизмов (обозначается 10–4 и т.д.).
2. Определить специфичность бактериофага методом Отто. Учесть результаты по демонстрационным препаратам.
Определение специфичности бактериофага
Растопленный 3% мясопептонный агар разливают в стерильные чашки Петри. Охлажденные чашки Петри подсушивают в термостате в течение 10– 15 мин. На поверхность питательной среды засевают «газоном» бульонную культуру бактерий, гомологичных искомому бактериофагу, наносят каплю известного фага, чашку наклоняют и дают капле фага стечь к противоположному краю. Чашки инкубируют в термостате 16–18 ч и учитывают результат. Если фаг гомологичен микроорганизму и биологически активен, то по пути стекания капли роста микробов не будет, среда останется прозрачной.
Вопросы для обсуждения
1.Строение бактериофага (табл. 10, рис. 15). 2. Свойства бактериофага
итипы его взаимодействия с микробной клеткой. 3. Отличия вирулентного и умеренного бактериофага. 4. Взаимодействие вирулентного бактериофага с бактериальной клеткой. 5. Особенности взаимодействия умеренного бактериофага с микробной клеткой. 6. Явление лизогении и фаговой конверсии. 7. Применение бактериофага в практической медицине. 8. Методы выделения
66

фага из объектов окружающей среды. 9. Качественные методы определения фагов. 10. Количественные методы определения фагов. 11. Определение спектра литического действия фага. 12. Фаготипирование бактерий. 13. Определение лизогении.
Дополнительный материал
Репродукция вирулентного фага в клетках бульонной бактериальной культуры сопровождается их лизисом и просветлением среды (рис. 14). На газоне чувствительных бактерий, выращенных на агаровой среде в чашке Петри, фаги образуют зоны очагового или сплошного лизиса, что зависит от их концентрации. Зоны очагового лизиса получили название негативных колоний фага или «стерильных пятен» (бляшек) (рис. 13).
Фаголизис (стерильное пятно)
|
|
|
Рост культуры ста- |
|
|
МПБ |
||||
|
|
|
филококка «газоном» |
|
МПБ |
Отсут- |
||||
|
|
|
|
|
Рост |
ствует рост |
||||
|
|
|
|
|
E. coli |
E. coli |
||||
|
|
|
|
|
|
(фаголизис) |
||||
|
|
|
|
Рис. 14. Лизис бульонной культуры |
||||||
|
Рис. 13. Лизис культуры стафилококка |
|
E. coli специфическим |
|||||||
|
|
специфическим бактериофагом |
|
бактериофагом |
||||||
|
|
|
Классификация фагов по форме |
Таблица 10 |
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С длинным |
|
Нитевидные |
С аналогом |
Без отростка |
С коротким |
С длинным |
отростком и |
|
отростка |
отростком |
отростком |
сокращающим- |
|||
|
|
|||||
|
|
|
|
|
ся чехлом |
67
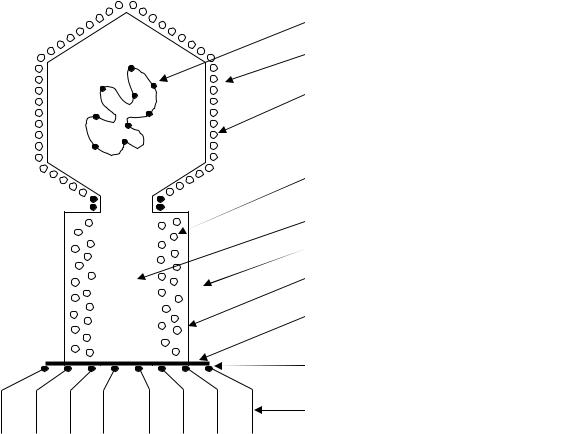
Большинство фагов характеризуется видовой специфичностью в отно- |
шении бактерий. Однако существуют фаги, способные поражать только от- |
дельные варианты одного и того же вида бактерий. Их используют для опре- |
деления фаговаров (фаготипов) внутри данного вида. |
Нуклеиновая кислота |
Головка |
Полипептидные субъединицы (кубиче- |
ский тип) образуют оболочку - капсулу |
Полипептидные субъединицы |
(спиральный тип) |
Полый стержень |
Отросток |
Чехол (сокращающийся) |
Шестиугольная базальная пластина |
Зубцы |
Нити |
Рис. 15. Структура фага |
Оформление лабораторной тетради
Зарисовать схему титрования фага по Аппельману и отметить полученный результат; записать результат определения специфичности бактериофага методом Отто.
68
Т Е С Т О В Ы Й К О Н Т Р О Л Ь
МОРФОЛОГИЯ И СТРУКТУРА МИКРООРГАНИЗМОВ
ВЫБЕРИТЕ ОДИН ИЛИ НЕСКОЛЬКО ПРАВИЛЬНЫХ ОТВЕТОВ
1.С именем какого ученого связано открытие сущности брожения [1857], микробной обусловленности и заразности инфекционных болезней [1881], методов изготовления вакцин и способов профилактики куриной холеры, сибирской язвы и бешенства [1882– 1885]?
1.Левенгук
2.Мечников
3.Кох
4.Пастер
2.Ученые–основоположники физиологического периода развития микробиологии:
1.Левенгук
2.Пастер
3.Мечников
4.Кох
3.Структурные особенности прокариотов:
1.Константа седиментации рибосом 70S
2.Имеется нуклеоид
3.Отсутствует аппарат Гольджи
4.Отсутствует ядерная мембрана
4.Липополисахарид бактериальной клетки расположен в:
1.Цитоплазматической мембране
2.Наружной мембране грамположительных бактерий
3.Мезосомах
4.Наружной мембране грамотрицательных бактерий
5.Компоненты ЛПС бактерий:
1.Липид А
2.Базисная часть (КДО)
3.Полисахаридная боковая цепь
4.Белок-порин
6.Свойства ЛПС:
1.Является эндотоксином
2.Термолабилен
3.Является О-антигеном
4.Содержит пептидогликан
7.В состав пептидогликана входят:
1.Тейхоевые кислоты
2.N-ацетилглюкозамин и М-ацетилмурамовая кислота
3.Липополисахарид (ЛПС)
4.Фосфолипиды
69
8.Микробы, у которых клеточная стенка в основном состоит из пептидогликана:
1.Грамотрицательные бактерии
2.Актиномицеты
3.Грамположительные бактерии
4.Грибы
9.К спирохетам относятся:
1.Трепонемы
2.Боррелии
3.Лептоспиры
4.Микоплазмы
10.Основные морфологические разновидности бактерий:
1.Кокки
2.Палочки
3.Извитые
4.Ветвящиеся
11.Тинкториальные свойства бактерий характеризуют:
1.Устойчивость во внешней среде
2.Устойчивость к действию физических факторов
3.Чувствительность к бактериофагам
4.Отношение к определенному методу окрашивания
12.Сложные дифференциально-диагностические методы окраски:
1.Окраска по Цилю–Нельсену
2.Окраска синим Леффлера
3.Окраска по Граму
4.Окраска разведенным карболовым фуксином
13.Признаки грамотрицательных бактерий:
1.Клеточная стенка состоит из бислоя фосфолипидов и внутреннего ригидного пептидогликанового слоя
2.Имеется периплазматическое пространство
3.Имеется ЛПС
4.Отсутствует пептидогликан
14.Признаки грамположительных бактерий:
1.В клеточной стенке есть тейхоевые кислоты
2.Могут образовывать споры
3.Основной компонент клеточной стенки - пептидогликан
4.Отдельные представители имеют эндотоксины
15.Микроорганизмы, частично или полностью утратившие клеточную стенку под действием факторов внешней среды:
1.Сферопласты
2.Протопласты
3.L-формы
4.Микоплазмы
70
