
Моторная (двигательная) функция
Целый класс моторных белков обеспечивает движения организма, например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт (кинезин, динеин). Динеины и кинезины проводят транспортировку молекул вдоль микротрубочек с использованием гидролиза АТФ в качестве источника энергии. Динеины переносят молекулы и органоиды из периферических частей клетки по направлению к центросоме, кинезины — в противоположном направлении[76][77]. Динеины также отвечают за движение ресничек и жгутиков эукариот. Цитоплазматические варианты миозина могут принимать участие в транспорте молекул и органоидов по микрофиламентам.
Белки в обмене веществ
Большинство микроорганизмов и растений могут синтезировать 20 стандартных аминокислот, а также дополнительные (нестандартные) аминокислоты, например,цитруллин. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей[78].
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии[79]. Аминокислоты также являются важным источником азота в питании организма.
Единых норм потребления белков человеком нет. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Методы изучения
Поскольку белки являются одними из наиболее часто изучаемых биологических молекул, структура и функции белков определяются как в очищеном состоянии in vitro, так и в естественных условиях, in vivo. Исследование чистых белков в контролируемых условиях полезны для определения функции белка: например, кинетикукаталитической активности фермента и его относительное сродство к различным возможным молекулам субстрата. In vivo эксперименты по деятельности белков в клетках или даже в целых организмамх могут предоставить дополнительную информацию о том, где белок функционирует и как он регулируется[80].
Молекулярной и клеточной биологии
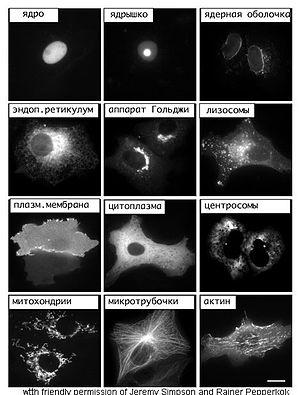
На фотографиях разные белки, помеченные зеленым флуоресцентным белком показывает расположение различных частей клетки
Методы молекулярной и клеточной биологии обычно применяются для изучения синтеза и расположения белков в клетке. Полезный метод изучения расположения белков использует генную инженерию, чтобы экспрессировать в клетке белковую химеру, состоящую из интересующего белка, соединенного с «репортером», например, зеленым флуоресцентным белком (GFP)[81]. Расположение белка-химеры в можно увидеть с помощью микроскопа[82].
Другой метод изучения локализации белков использует известные белки таких органелл, как эндоплазматический ретикулум, аппарат Гольджи, лизосомы и вакуоли и т. п. С помощью флуоресцентных меток, прикрепленных к этим белкам или антител к ним, становится гораздо проще определить локализацию изучаемогоо белка[83].
Иммуногистохимические методы обычно используют антитела, которые коньюгированы с ферментами, продуцирующими люминесцентный или цветной сигнал, который позволяет сравнить положение и число изучаемого белка в образцах. Более редкой методикой определения расположения белков является центрифугирование клеточных фракций в градиенте сахарозы или хлорида цезия с помощью равновесного центрифугирования[84][85].
Наконец, один из классических методов — это иммуноэлектронная микроскопия. Эта техника также использует антитела к изучаемому белку, наряду с методами электронной микроскопии. Образец подготавливается для электронной микроскопии, а затем обрабатывается антителами к белку, которые спединены с электро-плотным материалом, как правило, золотом[86].
С помощью сайт-направленного мутагенеза, исследователи могут изменять аминокислотную последовательность белка и, следовательно, его структуру, расположение в клетке и его регуляцию. С помощью этого метода, используя модифицированные тРНК[87], можно также ввести в белок искусственные аминокислоты, и сконструировать белки с новыми свойствами[88].
