
История изучения

Антуан Франсуа де Фуркруа, основоположник изучения белков
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана де Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) иглютен из зерна пшеницы.
В начале XIX века уже были получены некоторые сведения об элементарном составе белков, было известно, что при гидролизе белков образуются аминокислоты. Некоторые из этих аминокислот (например, глицин и лейцин) уже были охарактеризованы. Голландский химик Геррит Мульдер на основе анализа химического состава белков выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. В 1836 году Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов, он после нескольких уточнений пришёл к выводу, что минимальная структурная единица белка обладает следующим составом: C40H62N10O12. Эту единицу он назвал «протеином» (Pr) (от греч. протос — первый, первичный), а теорию — «теорией протеина»[4]. Сам термин «протеин» был предложен ещё шведским химиком Якобом Берцелиусом[5]. Согласно представлениям Мульдера, каждый белок состоит из нескольких протеинных единиц, серы и фосфора. Например, он предложил записывать формулу фибрина как 10PrSP. Мульдер также исследовал продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон. По мере накопления новых данных о белках теория протеина стала подвергаться критике, но, несмотря на это, до конца 1850-х всё ещё считалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков[6]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза.
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии по химии) показал, что фермент уреаза является белком[7].
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые легко могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих исследований.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотными остатками, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга (англ.)русск., внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В конце 1940-х — начале 1950-х годов Фредерик Сенгер разработал метод секвенирования белков, с помощью которого он к 1955 году определил аминокислотную последовательность двух цепей инсулина[8][9][10], продемонстрировав, что белки — это линейные полимеры аминокислот, а не разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые пространственные структуры белков, полученные методом дифракции рентгеновских лучей (рентгеноструктурного анализа) стали известны в конце 1950-х — начале 1960-х годов, а структуры открытые с помощью ядерного магнитного резонанса — в 1980-х годах. В 2012 году Банк данных о белках (Protein Data Bank) содержал около 87 000 структур белков[11].
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или целых организмов. Эта область биохимии называетсяпротеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгеноструктурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия крупных белковых комплексов и предсказание пространственных структур белковых доменов с помощью компьютерных программ приближаются к атомарной точности[12].
Свойства [править]
Размер [править]
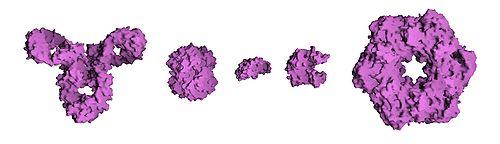
![]()
Сравнительный размер молекул белков. Слева направо: антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)
Размер белка может измеряться в числе аминокислотных остатков или в дальтонах(молекулярная масса), но из-за относительно большой величины молекулы масса белка выражается в производных единицах — килодальтонах (кДа). Белкидрожжей, в среднем, состоят из 466 аминокислотных остатков и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных вариантов (изоформ) варьирует в интервале от 3000 до 3700 кДа. Титин камбаловидной мышцы (лат. soleus) человека состоит из 38 138 аминокислот[13].
Для определения молекулярной массы белков применяют такие методы, как гель-фильтрация, электрофорез в полиакриламидном геле, масс-спектрометрический анализ, седиментационный анализ и другие[14].
Физико-химические свойства [править]
Амфотерность [править]
Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. В белках присутствуют несколько типов химических группировок, способных к ионизации в водном растворе: карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь, ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Каждый белок характеризуется изоэлектрической точкой (pI) — кислотностью среды (pH), при которой суммарныйэлектрический заряд молекул данного белка равен нулю и, соответственно, они не перемещаются в электрическом поле (например, при электрофорезе). В изоэлектрической точке гидратация и растворимость белка минимальны. Величина pI зависит от соотношения кислых и основных аминокислотных остатков в белке: у белков, содержащих много кислых аминокислотных остатков, изоэлектрические точки лежат в кислой области (такие белки называют кислыми), а у белков, содержащих больше основных остатков, — в щелочной (основные белки). Значение pI данного белка также может меняться в зависимости от ионной силы и типа буферного раствора, в котором он находится, так как нейтральные соли влияют на степень ионизации химических группировок белка. pI белка можно определить, например, из кривой титрования или с помощью изоэлектрофокусирования[14].
В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1[15], а для сальмина — белка-протамина молок лосося, особенностью которого является высокое содержание аргинина, — pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными группами, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Растворимость [править]
Белки различаются по степени растворимости в воде. Водорастворимые белки называются альбуминами, к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в составшёлка и паутины[16]. Растворимость белка определяется не только его структурой, но внешними факторами, такими как природа растворителя, ионная сила и pH раствора[14].
Белки также делятся на гидрофильные и гидрофобные (водооталкивающие). К гидрофильным относится большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относится большинство белков, входящих в состав биологических мембран, — интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны[17] (у этих белков, как правило, есть и гидрофильные участки).
Денатурация [править]

![]()
Необратимая денатурация белка куриного яйца под воздействием высокой температуры
Основная статья: Денатурация белков
Денатурацией белка называют любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры (см. раздел «Структура белка»). Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме[7]. Резкое изменение этих условий приводит к денатурации белка. В зависимости от природы денатурирующего агента выделяют механическую (сильное перемешивание или встряхивание), физическую (нагревание, охлаждение, облучение, обработка ультразвуком) и химическую (кислоты и щёлочи, поверхностно-активные вещества, мочевина) денатурацию[14].
Денатурация белка может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения водорастворимых белков с помощью солей аммония, и используется как способ их очистки[18].
Структура [править]
![]()
![]()
Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине, синтезирующей белок, — рибосоме
Молекулы белков представляют собой линейные полимеры, состоящие из остатков α-L-аминокислот (которые являются мономерами), также в состав белков могут входить модифицированные аминокислотные остатки и компоненты неаминокислотной природы. Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки из 5 аминокислотных остатков оно составляет уже более 3 миллионов, а цепочка из 100 аминокислотных остатков (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-карбоксильной группы (-COOH) одной аминокислоты с α-аминогруппой (-NH2) другой аминокислоты образуютсяпептидные связи. Концы белка называют N- и C-концом, в зависимости от того, какая из групп концевого аминокислотного остатка свободна: -NH2 или -COOH, соответственно. При синтезе белка на рибосоме первым (N-концевым) аминокислотным остатком обычно является остаток метионина, а последующие остатки присоединяются к C-концу предыдущего.
Уровни организации [править]
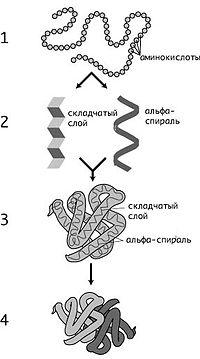
![]()
Уровни структурной организации белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
К. Линдстрём-Ланг предложил выделять 4 уровня структурной организации белков: первичную, вторичную, третичную ичетвертичную структуры. Хотя такое деление несколько устарело, им продолжают пользоваться[4]. Первичная структура (последовательность аминокислотных остатков) полипептида определяется структурой его гена и генетическим кодом, а структуры более высоких порядков формируются в процессе сворачивания белка[19]. Хотя пространственная структура белка в целом определяется его аминокислотной последовательностью, она является довольно лабильной и может зависеть от внешних условий, поэтому более правильно говорить о предпочтительной или наиболее энергетически выгодной конформации белка[4].
Первичная структура [править]
Основная статья: Первичная структура
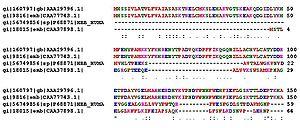
![]()
Пример выравнивания аминокислотных последовательностей белков (гемоглобинов) из разных организмов
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.
Важными особенностями первичной структуры являются консервативные мотивы — устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка[20]. По степени гомологии (сходства) аминокислотных последовательностей белков разных организмов можно оценивать эволюционное расстояние между таксонами, к которым принадлежат эти организмы.
Первичную структуру белка можно определить методами секвенирования белков или по первичной структуре его мРНК, используя таблицу генетического кода.
Вторичная структура [править]
Основная статья: Вторичная структура
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков[19]:
-
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[21] (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали;
-
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,34 нм на аминокислотный остаток[22]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
-
π-спирали;
-
310-спирали;
-
неупорядоченные фрагменты.
Третичная структура [править]
Основная статья: Третичная структура
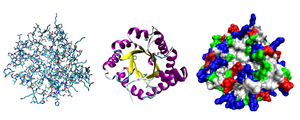
![]()
Разные способы изображения трёхмерной структуры белка на примере триозофосфатизомеразы. Слева — «стержневая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине — мотив укладки. Справа — контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
-
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
-
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
-
водородные связи;
-
гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Исследования принципов укладки белков показали, что между уровнем вторичной структуры и атомарной пространственной структурой удобно выделять ещё один уровень — мотив укладки (архитектура, структурный мотив). Мотив укладки определяется взаимным расположением элементов вторичной структуры (α-спиралей и β-тяжей) в пределах белкового домена — компактной глобулы, которая может существовать или сама по себе или входить в состав более крупного белка наряду с другими доменами. Рассмотрим для примера один из характерных мотивов строения белков. Изображённый на рисунке справа глобулярный белок, триозофосфатизомераза, имеет мотив укладки, который называется α/β-цилиндр: 8 параллельных β-тяжей формируют β-цилиндр внутри ещё одного цилиндра, сложенного из 8 α-спиралей. Такой мотив обнаруживается примерно в 10 % белков[23].
Известно, что мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков (такой как CATH или SCOP)[23].
Для определения пространственной структуры белка применяют методы рентгеноструктурного анализа, ядерного магнитного резонанса и некоторые виды микроскопии.
Четвертичная структура [править]
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Классификация по типу строения [править]
По общему типу строения белки можно разбить на три группы:
-
Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
-
Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая.
-
Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Простые и сложные белки [править]
Основные статьи: Простые белки, Сложные белки
Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы. В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[16]:
-
Гликопротеины, содержащие в качестве простетической группы ковалентно связанные углеводные остатки; гликопротеины, содержащие остатки мукополисахаридовотносятся к подклассу протеогликанов. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины относится к гликопротеинам. В протеогликанах углеводная часть составляет ~95 % от общей массы молекулы белка, они являются основным компонентом межклеточного матрикса;
-
Липопротеины, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеины, образованные белками-аполипопротеинами и связывающимися с ними липидами, используются для транспорта липидов в крови;
-
Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различныесупероксиддисмутазы, содержащие в активных центрах ионы меди, марганца, железа и других металлов);
-
Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК. К нуклеопротеидам относится хроматин, из которого состоят хромосомы;
-
Фосфопротеины, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина, треонина и тирозина. Фосфопротеином, в частности, является казеин молока[24];
-
Хромопротеиды, содержащие окрашенные простетические группы различной химической природы. К ним относится множество белков с металлсодержащейпорфириновой простетической группой, выполняющие разнообразные функции: гемопротеины (белки, содержащие в качестве простетической группы гем, например, гемоглобин и цитохромы), хлорофиллы, флавопротеиды с флавиновой группой и др.
Биофизика белка [править]
Физические свойства белка в клетке с учётом водной оболочки и краудинга макромолекул (англ.)русск. очень сложны. В пользу гипотезы о белке, как о упорядоченной «кристаллоподобной системе» — «апериодическом кристалле»[25][26] — свидетельствуют данные рентгеноструктурного анализа (вплоть до разрешения в 1 ангстрем)[27], высокая плотность упаковки[28], кооперативность процесса денатурации[29] и другие факты[30].
В пользу другой гипотезы, о жидкообразных свойствах белков в процессах внутриглобулярных движений (модель ограниченной прыжковой или непрерывной диффузии), свидетельствуют эксперименты по рассеянию нейтронов[31], мёссбауэровской спектроскопии[32][33].
Синтез [править]
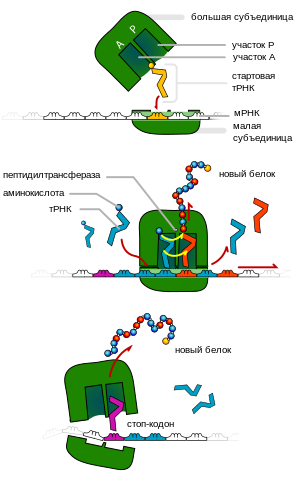
![]()
Схема синтеза белка рибосомой. Сверху вниз — инициация, элонгация и терминация трансляции
Биосинтез [править]
Основная статья: Биосинтез белка
Универсальный способ: рибосомный синтез [править]
Основная статья: Трансляция (биология)
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислотных остатков, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код представляет собой способ перевода нуклеотидной последовательности ДНК (через РНК) в аминокислотную последовательность полипептидной цепи. Этот код определяет соответствие трёхнуклеотидных участков РНК, называемых кодонами, и определённых аминокислот, которые включаются в состав белка: например, последовательность нуклеотидов АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном. Три кодона являются незначащими: они служат сигналами остановки синтеза полипептидной цепи и называются терминаторными кодонами, или стоп-кодонами[34].
Гены, кодирующие белки, сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) ферментами РНК-полимеразами. В подавляющем большинстве случаев белки живых организмов синтезируются на рибосомах — многокомпонентных молекулярных машинах, присутствующих в цитоплазме клеток. Процесс синтеза полипептидной цепи рибосомой на матрице мРНК называется трансляцией[34].
Рибосомный синтез белков принципиально одинаков у прокариот и эукариот, но различается в некоторых деталях. Так, мРНК прокариот может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции или даже до её завершения[35]. У эукариот же первичный транскрипт сначала должен пройти серию модификаций и переместиться в цитоплазму (к месту локализации рибосом), прежде чем может начаться трансляция. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду[36].
Ещё до начала трансляции ферменты аминоацил-тРНК-синтетазы специфично присоединяют аминокислоты к соответствующим им транспортным РНК (тРНК). Участок тРНК, который называется антикодоном, может комплементарно спариваться с кодоном мРНК, обеспечивая тем самым включение присоединённого к тРНК аминокислотного остатка в полипептидную цепь в соответствии с генетическим кодом.
Во время начальной стадии трансляции, инициации, инициаторный (обычно метиониновый) кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена аминоацилированная метиониновая тРНК. После узнавания стартового кодона к малой субъединице рибосомы присоединяется большая субъединица, и начинается вторая стадия трансляции — элонгация. При каждом шаге рибосомы от 5'- к 3'-концу мРНК считывается один кодон путём образования водородных связей между ним и комплементарным ему антикодоном транспортной РНК, к которой присоединён соответствующий аминокислотный остаток. Образование пептидной связи между последним аминокислотным остатком растущего пептида и аминокислотным остатком, присоединённым к тРНК, катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Этот центр позиционирует атомы азота и углерода в положении, благоприятном для прохождения реакции. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковыефакторы терминации гидролизуют связь между последней тРНК и полипептидной цепью, прекращая её синтез. В рибосомах белки всегда синтезируются от N- к C-концу[34].
Нерибосомный синтез [править]
У низших грибов и некоторых бактерий известен дополнительный (нерибосомный, или мультиферментный) способ биосинтеза пептидов, как правило, небольших и необычной структуры. Синтез этих пептидов, обычно вторичных метаболитов, осуществляется высокомолекулярным белковым комплексом, NRS-синтазой, без непосредственного участия рибосом. NRS-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи и высвобождение синтезированного пептида. Вместе эти домены составляют модуль. Каждый модуль обеспечивает включение одной аминокислоты в синтезируемый пептид. NRS-синтазы, таким образом, могут состоять из одного или более модулей. Иногда в состав этих комплексов входит домен, способный изомеризовать L-аминокислоты (нормальная форма) в D-форму[37][38].
Химический синтез [править]
Короткие белки могут быть синтезированы химическим путём с использованием методов органического синтеза, например, химического лигирования[39]. Чаще всего химический синтез пептида происходит в направлении от C-конца к N-концу, в противоположность биосинтезу на рибосомах. Методом химического синтеза получают короткие иммунногенные пептиды (эпитопы), которые затем инъецируют животным с целью получения специфичных антител или гибридо́м. Кроме того, этот способ также используется для получения ингибиторов некоторых ферментов[40]. Химический синтез позволяет вводить в состав белков аминокислотные остатки, не встречающиеся в обычных белках, например, такие, к боковым цепям которых присоединены флюоресцентные метки. Химические методы синтеза белков имеют ряд ограничений: они неэффективны при длине белка более 300 аминокислотных остатков, искусственно синтезированные белки могут иметь неправильную третичную структуру и у них отсутствую характерные посттрансляционные модификации (см. ниже).
Посттрансляционная модификация [править]
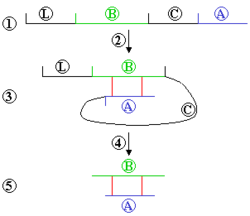
![]()
Посттрансляционные модификации инсулина. 1) Препроинсулин (L — лидерный пептид, B — участок 1, C — участок 2, А — участок 3) 2) Спонтанный фолдинг 3) Образование дисульфидного мостика между А и В 4) Лидерный и C-пептид отрезаются 5) Конечная молекула
Основная статья: Посттрансляционная модификация
После завершения трансляции большинство белков подвергается дальнейшим химическим модификациям, которые называются посттрансляционными модификациями[41]. Известно более двухсот вариантов посттрансляционных модификаций белков[42].
Посттрансляционные модификации могут регулировать продолжительность существования белков в клетке, их ферментативную активность и взаимодействия с другими белками. В ряде случаев посттрансляционные модификации являются обязательным этапом созревания белка, в противном случае он оказывается функционально неактивным. Например, при созревании инсулина и некоторых других гормонов необходим ограниченный протеолиз полипептидной цепи, а при созревании белков плазматической мембраны — гликозилирование.
Посттрансляционные модификации могут быть как широко распространёнными, так и редкими, вплоть до уникальных. Примером универсальной модификации служит убиквитинирование (присоединение к белку цепи из нескольких молекул короткого белка убиквитина), которое служит сигналом к расщеплению этого белка протеасомой[43]. Другой распространённой модификацией является гликозилирование — считается, что около половины белков человека гликозилировано[44]. К редким модификациям относят тирозинирование/детирозинирование и полиглицилированиетубулина[45].
Один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в составхроматина у эукариот) в разных условиях могут подвергаться более чем 150 различным модификациям[46].
Посттрансляционные модификации делят на:
-
модификации главной цепи;
-
отщепление N-концевого остатка метионина;
-
ограниченный протеолиз — удаление фрагмента белка, которое может происходить с концов (отщепление сигнальных последовательностей) или, в отдельных случаях, в середине молекулы (созревание инсулина);
-
присоединение различных химических групп к свободным амино- и карбоксильной группам (N-ацилирование, миристоилирование и др.);
-
-
модификации боковых цепей аминокислот;
-
присоединение или отщепление небольших химических групп (гликозилирование, фосфорилирование и др.);
-
присоединение липидов и углеводородов;
-
изменение стандартных аминокислотных остатков на нестандартные (образование цитруллина);
-
образование дисульфидных мостиков между остатками цистеина;
-
-
присоединение небольших белков (сумоилирование и убиквитинирование).
Жизненный цикл [править]
Внутриклеточный транспорт и сортировка [править]
Основная статья: Внутриклеточная сортировка белков
Синтезируемые в цитоплазме эукариотической клетки белки должны транспортироваться в разные органоиды клетки: ядро, митохондрии, эндоплазматический ретикулум(ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду[47]. Для попадания в определённый отдел клетки белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, илисигнальная последовательность белка), но в некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды[48].
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные белки на его внешней мембране[49]. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы и на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигналом ядерной локализации, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Поддержание структуры и деградация [править]
Поддержание правильной пространственной структуры белков принципиально для их нормального функционирования. Неправильное сворачивание белков, приводящее к их агрегации, может быть вызвано мутациями, окислением, стрессовыми условиями или глобальными изменениями в физиологии клетки. Агрегация белков является характерным признаком старения организма. Считается, что неправильный фолдинг белков является причиной или усугубляет такие заболевания, как муковисцидоз,лизосомная болезнь накопления (англ.)русск., а также нейродегенеративные расстройства (болезни Альцгеймера, Хантингтона и Паркинсона)[22].
В процессе эволюции клетками было выработано четыре основных механизма для противодействия агрегации белков. Первые два — повторное сворачивание (рефолдинг) с помощью шаперонов и расщепление протеазами — встречаются как у бактерий, так и у высших организмов. Аутофагия и накопление неправильно свёрнутых белков в особых немембранных органеллах характерны для эукариотов[22][50].
Шапероны [править]
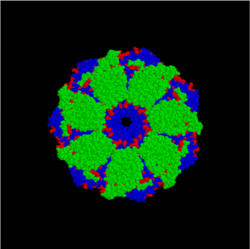
![]()
Модель комплекса бактериальных шаперонов GroES/GroEL (вид сверху). Часть агрегированного белка поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структуры
Основная статья: Шапероны
Способность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. В настоящее время общепризнана теория о том, что стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида[51].
В клетках существует группа белков, функция которых — обеспечение правильного сворачивания других белков после их синтеза на рибосоме, восстановление структуры белков после их повреждения, а также создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока)[52]. Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона α-кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за агрегирования белков и, как результат, к катаракте[53].
Протеолиз [править]
Основные статьи: Протеолиз, Протеасома
Если третичная структура белков не может быть восстановлена, они разрушаются клеткой. Ферменты, осуществляющие деградацию белков, называются протеазами. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы:
-
Эндопептидазы, или протеиназы, расщепляют пептидные связи внутри пептидной цепи. Они узнают и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определёнными аминокислотными остатками.
-
Экзопептидазы гидролизуют пептиды с концов цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы расщепляют толькодипептиды.
По механизму катализа Международный союз по биохимии и молекулярной биологии выделяет несколько классов протеаз, среди них сериновые протеазы,аспарагиновые протеазы, цистеиновые протеазы и металлопротеазы[54].
Особый тип протеазы — протеасома, крупная мультисубъединичная протеаза, присутствующая в ядре и в цитоплазме эукариот, архей и некоторых бактерий[55][56].
Для того, чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени[55][56]. В целом, эта система получила название убиквитин-зависимой деградации белка. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы.
Деградация белка в пероксисомах важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс.
Аутофагия [править]
Основная статья: Аутофагия
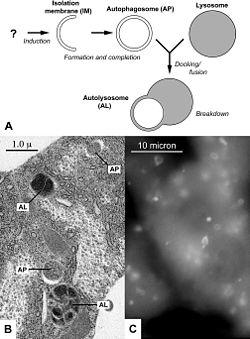
![]()
А: Образование аутофагосомы: изолирующая мембрана окружает клеточные структуры и создаёт аутофагосому (AP), которая сливается с лизосомой с образованием аутолизосомы (AL). В: Электронная микрофотография аутофагосом вжировом теле личинки дрозофилы. С: Помеченные флуоресцентной меткой аутофагосомы в клетках печени голодающей мыши
Аутофагия — это процесс деградации долгоживущих биомолекул, в частности, белков, а также органелл в лизосомах (у млекопитающих) или вакуолях (у дрожжей). Аутофагия сопровождает жизнедеятельность любой нормальной клетки, но стимулами к усилению процессов аутофагии в клетках могут служить нехватка питательных веществ, наличие в цитоплазме повреждённых органелл и, наконец, наличие в цитоплазме частично денатурированных белков и их агрегатов[57].
Различают три типа аутофагии: микроаутофагию, макроаутофагию и шаперон-зависимую аутофагию.
При микроаутофагии макромолекулы и обломки клеточных мембран захватываются лизосомой. Таким путём клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность[57].
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматического ретикулума. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы называются аутофагосомами. Аутофагосомы сливаются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются. Видимо, макроаутофагия также неизбирательна, хотя часто подчёркивается, что с помощью неё клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий, рибосом и др.)[57].
Третий тип аутофагии — шаперон-зависимая. При этом способе происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в её полость, где они перевариваются. Этот тип аутофагии, описанный только у млекопитающих, индуцируется стрессом[50].
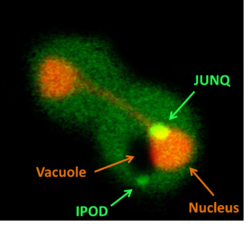
![]()
Клетка, содержащая JUNQ и IPOD. Nucleus — ядро клетки, vacuole — вакуоль
JUNQ и IPOD [править]
В условиях стресса, когда эукариотическая клетка не может справиться с накоплением большого числа денатурированных белков, они могут направляться в один из двух типов временных органелл — JUNQ и IPOD (англ.)русск.[58].
JUNQ (англ. JUxta Nuclear Quality control compartment — околоядерный компартмент контроля качества белков) ассоциирован с внешней стороной ядерной мембраны и содержит убиквитинированные белки, которые могут быстро переходить в цитоплазму, а также шапероны и протеасомы. Предполагаемая функция JUNQ состоит в рефолдинге и/или деградации белков[22].
IPOD (англ. Insoluble Protein Deposit — место отложения нерастворимых белков) расположен около центральной вакуоли и содержит неподвижные агрегаты фомирующих амилоиды белков. Накопление этих белков в IPOD может предотвращать их взаимодействие с нормальными клеточными структурами, поэтому предполагают, что это включение имеет защитную функцию[22].
Функции белков в организме [править]
Так же как и другие биологические макромолекулы (полисахариды, липиды и нуклеиновые кислоты), белки являются необходимыми компонентами всех живых организмов и играют важную роль в жизнедеятельности клетки. Белки осуществляют процессы обмена веществ. Они входят в состав внутриклеточных структур — органелл и цитоскелета, секретируются во внеклеточное пространство, где могут выступать в качестве сигнала, передаваемого между клетками, участвовать в гидролизе пищи и образовании межклеточного вещества.
Классификация белков по их функциям является достаточно условной, так как один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК-синтетаз, которая не только присоединяет остаток лизина к тРНК, но и регулирует транскрипцию нескольких генов[59]. Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки протеинкиназы, транспортный белокнатрий-калиевая аденозинтрифосфатаза и др.
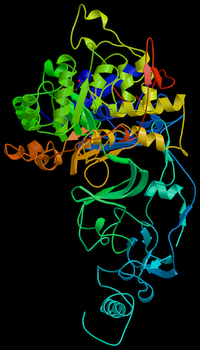
![]()
Молекулярная модель фермента-уреазы бактерииHelicobacter pylori
Каталитическая функция [править]
Основная статья: Ферменты
Наиболее хорошо известная функция белков в организме — катализ различных химических реакций. Ферменты — это белки, обладающие специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), в том числерепликацию и репарацию ДНК и матричный синтез РНК. К 2013 году было описано более 5000 тысяч ферментов[60][61]. Ускорение реакции в результате ферментативного катализа может быть огромным: например, реакция, катализируемая ферментом оротидин-5'-фосфатдекарбоксилазой, протекает в 1017 раз быстрее некатализируемой (период полуреакции декарбоксилирования оротовой кислоты составляет 78 миллионов лет без фермента и 18 миллисекунд с участием фермента)[62]. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются субстратами.
Хотя ферменты обычно состоят из сотен аминокислотных остатков, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество — в среднем 3—4 аминокислотных остатка, часто расположенные далеко друг от друга в первичной структуре — напрямую участвуют в катализе[63]. Часть молекулы фермента, которая обеспечивает связывание субстрата и катализ, называется активным центром.
Международный союз биохимии и молекулярной биологии в 1992 году предложил окончательный вариант иерархической номенклатуры ферментов, основанной на типе катализируемых ими реакций[64]. Согласно этой номенклатуре названия ферментов всегда должны иметь окончание -аза и образовываться от названий катализируемых реакций и их субстратов. Каждому ферменту приписывается индивидуальный код, по которому легко определить его положение в иерархии ферментов. По типу катализируемых реакций все ферменты делят на 6 классов:
-
КФ 1: Оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
-
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую;
-
КФ 3: Гидролазы, катализирующие гидролиз химических связей;
-
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов;
-
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата;
-
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза дифосфатной связи АТФ или сходного трифосфата.
Структурная функция [править]
Основные статьи: Структурная функция белков, Фибриллярные белки
Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются филаментозными: например, мономеры актина и тубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму[65]. Коллаген и эластин — основные компоненты межклеточного веществасоединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
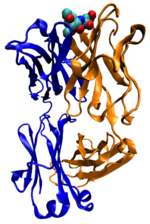
![]()
Fab-фрагмент мышиного антитела в комплексе с антигеном (вверху)
Защитная функция [править]
Основная статья: Защитная функция белков
Существует несколько видов защитных функций белков:
-
Физическая защита. Физическую защиту организма обеспечивают коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоёв кожи (дермы)); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса. Обычно такие белки рассматривают как белки со структурной функцией. Примерами белков этой группы служат фибриногены и тромбины[66], участвующие в свёртывании крови.
-
Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма[67].
-
Иммунная защита. Белки, входящие в состав кров и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов. Белки системы комплемента и антитела (иммуноглобулины) относятся к белкам второй группы; они нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами[68].
Регуляторная функция [править]
Основные статьи: Активатор (белки), Протеасома, Регуляторная функция белков
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют продвижение клетки по клеточному циклу, транскрипцию, трансляцию, сплайсинг, активность других белков и многие другие процессы. Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфичного связывания с другими молекулами. Так,факторы транскрипции, белки-активаторы и белки-репрессоры, могут регулировать интенсивность транскрипции генов, связываясь с их регуляторными последовательностями. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов[69].
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы и протеинфосфатазы — ферменты, которые активируют или подавляют активность других белков путём присоединения к ним или отщепления фосфатных групп.
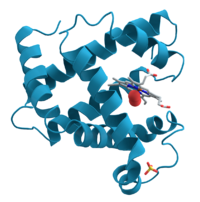
![]()
Структура миоглобина
Сигнальная функция
Основные статьи: Сигнальная функция белка, Гормоны, Цитокины
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с его рецептором является сигналом, запускающим ответную реакцию клетки. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Цитокины — пептидные сигнальные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост,дифференцировку, функциональную активность и апоптоз, обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухоли, который передаёт сигналы воспаления между клетками организма[70].
Транспортная функция
Основная статья: Транспортная функция белков
![]()
Молекулярная модель кальциевого канала, вид сверху
Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (аффинность) к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов[71].
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидныйкомпонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные транспортные белки принято подразделять на белки-каналы и белки-переносчики. Белки-каналы содержат внутренние заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться через мембрану. Многие ионные каналы специализируются на транспорте только одного иона; так, калиевые инатриевые каналы часто различают эти сходные ионы и пропускают только один из них[72]. Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» — АТФ-синтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам[73].
Запасная (резервная) функция
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений (например, глобулины 7S и 11S) и яйцеклетках животных[74]. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.

![]()
Схема трансмембранного рецептора: E — внеклеточное пространство; P — клеточная мембрана; I — внутриклеточное пространство
Рецепторная функция
Основная статья: Клеточный рецептор
Белковые рецепторы могут находиться как в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы. При воздействии сигнала на определённый участок молекулы — белок-рецептор — происходят её конформационные изменения. В результате меняется конформация другой части молекулы, осуществляющей передачу сигнала на другие клеточные компоненты. Существует несколько механизмов передачи сигнала. Некоторые рецепторы катализируют определённую химическую реакцию; другие служат ионными каналами, которые при действии сигнала открываются или закрываются; третьи специфически связывают внутриклеточные молекулы-посредники. У мембранных рецепторов часть молекулы, связывающаяся с сигнальной молекулой, находится на поверхности клетки, а домен, передающий сигнал, — внутри[75].
