
- •Часть 3 . Металлургия цветных металлов
- •3.1. Исторические вехи развития производства цветных металлов на Украине
- •Металлургия титана
- •3.2.1.Физико-химические свойства и области применения
- •Высокая коррозионная стойкость, низкая плотность и теплопроводность, высокая прочность обуславливает его широкое применение в аэрокосмической, химической и судостроительной отраслях промышленности.
- •Сырьевые источники титана
- •Восстановительная плавка ильменитовых концентратов.
- •Магниетермическое получение титана из тетрахлорида титана
- •3.2.5.1. Восстановление четыреххлористого титана магнием
- •3.2.6. Переработка титановой губки в товарную продукцию
- •3.2.7. Плавка титана и его сплавов
- •3.3. Производство меди
- •3.3.1. Свойства меди и области потребления
- •3.3.2 Медные руды и схема их переработки
- •3.3.3. Получение медных штейнов из концентратов
- •3.3.4. Переработка медного штейна
- •3.3.5. Рафинирование меди
- •3.3.5.1. Огневое рафинирование
- •3.3.5.2. Электролитическое рафинирование меди
- •3.3.6. Медные сплавы
- •3.4. Металлургия алюминия
- •3.4.1. Общие сведения об алюминии
- •3.4.2. Сырье для получения алюминия
- •3.4.3. Производство глинозема
- •3.4.3.1. Получение глинозема по способу Байера
- •3.4.3.2. Получение глинозема способом спекания.
- •3.4.3.3. Электролитическое производство алюминия
- •3.5. Металлургия магния
- •3.5.1 Общие сведения о магнии
- •3.5.2. Сырьевые источники магния
- •3.5.3. Общие принципы производства магния
- •3.5.4. Получение безводного хлорида магния
- •3.5.5.Электролитический способ получения магния
- •3.6. Предприятия цветной металлургии Украины
- •3.6.1. Горно- обогатительные предприятия
- •3.6.1.2. Вольногорский горно-металлургический комбинат
- •(Убрать правую часnь)
- •3.6.2. Металлургические предприятия
- •3.6.2.1. Производство алюминия
- •3.6.2.1 Запорожский алюминиевый комбинат (г.Запорожье)
- •3.6.2.3. Вторичный алюминий и сплавы
- •3.6. 2.4. Производство титана и магния
- •3.6.2.4.1.«Запорожский титано - магниевый комбинат» (г. Запорожье).
- •3.6.2. 2. Производство пигментного диоксида титана
- •3. 6.2.3. Производство циркония и гафния
- •3.6.4.4. «Донецкая химико- металлургическая фабрика» (п.Г.Т. Донское, Волновахский район, Донецкая область)
- •2.2.6. Производство меди , никеля, цинка, свинец
- •3. Производство цветных металлов
3.5.3. Общие принципы производства магния
Металлический магний получают двумя способами: электролитическим и термическим.
Электролитический способ получения магния в настоящее время является основным. Этот метод предусматривает получение магния в несколько стадий, основными из которых являются: получение чистого безводного хлорида магния, электролиз расплавленного хлорида и рафинирование магния.
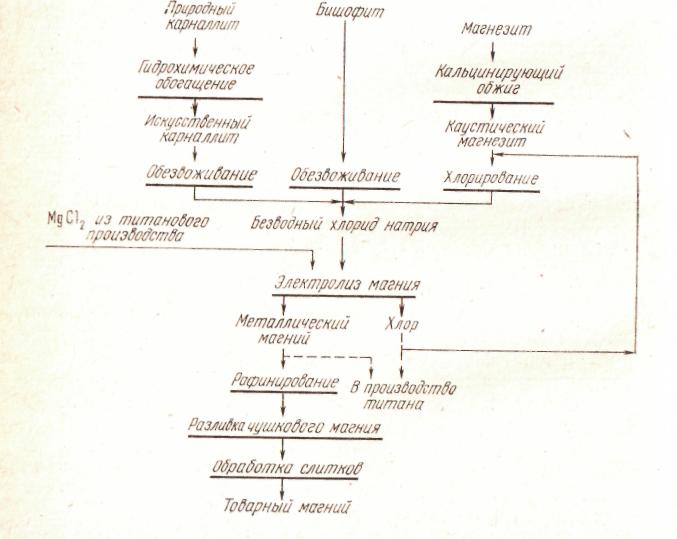
Рис. . Принципиальная технологическая схема получения магния электролитическим способом
В зависимости от вида перерабатываемого сырья и способа получения хлорида возможны варианты технологических схем получения электролитического магния (рис. 161).
3.5.4. Получение безводного хлорида магния
Сырьем для получения безводного хлорида магния могут служить карналлит, бишофит и магнезит. Однако методы подготовки МgCl2 к электролизу из этих видов сырья различны.
Обезвоживание искусственного карналлита протекает по схеме:
MgCl2*KCl*6H2O MgCl2*KCl*2H2O MgCl2*KCl
Первую стадию проводят в трубчатых вращающихся печах длиной 35 -40 м и диаметром 3,0 - 3,5 м при температуре на загрузочном конце печи ниже 120°С, а на разгрузочном - не выше 500 - 560 °С. При такой операции степень обезвоживания составляет 85 - 90 %. Обезвоженный в трубчатых печах карналлит содержит 6 - 8 % Н20 и до 2,5 % МgО.
Вторая стадия обезвоживания с целью полного удаления влаги и отстаивания MgO проводится путем плавки в стационарных карналлитовых печах непрерывного действия (СКН) или в хлораторах.
Безводный карналлита содержит, %: 49 – 51 MgCl2; 40 - 46 KCl; 6 – 7 NaCl;
0,5 – 1,0 MgO; 0,01 – 0,1 H2O.
3.5.5.Электролитический способ получения магния
Электролитическая сущность процесса электролитического получения магния заключается в следующем. В хлоридном расплаве в результате электролитической диссоциации образуются катионы металлов Mg2+, Na+, K+ и анионы хлора Cl-.
Под воздействием постоянного тока на катоде разряжаются только катионы по электролитической реакции
Mg2+ + 2 e Mg.
Анодный процесс сводится в разряду ионов хлора
2Cl- - 2 e Cl2
В процессе электролиза, проводимом при 690 – 7200 С, магний получают в жидком виде.
Процесс электролитического получения магния и хлора проводится в электролитической ячейке, представленной на рис. 13.4.
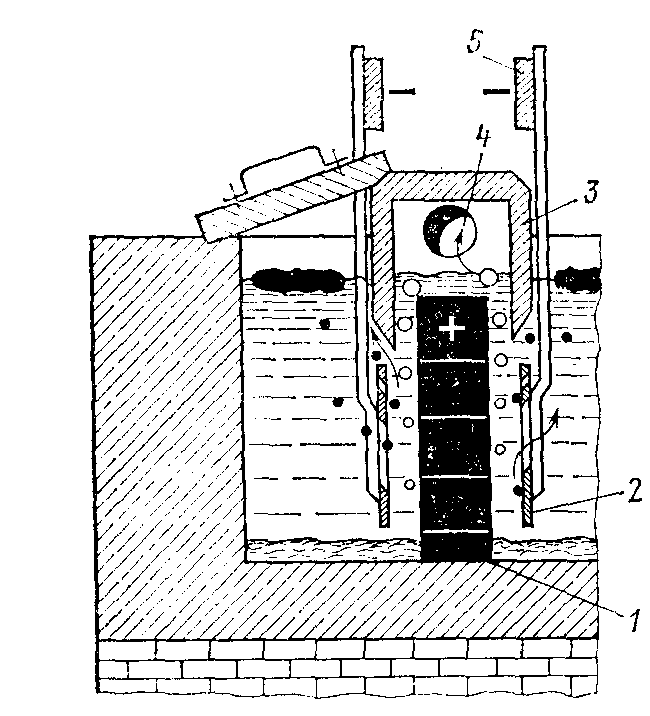
1 - анод; 2 – катоды; 3 - диафрагма, отделяющая анодное и катодное пространства; 4 - труба для отвода хлора из анодного пространства; 5 - катодные шины
Анодами служат графитированные плиты 1, катодами - стальные пластины 2. Так как плотность расплавленного электролита больше, чем плотность магния при температуре электролиза, то выделяющийся на катоде жидкий магний, не растворяясь в электролите, в виде капель всплывает на его поверхность. На аноде выделяется газообразный хлор, который также поднимается и выбрасывается из электролита. Во избежание взаимодействия хлора и магния и короткого замыкания анода и катода расплавленным магнием вверху устанавливают перегородку, которую принято называть диафрагмой 3. Выделяющийся в анодном пространстве хлор отсасывают через трубы и используют, например, для хлорирования окиси магния или двуокиси титана.
Магниевые ванны соединяют последовательно в серии из 60 - 100 шт. Напряжение источника постоянного электрического тока на ванне колеблется в пределах 5,5 -7,5 В.
Извлекают магний из электролизера не реже одного раза в сутки с помощью вакуумного ковша. Извлеченный из ванн магний обычно содержит более 0,1 % примесей поэтому он всегда подвергается очистке.
