
диссертации / 131
.pdfВ настоящий момент в литературе имеется множество сообщений о влиянии тех или иных внешних и внутренних факторов на развитие РПЖ,
однако точные причины до сих пор остаются неизвестными. Некоторые исследователи сообщают, о том, что рак ПЖ встречается на 30% чаще у лиц мужского пола, чем у женского [29; 78]. Пожилой возраст так же влияет на частоту возникновения этого заболевания и на увеличение смертности [170].
Среди других факторов выделяют влияние социального и экономического статуса [139], употребление алкоголя [112; 157], пониженную физическую активность [32, 33,103]. Некоторые инфекционные заболевания способны повышать риск развития рака поджелудочной железы, например хронические инфекции вирусами гепатитов В и С, Helicobacter pylori [73; 53; 128].
Существуют данные о повышенной частоте заболеваемости РПЖ у людей,
перенесших хирургические операции резекции желудка [69] и
холецистэктомии [102]. Наиболее доказательными считаются данные,
показывающие роль курения табака в возникновении РПЖ [2, 7, 8, 82, 125, 126], .который диагностируется у курильщиков как вторая по частоте опухоль после рака легкого, гортани и мочевого пузыря, то есть тех злокачественных опухолей, для которых курение является достоверно установленным этиологическим фактором. По данным различных исследований у курильщиков риск развития РПЖ повышен в 2-4 раза по сравнению с некурящими [154], а широкая распространенность табакокурения позволяет связать с ним до 30% всех случаев РПЖ.
Хронический панкреатит в настоящее время расценивается как фоновое заболевание для РПЖ, существуют данные, что при длительно существующем хроническом панкреатите, на протяжении 20 и более лет,
риск развития РПЖ может увеличиваться в 20 и более раз [2, 4, 5, 7, 8, 12, 14,
77].
11
Многие исследователи рассматривают сахарный диабет как второе фоновое заболевание для РПЖ. [2, 5, 7, 8, 107]. По данным некоторых авторов, [44, 124], у 25 % пациентов с выявленным раком ПЖ имелся сахарный диабет, а у 40% состояние, предшествующее развитию диабета. У
пациентов с длительно текущим сахарным диабетом II типа отмечают повышение риска развития ПАК на 50% по сравнению с не имеющими этого заболевания. [81]. При этом уровень риска зависит от тяжести и длительности гиперлипидемии, нарушений метаболизма углеводов,
инсулинрезистентности. [87,145, 146, 147].
Многие исследования указывают на роль пищевых продуктов в возникновении РПЖ, особенно животных жиров и красного мяса [2].
Повышенное употребление этих продуктов связывают с увеличенным риском развития РПЖ и некоторых других видов рака (колоректального,
рака молочной и предстательной желез, рака желудка и пищевода), что обусловлено содержанием в них гетероциклических аминов, химических соединений с высокой мутагенной активностью. Существует зависимость между показателями смертности от РПЖ в некоторых странах и уровнем потребления указанных пищевых продуктов. Так, в странах северной Европы и США, где самые высокие показатели смертности от РПЖ, уровень потребления мяса и жира составляет в среднем 150г на человека в сутки,
тогда как в странах Средиземноморского региона, лишь 40-80г в сутки. При этом, показатели смертности от РПЖ в этих странах на 40-50% ниже. [31, 34, 83, 84, 85, 96, 98, 164, 175].
Некоторые авторы указывали на связь между частотой развития РПЖ и употреблением кофе, однако эти данные пока не подтверждены широкими исследованиями. [63, 162].
Установлено, что ряд наследственных синдромов связаны с повышенной частотой развития РПЖ (Таблица 1), из которых самый высокий риск – 11-36% наблюдается при синдроме Пейтса-Егерса. [148].
12

Наследственный панкреатит, обусловленный повышенной продукцией пищеварительных ферментов, в особенности трипсина, так же является фактором риска развития РПЖ.
Это редкое нарушение обусловлено мутацией гена PRSS1 наследуется по аутосомно-доминантному типу с 80% пенетрантностью, в независимости от пола. Риск развития РПЖ при этом состоянии увеличивается до 70%. [76].
Таблица 1
Наследственные синдромы, связанные с повышенным риском РПЖ (по данным Ghanech et al, 2007[65])
Syndrom |
Gene mutation |
Pancreatic cancer lifetime |
|
|
risk |
Familial pancreatic cancer |
BRCA2 in up to 20% |
Variable depended on pedigree- |
|
|
up to 50% |
Family X |
Paladin |
Family X affected subject carry |
|
|
the P239S variants |
FAMMM-pancreatic cancer |
TP16 |
17% (p16 Leidenmutation) |
variant |
|
|
Familial breast and ovarian |
BRCA1 and BRCA2 |
Pedigree depanded |
cancer syndromes |
|
|
Fanconi anaemia |
FANCA,B,C, D1(BRCA2), |
?-5%( patients<50 years may |
|
D2, E, F, G |
carry genes) |
Peutz-Jeghers syndrome |
STK11/LKB1 |
36% |
Hereditary pancreatitis |
PRSS1 in up to 80% |
35% |
von Hippel-Lindau disease |
VHL |
?-5% (neuroendocrine tumours |
|
|
are frequent) |
Ataxia telangiectasia |
ATM |
?- unusual (breast cancer is most |
|
|
common) |
Li-Fraumeni syndrome |
TP53 |
~5% |
Cystic fibrosis |
CFTR |
?-5% (increased risk of digestive |
|
|
track cancers) |
|
|
|
FAP |
APC |
? |
HNPCC |
MLH1, MSH2, MSH6, PMS1, |
?-5% |
|
PMS2 |
|
FAMMM, familial atypical multiple mole melanoma; FAP, familial adenomatous polyposis; HNPCC, hereditary non-polyposis colon carcer.
В последние годы появились сообщения о роли в возникновении РПЖ мутаций гена BRCA2 (breast cancer susceptibility gene), которые
13
вызывают развитие рака молочной железы и яичников. [71]. Существуют сообщения о связи РПЖ с генетическим полиморфизмом некоторых метаболических ферментов, в частности цитохрома P450 и глутатион-S
трансферазы (GST), ацетилтрансфераз NAT1 и NAT2. По данным авторов,
риск развития РПЖпри этих состояниях существенно выше в случаях сочетания их с курением и хроническим панкреатитом [50].
1.3 Морфологическая характеристика рака ПЖ
Наиболее распространенная локализация ПАК - головка
поджелудочной железы (60-70%), реже тело (5-15%) и хвост (10-15%), так же описаны единичные случаи локализации опухоли в крючковидном отростке
[4, 19, 141] и в абберантной ткани поджелудочной железы [68].
Макроскопически ПАК ПЖ обычно представлена нечетко отграниченным беловато-желтоватым узлом волокнистого вида, размерами опухоли от 1,5 до 5,5 см в диаметре, в среднем 2,5-3,5см. При локализации опухоли в головке железы, часто наблюдается стеноз общего желчного протока, в результате его инвазии или сдавливания, расширение просвета в проксимальной части. Кроме того, опухоль может инфильтрировать область большого дуоденального сосочка, стенку двенадцатиперстной кишки или желудка. Опухоль тела и хвоста железы обычно вызывает стеноз только
главного панкреатического протока.
Микроскопически ПАК ПЖ представлена железистыми структурами с различной степенью дифференцировки, окруженными хорошо развитой десмопластической стромой, которая содержит коллагеновые волокна,
фибробласты, элементы воспаления и может занимать до 90% объема
опухолевой ткани [6, 14]. |
|
|
Высокодифференцированная ПАК |
характеризуется |
преобладанием |
крупных протокоподобных структур, в |
которых могут |
присутствовать |
14 |
|
|
сосочковые разрастания эпителия без фибро-васкулярной ножки, а так же присутствием среднего размера железистых, криброзных и тубулярных структур. Опухоль характеризуется достаточно низкой митотической активностью, клетки секретируют муцин.
Неопластические железы, в отличие от нормальных протоковых структур, характеризуются более крупными размерами клеточного ядра,
потерей клеточной полярности, неровной ядерной мембраной, присутствием различных размеров ядрышек.
Умереннодифференцированная ПАК морфологически представлена в основном железистыми структурами среднего размера в комбинации с различной формы тубулярными структурами.
По сравнению с высокодифференцированной аденокарциномой более частыми становятся фигуры митоза, в большей степени выражен клеточный и ядерный полиморфизм, снижается продукция муцинов.
Низкодифференцированная ПАК построена из плохо сформированных мелких железистых и гнездных структур, полей из отдельных опухолевых клеток, обладающих значительной степенью клеточного и ядерного полиморфизма. Продукция муцина может быть незначительной или полностью отсутствовать [6, 12, 13, 14, 39]. Рис.2
На ультраструктурном уровне клетки ПАК ПЖ характеризуются наличием гранул муцина в апикальной цитоплазме, нерегулярными микроворсинами на люминальной поверхности, ядрами различного размера с той или иной степенью сохранения полярности. [47, 133].
Снижение клеточной дифференцировки характеризуется потерей клеточной полярности, базальной мембраны, исчезновением гранул муцина,
неравномерностью межклеточных пространств, изменением плотности межклеточных контактов [90].
15
1.4 Иммуногистохимическая характеристика ПАК ПЖ
Для ПАК ПЖ характерна экспрессия цитокератинов (СK) СК7, СК8,
СК18 и СК19 (как и в нормальных клетках протокового эпителия ПЖ), а так же слабая или фокальная экспрессия СК4, СК10, СК17, СК20 [18, 113]. По
данным авторов, [104, 105,116] опухолевые клетки ПАК экспрессируют СК13.
Наибольшее диагностическое значение имеет экспрессия клетками
ПАК ПЖ CК 7 и СК19, так как в большинстве случаев эти маркеры дают диффузное стойкое положительное окрашивание, что важно в дифференциальной диагностике ПАК с эндокринными и ацинарными опухолями, а так же вторичными образованиями гастроинтестинального тракта [25].
Клетки ПАК ПЖ, в отличие от эндокринных и ацинарных клеток,
секретируют несколько видов |
муцин-содержащих гликопротеидов, включая |
муцин-1 (MUC 1), высокий |
уровень экспрессии которого, является |
негативным фактором прогноза [91, 92].
Характерна экспрессия MUC3, MUC4, MUC5AC , а так же MUC 6 в
небольшом проценте случаев. [12, 14].
Экспрессия MUC2 практически не встречается в ПАК ПЖ, за исключением случаев фокальной муцинозной дифференцировки, а так же при кишечном типе ПАК ПЖ. [100].
Клетки ПАК ПЖ обычно не окрашиваются маркерами панкреатических ферментов трипсина, химотрипсина, липазы, за исключением случаев смешенной протоково-ацинарной дифференцировки, которые встречаются исключительно редко. [116].
16
Для клеток ПАК характерна широкая экспрессия онкопротеинов,
включая CA19-9, CEA (карциноэмбриональный антиген), B72.3 (TAG 72), ductal-ofpancreas-2 (DUPAN-2), CA125 [35, 94], что не встречается в реактивно измененном протоковом эпителии при воспалительных заболеваниях.
Так же опухоль негативна для маркеров нейроэндокринной дифференцировки синаптофизина, хромогранина А, нейрон специфической энолазы (NSE), CD56 [45, 46, 48, 132].
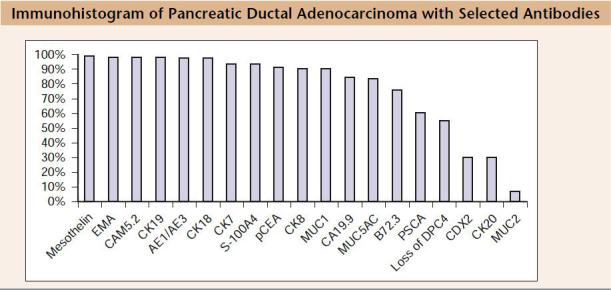
На Рис. 1 представлена иммуногистограмма ПАК ПЖ.
Рис.1. Иммуногистограмма протоковой аденокарциномы поджелудочной железы [Dаbbs D., Diagnostic Immunohistochemistry, 2010].
1.5 Факторы прогноза ПАК ПЖ
Для ПАК ПЖ выделено большое количество клинических и морфологических факторов прогноза, влияние которых на выживаемость больных после радикальной операции в настоящее время остается в центре
внимания исследователей. По данным многих авторов, такие характеристики
17

как пол и возраст пациентов не оказывают влияния на прогноз жизни после
операции [72, 86, 89, 101, 114, 115, 136, 153, 163, 165]. Только в одном исследовании [52], медиана выживаемости больных старше 74 лет была существенно меньше, чем у пациентов младшего возраста (11,4 месяца и 25.1
месяц).
Не отмечено влияния на продолжительность жизни больных локализации опухоли в ткани ПЖ, типа хирургической операции
(панкреатодуоденальной или дистальной резекции).
Объем интраоперационной кровопотери и гемотрансфузии, а также длительность операции, также не оказывают влияния на долгосрочную выживаемость больных [4, 143, 144].
Важной характеристикой опухоли, влияющей на послеоперационную продолжительность жизни, является ее размер [40, 43, 58, 62, 74, 93, 117, 118, 142, 144, 152, 159, 173].
Соотношения медиан выживаемости при различных размерах резицированных ПАК ПЖ показаны на рисунке 2.
18
Рис 2. Процентное соотношение медиан выживаемости, больных ПАК ПЖ с различными размерами резецированных опухолей. N – число публикаций.
[61]
Установлено, что чем крупнее размер опухоли, тем больше вероятность наличия метастазов в регионарные лимфатические узлы и метастазов в печень [75], кроме того более крупные опухоли чаще имеют более агрессивный гистологический тип.
Характеристики размеров опухоли, ее распространения и наличия метастазов отражаются при стадировании по системе TMN. В настоящее время действует классификация TNM от 2010 года [39].
TNM классификация опухолей экзокринной части ПЖ:
Первичная опухоль (рТ): |
|
Тх – оценка первичной опухоли невозможна; |
|
Т0 – первичная опухоль не обнаружена; |
|
Тis – рак in situ; |
|
Т1 – опухоль ограничена в пределах ПЖ, размеры опухоли |
в |
наибольшем измерении – 2 см и менее; |
|
Т2 - опухоль ограничена в пределах ПЖ, размеры опухоли |
в |
наибольшем измерении – 2 см и более;
Т3 – опухоль распространяется за пределы ПЖ, однако чревный ствол и верхняя брыжеечная артерия не поражены;
Т4 – опухоль с поражением чревного ствола и верхней брыжеечной артерии (нерезецируемая первичная опухоль).
Поражение региональных лимфоузлов (рN):
Nх – состояние региональных ЛУ оценить невозможно;
N0 – метастазов в региональных ЛУ нет;
N1 – наличие метастазов в региональных ЛУ.
Отдаленные метастазы (рМ):
19
Мх – наличие отдаленных метастазов оценить невозможно;
М0 – отдаленных метастазов нет;
N1 – наличие отдаленных метастазов;
Крайне важным для постановки морфологического диагноза и стадирования опухоли по системе TNM, является оценка статуса регионарных лимфатических узлов.
Регионарные лимфоузлы ПЖ в зависимости от их локализации подразделяются на следующие группы:
-верхние – расположенные сверху головки и тела ПЖ;
-нижние – к низу от головки и тела;
-передние – передние панкреатодуоденальные, пилорические (только для опухолей головки) и проксимальные брыжеечные лимфоузлы;
-задние – задние панкреатодуоденальные, вокруг общего желчного протока и проксимальные брыжеечные лимфоузлы;
-селезеночные – в воротах селезенки и около хвоста поджелудочной железы (только для опухолей тела и хвоста);
-чревные – только для опухолей головки поджелудочной железы.
Регионарные лимфоузлы представлены на рисунках 3 и 4.
Согласно рекомендациям Union for International Cancer Control (UICC TNM, 2010) для постановки морфологического диагноза необходимо исследовать не менее 10 регионарных лимфатических узлов.
Тело железы словно «вырезано» на рисунке, видны ретроперитонеальные сосуды и лимфатические узлы. (AJCC Cancer Staging Atlas (2006).
Большинство исследователей в своих работах отмечают важную прогностическую роль наличия метастазов в регионарных лимфатических узлах [36, 40, 74, 110, 117, 118, 143, 152, 161].
Средняя медиана выживаемости для пациентов с N0 статусом составляет 25 месяцев, тогда как для пациентов с N1 статусом - 11,6 месяцев.
20
