
диссертации / 5
.pdf
60
следующими уравнениями: у = 0,463 –0,17х для дексаметазона; у = 0,37 –
0,12х для преднизолона; у = 0,19 – 0,07х для кортизола.
Рис. 18. Специфическое связывание 3Н-кортизола (1) и 3Н-преднизолона
(2) фибробластами, представленное в координатах Скэтчарда.
По оси абсцисс - концентрация связанного лиганда, пмоль/106 клеток.
По оси ординат - отношение количества связанного и свободного гормона, пмоль/нМ 106 клеток.
Величина В/F для 3Н -дексаметазона почти в два раза выше, чем у 3Н -
кортизола, что свидетельствует о преимущественном связывании дексаметазона внутриклеточными рецепторами ГК клеток. Преднизолон занимает промежуточное положение.
В табл. 6 приведены параметры специфического связывания (Кд -
равновесная константа диссоциации, Вмакс - концентрация связывающих участков) дексаметазона, кортизола и преднизолона внутриклеточными и мембранными рецепторами ГК фибробластов. При расчете количества мест связывания на клетку взята средняя величина. Обращает внимание, что внутриклеточные рецепторы ГК отличаются высоким аффинитетом (Кд не превышает 18 нМ) и относительно небольшой связывающей емкостью (0.27-
0.36 пмоль/кг белка или в среднем 6х103 участков связывания на клетку). В
зависимости от степени сродства к рецепторам ГК располагаются в ряду:
61
дексаметазон дексаметазон-21-мезилат > преднизолон > кортизол >
прогестерон > 11-ДОК >> тестостерон > эстрадиол. Полученные результаты согласуются с литературными данными [ Raneletti F.O. et al., 1987, Голиков
П.П. и соавт., 1992 ].
Для мембранных «систем узнавания» ГК характерны более высокая концентрация мест связывания (3-4,3 пмоль/мг белка, 75х103 /клетку) и
менее выраженная аффинность (Кд порядка 0.3 мкМ). Тропность ГК к мембранной рецепторной системе подчиняется следующей закономерности:
кортизол > преднизолон > дексаметазон.
Таким образом, взаимодействие различных ГК с внутриклеточной и мембранной рецепторными системами клеток имеет характерные особенности.
Синтетические препараты дексаметазон и преднизолон в изученном диапазоне концентраций (2-30 нМ) избирательно связываются внутриклеточными рецепторами ГК. Отношение Кдмем /Кдвн , отражающее характер распределения ГК между внутриклеточными и мембранными рецепторами, для дексаметазона
и преднизолона равно соответственно 66,6 и 40,8. В то же время Кдмем /Кдвн,
вычисленное для кортизола, составляет 10.3, что свидетельствует о
преимущественном связывании природного гормона плазматической мембраной фибробластов.
Проведено сравнительное изучение основных характеристик мембранных и внутриклеточных участков связывания ГК, определены
параметры |
специфического |
связывания |
Кд |
(равновесная константа |
диссоциации |
гормон-рецепторного комплекса), максимальная связывающая |
|||
емкость, получены данные |
об относительном |
сродстве рецепторов к |
||
различным стероидам. Установлено, что мембранные и внутриклеточные участки связывания различаются как аффинностью к гормонам, так и концентрацией мест связывания. Внутриклеточные рецепторы ГК характеризуются более высоким сродством (Кд порядка 10 нМ) и
значительно меньшим числом связывающих участков (примерно в 20 раз).
Отличаются эти две рецепторные системы и по способности связывать ГК
62
гормоны и синтетические стероиды. Для синтетических глюкокортикоидов дексаметазона и преднизолона характерна избирательность связывания с цитозольными рецепторами ГК. Тропность природных глюкокортикоидов кортизола и кортикостерона к внутриклеточным рецепторам проявляется в значительно меньшей степени.
Глава 4.2. Определение молекулярных мишеней апоптотического действия глюкокортикоидов на фибробласты кожи.
Апоптотическая реакция лежит в основе фармакологического действия глюкокортикоидов при лечении многих аллергических, в том числе кожных заболеваний, в патогенезе которых принимают участие фибробласты. При этом возможны как желательные иммунодепрессивные эффекты гормональной терапии (апоптоз имунокомпетентных Т-лимфоцитов), так и нежелательное атрофическое влияние стероидов на кожу (апоптоз фибробластов).
I. Важным интегральным показателем клеточного гомеостаза является внутриклеточный рН (рНi). Постоянство рНi в покоящихся клетках определяется буферными свойствами внутриклеточных компонентов: белков,
нуклеотидов, неорганических фосфатов и карбонатов. Активным компонентом Н+-обмена служит Na/H-переносчик, локализованный в плазматической мембране, осуществляющий обмен внеклеточного иона натрия на
внутриклеточный протон. Движущей силой переноса является электрохимический градиент Na+ (потенциал покоя ПМ фибробластов
составляет |
примерно –60мВ). |
|
В задачи |
первой |
части исследования входило изучение влияния |
глюкокортикоидов на величину внутриклеточного рН с помощью флуоресцентного зонда BCECF; сравнение закономерностей изменения внутриклеточного рН при апоптотической и некротической формах гибели фибробластов.
Величина рНвн в контрольных образцах клеток, в отсутствие химического воздействия (контроль 1), составляла 7,12 0,05 (n=6) и незначительно

63
изменялась в течение всего времени наблюдения. Через 1,5 ч рНвн в
контрольных пробах приближалось к величине 7,03 0,05 (n=3).
В начальный момент времени значение рНвн в клетках, подвергшихся воздействию БГП, равнялось 7,09 0,06 (n=4), достоверно не отличаясь от контрольных. По мере увеличения времени инкубации с БГП величина рНвн
плавно повышалась, выходя на плато к 60-75 мин наблюдения. При этом конечное значение рНвн составляло 7,35 0,04 (n=4), примерно соответствующее величине рН инкубационной среды (рНвнеш). По-видимому, происходило выравнивание рНвн во внеклеточном и внутриклеточном пространствах. Для проверки этого предположения была использована инкубационная среда с заданным значением рНвнеш, равным 7,5. В новых условиях эксперимента динамика изменений рНвн в целом имела сходный характер (рис. 19), однако,
конечные значения рНвн уже составляли 7,51 0,07 (n=3). Следует отметить, что значения рНвн в контрольных образцах фибробластов (контроль 2),
инкубировавшихся в среде с рНвнеш=7,5, колебались в пределах 7,02– 7,16,
достоверно не отличаясь от уровня рНвн в контроле 1.
|
7,70 |
|
|
|
|
|
|
|
7,60 |
|
|
|
|
|
|
|
7,50 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
7,40 |
|
|
|
2 |
|
|
i |
|
|
|
|
|
|
|
рН |
7,30 |
|
|
|
|
1 |
|
|
|
|
|
|
|
||
|
7,20 |
|
|
|
|
|
|
|
7,10 |
|
|
|
|
|
|
|
7,00 |
|
|
|
|
|
|
|
0 |
15 |
30 |
45 |
60 |
75 |
90 |
|
|
|
Время, мин. |
|
|
||
Рис. 19. Динамика изменения рНi |
в фибробластах при некротической форме |
||||||
гибели (модель окислительного стресса). |
|
||||||
Обозначения: кривая 1 - в присутствии 100 мкМ бутилгидропероксида (рН инкубационной среды |
|||||||
7,35); |
кривая 2 |
- в присутствии 100 |
мкМ бутилгидропероксида (рН инкубационной среды 7,5); |
||||
кривая 3 - в присутствии 100 мкМ бутилгидропероксида, 30 мМ 2-дезоксиглюкозы, 50 мкМ |
|||||||
трифлуоперазина. |
|
|
|
|
|
||
64
Таким образом, при некротической форме гибели клеток наблюдаются нарушения гомеостатической функции плазматической мембраны,
выражающиеся в выравнивании рНвн и рНвнеш к 60-й мин после начала воздействия БГП. Маловероятно, что повышение рНвн связано с активацией
Na/H-обмена, так как добавление в суспензию клеток селективного ингибитора антипорта препарата амилорида не влияло на динамику изменения рНвн.
Внесение в среду инкубации, наряду с БГП, ингибитора синтеза АТФ 2-
дезоксиглюкозы (30 мМ) и блокатора киназных реакций трифлуоперазина
(ТФП, 50 мкМ) только усугубляло нарушения клеточного гомеостаза, приводя к выравниванию рНвн и рНвнеш к 45-ой мин инкубации (рис. 19, кривая 3).
Апоптотическую форму гибели фибробластов индуцировали дексаметазоном (1 мкМ). Инкубация клеток с дексаметазоном приводила к закислению внутриклеточной среды, достоверные изменения рНвн
регистрировали, начиная с 45-ой мин инкубации (рНвн = 6,95 0,04; n=4). В
последующий отрезок времени величина рНвн плавно уменьшалось, достигая значений 6,87 0,04 к концу наблюдения (рис. 20). Предварительное внесение в среду инкубации 2-дезоксиглюкозы и ТФП отменяло изменения рНвн,
индуцированные дексаметазоном. Полученные данные указывают на участие в рН-ответе фибробластов энергетически-зависимых реакций.
|
|
|
|
|
|
|
65 |
|
7,20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
7,10 |
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
рН |
7,00 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
6,90 |
|
|
|
|
|
|
|
6,80 |
|
|
|
|
|
|
|
0 |
15 |
30 |
45 |
60 |
75 |
90 |
|
|
|
Время, мин. |
|
|
||
Рис. 20. Динамика изменения рНi |
в фибробластах при апоптотической |
||||||
форме гибели, индуцированной дексаметазоном (1 мкМ). |
|||||||
Обозначения: кривая 1 - в присутствии 1 мкМ дексаметазона; кривая 2 - в присутствии 1 мкМ |
|||||||
дексаметазона, 30 мМ 2-дезоксиглюкозы, 50 мкМ трифлуоперазина. |
|||||||
Для изучения молекулярных механизмов действия дексаметазона на Na/H-
обмен были использованы 3 экспериментальных подхода, включающие оценку влияния глюкокортикоида на активацию Na/H-обмена в фибробластах с помощью ангиотензина II (100 нМ, АII), активатора фосфоинозитидного обмена форболмеристатацетата (20 нМ, ФМА) и осмотическую стимуляцию.
Вне зависимости от природы воздействия, изменение рНвн наступало быстро (в пределах 5-10 мин), блокировалось амилоридом (200 мкМ),
внутриклеточная среда защелачивалась, диапазон значений рНвн составлял от
7,28 до 7,32. Дексаметазон (1 мкМ) достоверно ингибировал подъем рНвн на всех экспериментальных моделях; предварительная инкубация с дексаметазоном не требовалась, достаточно было внести глюкокортикоид за 3-5
мин до воздействия AII, ФМА или гиперосмотического шока. Полученные данные суммированы в таблице 8.

66
Таблица 8. Влияние различных экспериментальных условий на рНвн фибробластов
Экспериментальные |
|
|
Время инкубации, мин |
|
|
||
условия |
0 |
15 |
30 |
45 |
60 |
75 |
|
Контроль |
7,12±0,05 |
7,12±0,05 |
7,10±0,06 |
7,08±0,05 |
7,06±0,05 |
7,03±0,05 |
|
|
|
|
|
|
|
|
|
Дексаметазон, 1 мкМ |
7,10±0,04 |
7,06±0,05 |
7,02±0,04 |
6,95±0,04* |
6,92±0,04* |
6,89±0,05* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ангиотензин II, 100 |
7,12±0,05 |
7,17±0,05 |
7,20±0,06 |
7,25±0,04* |
7,30±0,05* |
7,28±0,05* |
|
нМ |
|
|
|
|
|
|
|
Ангиотензин II, 100 |
7,12±0,05 |
- |
7,11±0,05 |
- |
7,08±0,05 |
- |
|
нМ + амилорид, 200 |
|
|
|
|
|
|
|
мкМ |
|
|
|
|
|
|
|
Ангиотензин II, 100 |
7,12±0,05 |
7,06±0,05 |
7,12±0,04 |
7,09±0,04** |
7,08±0,04** |
7,10±0,05** |
|
нМ + дексаметазон, 1 |
|
|
|
|
|
|
|
мкМ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ФМА, 20 нМ |
7,11±0,05 |
7,18±0,05 |
7,21±0,04 |
7,26±0,05* |
7,30±0,06* |
7,32±0,05* |
|
|
|
|
|
|
|
|
|
ФМА, 20 нМ + |
7,11±0,05 |
- |
7,11±0,05 |
- |
7,08±0,05 |
- |
|
амилорид, 200 мкМ |
|
|
|
|
|
|
|
ФМА, 20 нМ + |
7,11±0,05 |
7,06±0,05 |
7,10±0,04 |
7,06±0,04*** |
7,09±0,04*** |
7,11±0,05*** |
|
дексаметазон, 1 мкМ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Условия: дексаметазон добавляли в инкубационную среду за 3–5 мин до внесения изучаемых препаратов (ФМА, ангиотензин II, амилорид). Отсчет времени в таблице указан с момента введения изучаемых препаратов. Обозначения: ФМА – форболмеристатацетат. *– достоверное отличие (p <0,05) от контрольных значений; ** – достоверное отличие (p <0,05) по отношению к действию ангиотензина II; *** – достоверное отличие (p <0,05) по отношению к действию ФМА.
Достоверное увеличение рНвн наблюдали, начиная с 45-й минуты инкубации с ангиотензином II (100 нМ) или ФМА (20 нМ). Подъем рНвн,
вызванный ангиотензином II или ФМА, блокировался амилоридом (200 мкМ):
внутриклеточная среда защелачивалась, диапазон значений рНвн составлял от
7,28 до 7,32. Дексаметазон (1 мкМ) ингибировал подъем рНвн на всех экспериментальных моделях (таблица).
Таким образом, ингибирующее действие дексаметазона на Na/H-обмен в фибробластах может быть отнесено к ранним, негеномным эффектам глюкокортикоидов, а ингибирование Na/H-обмена – к ранним проявлениям апоптотического пути гибели клеток, индуцированных дексаметазоном.
II. В задачи второй части исследования входило исследование динамики апоптотического изменения концентрации ионов Са2+ в цитоплазме фибробластов с помощью флуоресцентного индикатора FURA-2.

67
По нашим данным, базальный уровень [Ca2+]цит в фибробластах составляет в среднем 105 нМ. Влияние дексаметазона на уровень [Ca2+]цит в фибробластах характеризуется дозовой и временной зависимостью (рис. 21). Выявлены две фазы кальциевого ответа на ГК.
Концентрация Са в цитозоле, нМ
200 |
|
|
|
|
|
|
|
|
* |
|
* |
180 |
|
|
|
|
|
160 |
|
|
|
|
|
140 |
|
* |
* |
* |
0,1 мкМ |
120 |
* |
1 мкМ |
|||
* |
* |
* |
10 мкМ |
||
|
|
|
|
|
|
100 |
|
|
|
|
|
80 |
|
|
|
|
|
0,5 |
1 |
1,5 |
2 |
2,5 |
|
|
Время инкубации, часы |
|
|
||
Рис. 21. Изменения уровня |
[Ca++]цит в фибробластах |
на |
ранних |
стадиях |
апоптоза, индуцированного |
дексаметазоном (0,1 мкМ, |
1 |
мкМ, 10 |
мкМ). |
Обозначения: * - достоверное отличие от исходных значений при р < 0,05.
Первая фаза характеризуется плавным нарастанием, начиная с 60 мин,
внутриклеточного содержания Са2+ . Во второй фазе (после 120 мин инкубации)
отмечается максимальное увеличение концентрации цитозольного Са2+ (до 187
нМ или 178% от начальной величины).
При повторении эксперимента в бескальциевой среде увеличения [Ca2+]цит не наблюдалось. Это позволило нам предположить, что эффект дексаметазона реализуется на уровне плазматической мембраны клеток. По-видимому,
увеличение [Ca2+]цит связано с изменением проницаемости мембраны для ионов
Ca2+, а не с мобилизацией их из внутриклеточных депо. Для определения механизма изменения проницаемости мембраны при действии ГК были поставлены следующие эксперименты. Одновременно с дексаметазоном (10
68
мкМ) в суспензию клеток вносили блокатор синтеза РНК актиномицин Д (1
мкМ) или ингибитор трансляции циклогексемид (30 мкМ). Указанные соединения достоверно изменяли динамику Са-ответа фибробластов на дексаметазон: отсутствовал резкий подъем уровня [Ca++]цит после 120 мин инкубации с дексаметазоном. Однако тот факт, что ответ не отменялся полностью, свидетельствует о вкладе как геномных, так и негеномных механизмов глюкокортикоидного эффекта.
Таким образом, с помощью флуоресцентного зонда FURA-2 определен уровень
[Ca2+]цит в суспензии фибробластов на начальных этапах дексаметазон-
иидуцированного апоптоза, выяснен вклад геномных и негеномных механизмов действия ГК в изменение кальциевого гомеостаза. Базальный уровень [Ca2+]цит в
фибробластах составляет 105 12 нМ. Влияние дексаметазона (0,1-10 мкМ) на уровень [Ca2+]цит в фибробластах характеризуется дозовой и временной зависимостью. Выявлены две фазы кальциевого ответа на ГК. Первая фаза характеризуется плавным нарастанием, начиная с 60 мин, внутриклеточного содержания Са2+. Во второй фазе (после 120 мин инкубации) отмечается максимальное увеличение концентрации цитозольного Са2+ (187 13 нМ или
78 6% от начальной величины). Одновременное с дексаметазоном внесение блокатора синтеза РНК актиномицина Д (1 мкМ) и ингибитора процесса трансляции циклогексемида (30 мкМ) достоверно изменяло ответ фибробластов, однако не отменяло его полностью. Можно предположить, что увеличение [Ca2+]цит связано с изменением проницаемости мембраны для ионов
Ca2+, а не с мобилизацией их из внутриклеточных депо. Увеличение [Ca2+]цит
является результатом как геномных, так и негеномных механизмов глюкокортикоидного эффекта.
Таким образом, на экспериментальной модели окислительного стресса установлено, что некротический путь лизиса фибробластов характеризуется ранними нарушениями механизмов поддержания рНвн, значения которого выравнивается с рН внеклеточной среды после 60-й минуты инкубации с БГП.
69
На экспериментальной модели апоптоза показано, что через 1 ч после
воздействия дексаметазона наблюдается достоверное закисление внутриклеточной среды (рНвн =6,87 0,04). К одному из молекулярных механизмов рН-ответа фибробластов относится ингибирование активности
Na/H-обмена.
Глава 4.3. Использование наноразмерного кортизол-полимерного комплекса
для изучения механизмов регуляции функциональной активности
фибробластов кожи
4.3.1. Изучаемые геномные механизмы регуляции функциональной активности фибробластов включали: 1) влияние глюкокортикоидов на базальную и стимулированную ангиотензином II (AII) клеточную пролиферацию; 2) влияние глюкокортикоидов на базальный и индуцированный синтез коллагена,
оцениваемый по включению меченного тритием пролина.
АII достоверно увеличивает инкорпорацию меченых предшественников:
включение тимидина в среднем на 57%, пролина – на 31%. Пролиферативный эффект ангиотензина II (100 нМ) и его влияние на синтез коллагена в фибробластах опосредовано АТ1-типом мембранных рецепторов [11], действие АII отменяется конкурентным антагонистом АТ1-рецепторов ирбесартаном (1
мкМ).
ГК во всем изученном диапазоне концентраций (1нМ – 10 мкМ)
ингибировали включение [3H]-тимидина в ДНК фибробластов. В концентрации ГК выше 10 нМ наблюдается достоверное снижение стимулированнго АII
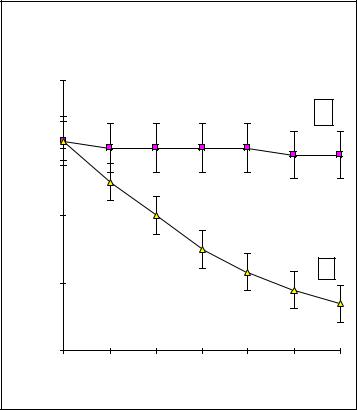
синтеза ДНК; начиная с концентрации 1 мкМ ГК подавляют и базальный уровень включения меченого тимидина (рис. 22А). Влияние ГК на синтез коллагена определяется в основном подавлением индуцированного АII уровня,
базальный уровень включения меченого пролина снижается не более, чем 10-
15%. Сравнение активности глюкокортикоидов свидетельствует о 4-5-кратном
превосходстве |
дексаметазона |
по сравнению |
с кортизолом |
угнетать как |
пролиферацию |
клеток, так и |
синтез коллагена. |
Действие ГК |
отменяется в |
