
диссертации / 5
.pdf
_________________ ОБЗОР ЛИТЕРАТУРЫ ___________________ |
11 |
Рис. 1. Классическая «двухступенчатая» модель действия глюкокортикоидов,
опосредованная внутриклеточными рецепторами [Rang H.P., Dale M.M., Ritter J.M., 2005].
структуре выделяют домены, которые связывают глюкокортикоидную молекулу, ДНК, участки, ответственные за регуляцию транскрипции и димеризацию рецепторов (табл.1). Точечные мутации в центральной области 4
домена приводят либо к полной, либо к значительной потере способности рецептора связывать гормон [Sato A et al., 1996]. В отсутствие гормона рецепторы представляют собой неактивные гетеротетрамерные комплексы,
содержащие белки теплового шока (hsp90 и hsp70) и иммунофилины (рис. 3).

_________________ ОБЗОР ЛИТЕРАТУРЫ ___________________ |
12 |
Рис. 2. Структурно-функциональная карта рецептора глюкокортикоидов
[Miesfeld,Bloom,1996].
Рис. 3. Схема взаимодействия глюкокортикоид-рецепторного комплекса с гормончувствительными элементами генома клеток-мишеней [Weigel NL, Zhang Y., 1998].

Табл.1. Домены внутриклеточных рецепторов глюкокортикоидных гормонов и их функции [Rang et al., 2005].
Название |
|
I |
|
II |
|
|
III |
|
|
|
IV |
|
|
домена |
|
Регуляторный |
|
ДНК- |
|
“Петлевой” |
|
|
Стероид-связываюший |
|
|||
|
|
домен |
|
связывающий домен |
|
домен |
|
|
|
домен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Свойства |
|
Активация |
|
Узнавание |
и |
|
Определение |
|
Связывание |
лиганда. |
|
||
домена |
|
транскрипции |
|
связывание с |
гормон- |
|
локализации в ядре |
|
Активация |
транскрипции. |
|
||
|
|
Белок-белковые |
|
чувстви-тельным эле- |
|
клетки, димериза- |
|
Связывание |
белков |
теплового |
|
||
|
|
взаимодействия. |
|
ментом ДНК. Димери- |
|
ция. |
|
шока |
и |
иммунофилинов. |
|
||
|
|
|
|
зация |
|
|
|
|
Определение |
локализации в |
|
||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
ядре. Димериация |
|
|
||
________________ ОБЗОР ЛИТЕРАТУРЫ ________________ |
13 |
Одна из функций белков теплового шока заключается в способствовании перехода гормонсвязывающего домена рецептора в конформацию,
характеризующуюся высоким сродством к стероиду. Другим важным свойством комплексообразование рецепторов ГК с белками теплового шока является предотвращение гидролиза рецепторной молекулы специфическими протеазами [Сергеев и соавт., 1998].
В интактных клетках в отсутствии лиганда указанные гетерокомлексы 9S
глюкокортикоидных рецепторов связаны с микротубулярным аппаратом
(колхицин - вещество, разрушающее микротрубочки, ингибирует ряд геномных эффектов глюкокортикоидов). Иммунофиллины, взаимодействующие с гетерокомплексами рецепторов стероидных гормонов всех типов, имеют молекулярную массу около 59 кДа и принимают участие в разворачивании молекулы рецептора.
Число генов в клетке, экспрессия которых напрямую регулируется ГК,
варьирует между 10 и 100, но транскрипция многих других генов опосредованно регулируется РГ путѐм их взаимодействия с другими факторами транскрипции. После активации рецепторы ГК образуют димер,
который связывается соответствующим гормончувствительным элементом
(ГЧЭ) ДНК, находящимся в 5'-промоторной зоне стероидо-чувствительных генов. Это взаимодействие изменяет порядок транскрипции, вызывая индукцию или репрессию данного гена [Beato, 1989]. ГЧЭ стимулирующего типа - это последовательность нуклеотидов, включающая 15 пар оснований -
ГГТАЦАnnnТГТТЦТ (где n - любой нуклеотид). Репрессию транскрипции осуществляют негативные ГЧУ (нГЧЭ), которые имеют более изменчивую последовательность расположения нуклеотидов (АТЦАЦnnТnТГАТЦn). К
генам, экспрессия которых негативно регулируется ГК относятся гены цитокинов и их рецепторов, гены коллагеназы и стромелизина – т.е. БАВ,
принимающих участие в воспалении и иммунных реакциях.
________________ ОБЗОР ЛИТЕРАТУРЫ ________________ |
14 |
|||
Помимо этих простых ГЧЭ существуют комбинированные ГЧЭ, которые |
||||
имея другую |
последовательность |
нуклеотидов, являются |
акцепторами |
|
действия других ядерных факторов |
транскрипции, в частности фактора |
|||
транскрипции АР-1, |
состоящего из продуктов онкогенов Fos и Jun [Rang et al., |
|||
2005]. АР-1 образует |
белок-белковый |
комплекс с активным рецептором ГК, |
||
предотвращая |
его взаимодействие с ДНК и соответственно снижая ответ на |
|||
действие стероидов.
Ряд исследователей придерживаются мнения о гетерогенности внутриклеточных рецепторов ГК, основанное на различиях параметров связывания меченых лигандов. Так, на периферических лимфоцитах имеются рецепторы с Kd1 - 0,088 0,025 нМ и Kd2 - 4,2 0,6 нМ, причем В-лимфоциты имеют рецепторы с Kd1 в 3 раза больше, чем Т-лимфоциты. Митогенная и антигенная стимуляция приводит к увеличению в несколько раз рецепторов с
Kd1 [Reichardt HM et al., 1998].
Некоторые авторы считают, что не существует подтипов рецепторов ГК
[Shahidi H et al., 1999], хотя одна изоформа рецептора (ГР ), не связывающая гормон и являющаяся транскрипционно неактивной, была описана [Lu NZ, Cidlowski JA, 2006]. ГР был обнаружен в человеческих тканях, но
функциональная его значимость неясна.
Участие системы вторичных мессенджеров в механизме действия
глюкокортикоидов.
Данные последних лет значительно расширили представления о молекулярных механизмах действия ГК на клеточные функции [Nordeen S.K. et al., 1994].
Допускается возможность реализации отдельных ранних эффектов ГК через посредство вторичных мессенджеров – внутриклеточной системы
сравнительно небольших молекул и ионов, с помощью которой
осуществляется передача и реализация внеклеточного сигнала в клетке-
мишени. В настоящее время выделяют следующие вторичные мессенджеры:
цАМФ, продукты гидролиза фосфотидилинозитола, ионы кальция, цГМФ.
15
цАМФ. За счет изменения уровня этого мессенджера происходит регулирование фосфорилирования белков клетки. Синтез цАМФ из АТФ
катализирует аденилатциклаза (АЦ) - интегральный белок цитоплазматических мембран, активный центр которого расположен на
внутренней стороне мембраны. Мембранный рецептор и фермент сопрягаются через ГТФ-связывающий белок (G-белок). Для перехода АЦ в активное состояние необходимо взаимодействие ее каталитической субьединицы с G-
белком. Субстратом для аденилатциклазы является Mg-АТФ или Mn-АТФ,
свободный АТФ является ее конкурентным ингибитором. Образовавшийся
цАМФ |
через |
цАМФзависимую |
протеинкиназу |
осуществляет |
|
фосфорилирование |
любого белкового |
субстрата. |
Гидролиз цАМФ |
||
осуществляется фосфодиэстеразами, которые делятся на два типа, в
зависимости от сродства к цАМФ. цАМФ может регулировать освобождение кальция из митохондриальной фракции и/или участвовать в освобождении
кальмодулина |
из мембранных |
структур за счет фосфорилирования |
мембранных белков. |
|
|
Возможное |
участие цАМФ в |
проведении гормонального сигнала ГК |
основывается на том, что активация внутриклеточных гормон-рецепторных комплексов, предваряющая их транслокацию в ядро, является цАМФ зависимым процессом [Perez-Martinez L. et al., 1998]. Поэтому колебание концентрации цАМФ может приводить к изменению внутриклеточной рецепции ГК. В этом случае мембранные рецепторы, передающие внешний сигнал на аденилатциклазу, выполняют модулирующую роль: они подготавливают клетку к "восприятию" гормонального сигнала [Christ M. et al., 1999].
Стероидные гормоны потенцируют опосредованное активаторами аденилатциклазы повышение уровня цАМФ в лимфоцитах [Hirano T. et al., 1998; Shahidi H. et al., 1999; Dosiou C. et al., 2008]. Этот механизм реализации гормонального влияния не чувствителен к действию актиномицина D и
16
циклогексимида. В ряде работ указывается на снижение активности
фосфодиэстеразы цАМФ в присутствии стероидов [Buttgereit F, Scheffold A., 2002]. Однако, как правило, рассматриваемые эффекты проявляются при концентрации гормонов в среде 1 - 10 мкмоль/л. Поэтому, мало вероятно, что в физиологических условиях увеличение содержания цАМФ при действии ГК связано с их ингибирующим влиянием на активность фосфодиэстеразы цАМФ.
Возможно, влияние стероидов на аденилатциклазную систему реализуется на
уровне цАМФ-зависимых протеинкиназ, функция которых регулируется цАМФ и стероидами [Gekle M. et al., 2014].
Полифосфоинозитидная система. Стимуляция данной системы запускает два каскада реакций, приводящих к увеличению концентрации внутриклеточного кальция и активации протеинкиназы С (посредством ее
осуществляется дальнейшее фосфорилирование мембранных белков)
[Berridge, 1993]. Фактически все клетки млекопитающихся содержат в
плазматической мембране малые количества фосфоинозитида (PI),
фосфоинозитидфосфата (РIP) и фосфоинозитиддифосфата (PIP2) [Gordeladze et al., 1994]. Их присутствие поддерживаются в равновесии двумя "холостыми циклами", катализируемыми киназами и фосфолеоноэстеразами. Внешний
сигнал от различных веществ, в том числе и гормонов, после взаимодействия с мембранными рецепторами через G-белок активирует фосфолипазу С,
которая гидролизует PIP2 с образованием диацилглицерола и IP3.
Инозитолтрифосфат осуществляет освобождение Са из внутриклеточных депо
(митохондрии, везикулы ЭПР). Диацилглицерол через протеинкиназу С модулирует потенциало- и рецепторозависимые кальциевые каналы [Авдонин,
Ткачук, 1996]. Показано, что стероидные гормоны по-разному влияют на активность фосфолипазы С и, следовательно, на гидролиз РIP2. Эстрогены, в
частности эстрадиол, витамин Д3 вызывают усиление гидролиза PIP2 [Pedram A, Razandi M, Levin ER., 2006; Toran-Allerand CD, Singh M, Setalo GJr, 1999]; ГК
(дексаметазон, гидрокортизол) блокируют атиген-индуцированный распад PIP2
17
в базофилах и лимфоцитах, оказывая тем самым антипролиферативное действие [McEwen, 1991; Solito E. et al, 2003].
Ионы кальция. Кальций является одним из универсальных посредников в реализации внешнего сигнала, причем он филогенетически более древний,
чем гормоны и циклические нуклеотиды. Установлено, что увеличение цитоплазматической концентрации ионов кальция (Са2+) является событием,
необходимым для активации ряда физиологических процессов внутри клетки
[Ткачук, 1983]. В покоящейся клетке концентрация свободного Са2+
поддерживается на довольно низком уровне, в лимфоцитах человека она составляет в среднем 100 нМ, концентрация же Са2+ в межклеточной среде на
4 порядка выше. Такое низкое содержание кальция, по-видимому, необходимо клетке для реализации различного вида сигналов, когда его концентрация возрастает почти трехкратно [Орлов, Лабас, 1989]. Источники повышения концентрации Са2+ цитоплазмы могут находится во внешней среде,
внутриклеточных органеллах и в самой цитоплазме клетки. Са2+ ,
присутствующий в цитоплазме, связан с фосфолипидами и белками, однако его количество незначительно. В выбросе кальция из внутриклеточных депо возможно участие кальциевых каналов, во многом напоминающих таковые на плазматической мембране, однако механизм их действия до сих пор недостаточно изучен. Вход внеклеточного кальция осуществляется за счет небольшого постоянного неспецифического тока, основанного на разности концентраций внутри и вне клетки. Благодаря этому возникает направленный внутрь клетки электрохимический градиент кальция. Поток ионов имеет низкий температурный коэффициент и не чувствителен к метаболическим ингибиторам, что говорит о его независимости от источников энергии. Для входа кальция в клетку существуют также специфические потенциало- и
рецепторо-зависимые каналы. Выход иона осуществляется за счет работы Са-
АТФазы, участвующей в активном транспорте иона против градиента концентрации, т.е. это - энергозависимый процесс. Са-АТФазные насосы
18
поддерживают постоянное низкое содержание кальция, что обеспечивает быстрое прекращение ответа на биологический стимул и предупреждает повреждающее действие внутриклеточного кальция при его избытке. Таким образом, основным механизмом входа Са2+ в клетку является, по-видимому,
облегченная диффузия, а выход осуществляется путем активного транспорта.
На роль ионов кальция в реализации гормонального влияния ГК указывают данные о том, что в случае отсутствия в среде Са2+ катаболическое действие ГК на лимфоидную ткань (ингибирование синтеза РНК и белка) не проявляется. В тоже время показано, что ГК подавляют транспорт Са2+ внутрь клеток-мишеней и уменьшают внутриклеточное содержание кальция пропорционально биологической активности стероидов и их действующей концентрации [Doolan C.M., O'Sullivan G.C., Harvey B.J., 1998]. Описанные эффекты могут объясняться способностью стероидных гормонов стимулировать обмен фосфоинозитидов плазматической мембраны, что вызывает мобилизацию кальция из внутриклеточных депо и внеклеточной жидкости. Подтверждением этого предположения служат исследования, в
которых показано, что стероидные гормоны изменяют обмен мембранных фосфолипидов [Сергеев П.В. и соавт., 1996, Baran D.T. et al., 2004]. Эти и целый ряд других данных последних лет подтверждают целесообразность рассмотрения действия ГК на систему вторичных медиаторов в качестве возможного пути реализации биологической активности стероидов в клетках-
мишенях.
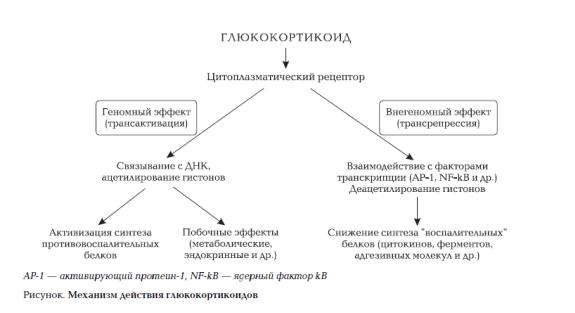
Экстрагеномные эффектыглюкокортикоидов. В последние годы установлено,
что гормонрецепторные комплексы (в виде мономера) непосредственно и через молекулы СBP взаимодействуют с факторами транскрипции (активирующий протеин 1 (AP1), NF-kB и др.), которые активируются под влиянием медиаторов воспаления, оксидантов и вирусов [Zeng J et al., 2013]. Итогом этого является торможение транскрипции "воспалительных" генов
(трансрепрессия) (схема 1). Последнее, в свою очередь, уменьшает образование
________________ ОБЗОР ЛИТЕРАТУРЫ ________________ |
19 |
в клетках следующих белков и пептидов [Шимановский Н.Л., 2005; Schacke H
et al., 2004]:
-провоспалительных цитокинов (интерлейкинов 1—6, 9, 11—13, 16—18,
фактора некроза опухоли α, гранулоцитарно-макрофагального
колониестимулиующего фактора);
- хемокинов (интерлейкина 8, эотаксина, RANTES, моноцитарного
хемотаксического белка_4, воспалительного белка макрофагов-1α),
привлекающих клетки в зону воспаления;
-индуцибельной циклооксигеназы (ЦО-2), участвующей в образовании простагландинов;
-индуцибельной фосфолипазы А2, катализирующей синтез арахидоновой кислоты;
-молекул адгезии (ICAM-1, VCAM-1) лейкоцитов;
-рецепторов субстанции P (NK1-рецепторов).
Схема 1. Эффекты глюкокортикоидов, опосредованные цитозольными рецепторами.
Сравнительно недавно было показано, что одним из молекулярных механизмов подавления стероидами экспрессии ―воспалительных‖ генов является
