
студ ивт 22 материалы к курсу физики / belonuchkin_ve_zaikin_da_tsipeniuk_ium_kurs_obshchei_fiziki
.pdf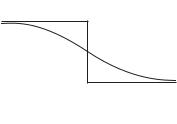
4.7 ] |
Основы теории теплоемкости |
371 |
Хотя бы из соображений размерности ясно, что роль «коэффициента диффузии температуры» играет коэффициент температуропроводности . Заметное «продвижение температуры» в холодный стержень и «продвижение холода» в горячий будут ограничены расстояниями 2 1 2. Примерный профиль температур через некоторое время по-
сле начала процесса изображен на |
|
|
рис. 4.16 штриховыми линиями. |
|
|
В явлениях вязкости подобную |
|
|
роль играет кинематический коэф- |
|
|
фициент вязкости . Если, к приме- |
|
|
ру, привести в движение по поверх- |
|
|
ности пруда плот, то через время за |
1 |
2 |
счет вязкости начнут двигаться слои |
|
|
воды до глубины порядка 2 1 2. |
Рис. 4.16 |
|
Кстати, напомним, что в газах |
||
|
. В конденсированном состоянии наши оценки остаются справедливыми, но соответствующие коэффициенты могут
отличаться на много порядков (см. § 1.3).
Теория теплоемкости и квантовые эффекты. Очень логичная и глубоко обоснованная классическая теория теплоемкости, базирующаяся на законе равнораспределения, в некоторых случаях не выдерживает экспериментальной проверки.
Приведем несколько примеров.
Для большинства твердых тел довольно хорошо выполняется закон Дюлонга и Пти, согласно которому молярная теплоемкость равна 3 . Но теплоемкость кристаллического углерода гораздо меньше: у графита она примерно равна , у алмаза — и вовсе 0,75 .
Вметаллах свободные электроны во многом ведут себя подобно идеальному газу. Однако вклада в теплоемкость они не дают.
Влюбой молекуле, состоящей из нескольких (хотя бы двух) атомов, в принципе существуют колебательные степени свободы: атомы могут колебаться относительно друг друга. Но в прямом противоречии с законом равнораспределения вклада в теплоемкость эти степени свободы не вносят.
Теплоемкость всех веществ, особенно это заметно для твердых тел, зависит от температуры, что также явно противоречит закону равнораспределения. Можно привести и другие примеры.
Все эти противоречия классической теории теплоемкости разрешаются в рамках квантовой теории. Основная особенность квантовых представлений с интересующей нас точки зрения — дискретность энергетического спектра микросистем. Энергия ча-

372 Элементы статистической физики [ Гл. 4
стицы не может принимать произвольное значение, возможны только некоторые избранные, разрешенные ее значения.
Квантовая теория теплоемкости будет подробно рассмотрена в главах 8 и 9. А сейчас мы на некоторых простейших примерах проследим, как дискретность энергетического спектра влияет на теплоемкость.
Двухуровневая система. Электрон в магнитном поле может находиться только в двух энергетических состояниях: его спин может иметь проекцию на направление магнитного поля или
2, или 2.
Разность энергий в этих двух состояниях
2 . Заселенности верхнего уровня 2 и нижнего 1 связаны формулой Больцмана
2 1 Б
Учитывая, что полное число частиц 1 2, получаем заселенность верхнего уровня
2 1 Б
и полную энергию взаимодействия с магнитным полем
|
|
|
(4.58) |
1 Б |
При малых температурах Б в знаменателе можно пренебречь единицей, и тогда после дифференцирования по температуре получаем для теплоемкости, приходящейся на рассматриваемую степень свободы, следующее выражение
2
|
|
Б |
(4.59) |
||
|
|
|
|||
Б |
|
||||
|
|
||||
|
Б |
|
|
|
|
Мы видим, что при низких температурах теплоемкость такой двухуровневой системы оказывается экспоненциально малой по сравнению с классическим значением и становится заметной, когда Б по порядку величины приближается к . Это общее правило — степени свободы как бы постепенно «включаются» по мере приближения тепловой энергии Б к характерному масштабу квантования энергии.
Вращательная энергия. Напомним, что порядок величины ступенек энергетического спектра для вращательного движения
определяется величиной 2 , где — постоянная Планка, а— соответствующий момент инерции. Обычно величина ступенек для молекулы составляет около 10 23 Дж, что соответствуетБ при температуре около 1 К. Поэтому при комнатных температурах вращательные степени свободы полностью возбуждены и квантовые эффекты себя не проявляют.

374 |
Элементы статистической физики |
[ Гл. 4 |
Этот интеграл должен сходиться — в этом состоит первая часть утверждения Нернста. Для этого, в частности, необходимо, чтобы теплоемкость при стремлении температуры к нулю убывала (по крайней мере, быстрее, чем ), стремясь в пределе к нулю.
Кроме того, надо постулировать, что любые переходы из одного состояния в другое при абсолютном нуле происходят без изменения энтропии. Иначе неясно, к одному и тому же пределу стремится энтропия при различных способах перехода к нулю температуры или к различным пределам.
Теорема Нернста получает естественное объяснение в квантовой теории. Во-первых, снимается противоречие с законом равнораспределения, который требовал постоянства теплоемкости, по крайней мере, теплоемкости при постоянном объеме.
Во-вторых, при абсолютном нуле температуры система должна находиться в состоянии с минимально возможной энергией. Если учесть квантовомеханический принцип тождественности микрочастиц, то мы получаем, что при абсолютном нуле температуры равновесному макросостоянию системы соответствует одно единственное микросостояние. Статистический вес этого состояния, как правило, равен единице, а следовательно, энтропия равна нулю.
Существенно, что при этом статистическая энтропия, вычисленная по формуле (4.38), совпадает с термодинамической энтропией, рассчитанной, например, с помощью соотношения (4.60).
* * *
В основаниях статистической физики лежат представления о вероятностном характере поведения макросистем, состоящих из большого числа частиц. Это с неизбежностью приводит к вероятностной трактовке законов термодинамики. Меняется формулировка второго начала: система не обязательно пойдет к равновесию — такое развитие событий только наиболее вероятно. Точно так же система, пришедшая к равновесию, не находится всегда в этом, наиболее вероятном состоянии — ее макроскопические параметры флуктуируют около наиболее вероятных значений.
Однако вероятность того, что система будет эволюционировать не к равновесию, а от него, как и вероятность ощутимых флуктуаций очень быстро убывают с ростом числа частиц (подсистем), составляющих систему.
Для системы, сколько-нибудь реально претендующей на роль макроскопической, эти вероятности становятся столь ничтожными, что законы термодинамики вполне можно считать динамическими и поведение системы строго детерминированым.

4.8 ] |
Задачи |
375 |
Статистические закономерности приводят к закону равнораспределения кинетической энергии по степеням свободы, что открывает, в частности, возможность расчета теплоемкостей газов и твердых тел. Отступления от закона равнораспределения, безусловно справедливого в рамках классической физики, объясняются проявлением квантовомеханических закономерностей.
Задачи
1. Оцените, на какой высоте в горах можно сварить яйцо, если белок свертывается при температуре с 353 К (80 ÆC). Атмосферу считать изотермической со средней температурой 280 К (7 ÆC); теплота испарения воды при этой температуре равна 4,45 104 Дж/моль.
Ук а з а н и е . На уровне моря, при давлении 0, температура кипения воды0 373 К. Подставляя вместо в формулу (3.15) с, а в формулу (4.13) —
, и приравнивая получившиеся выражения, находим высоту, на которой температура кипения воды равна 80 ÆC.
Ответ: с 0 6 км
с 0
2. Конический сосуд высоты , заполненный идеальным газом с молярной массой , подвешен вершиной вниз, как показано на рис. 4.17. При какой температуре наиболее вероятное значение координаты молекулы равно 2?
|
У к а з а н и е . Число молекул в слое толщины равно |
|
||
произведению концентрации 0 на |
|
|||
объем слоя, который пропорционален 2. |
|
|
||
|
Ответ: |
|
|
|
|
4 |
|
|
|
|
3. Из результатов многочисленных измерений известно, |
|
||
что |
в диапазоне высот от 1 120 км |
до 2 160 км |
Рис. 4.17 |
|
температура в атмосфере меняется по линейному закону от |
||||
|
||||
1 332 К до 2 1155 К. |
|
|
||
|
Определить давление 2 на высоте |
2, если на высоте 1 оно рав- |
||
но |
1 2,5 10 3 Па. Молярная масса |
воздуха на таких высотах равна |
||
27,5 г/моль.
Решение. Линейность означает, что на высоте 1 температура равна
1 2 1 2 1 . Плотность газа . Тогда для скорости изменения давления имеем . Окончательно имеем
1 2 1 2 1
После интегрирования от 0 до 2 1 получаем
|
2 |
|
2 1 |
|
2 |
1,967 |
|
|
|
||||
1 |
|
2 1 1 |
|
|||
Отсюда 2 1 1,967 0,14 1 3,5 10 4 Па.
4. Относительная концентрация аргона 40Ar в атмосфере вблизи поверхности Земли составляет 0,9 %. Считая атмосферу изотермической ( 280 К), оцените относительную концентрацию аргона на высоте, где давление падает в 10 раз.
376 |
Элементы статистической физики |
[ Гл. 4 |
Решение. При решении этой задачи учтем, что, во-первых, давление и концентрация для идеального газа пропорциональны друг другу и, во-вторых, один идеальный газ не влияет на поведение другого. Концентрации газов с разными молярными массами по-разному убывают с высотой. Концентрация аргона весьма мала, поэтому можно считать, что до высоты, на которой давление падает в 10 раз, молярная масса воздуха не меняется (измерения подтверждают это). Поэтому мы можем записать изменение концентрации для воздуха в целом ( 1 29 г/моль) и отдельно для аргона ( 2 40 г/моль):
|
|
|
|
|
1 |
1 0 1 , |
(4.61) |
|||||||||
|
|
|
|
|
2 |
2 0 |
2 |
(4.62) |
||||||||
Поделив (4.62) на (4.61) и учитывая, что отношение концентраций аргона |
||||||||||||||||
и воздуха есть относительная концентрация , получим |
|
|||||||||||||||
|
|
|
|
0 1 |
2 |
(4.63) |
||||||||||
Прологарифмируем (4.62) и (4.63) и поделим одно на другое: |
||||||||||||||||
|
|
|
|
|
0 |
|
|
1 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
0 |
1 |
|
2 |
|
|||||||
Учитывая, что по условию задачи |
|
0 0,1, а 0 0,009, окон- |
||||||||||||||
чательно получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
0 10 1 |
2 1 |
0,0038 0,38 |
|||||||||||||
5. Скорости молекул 1 и 2 равновероятны. Во сколько раз они отлича- |
||||||||||||||||
ются от вер, если 2 1 |
|
5? |
|
|
|
|
|
|
|
|
|
|
||||
Ук а з а н и е . Удобно, полагая 1 вер |
и 2 вер |
, воспользоваться |
||||||||||||||
выражением (4.36). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1 |
|
|
2 |
|
1 2 |
|
|
|
|
2 |
|
|
|
|
|
Ответ: |
|
|
|
0,366, |
|
|
|
1,83 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
вер |
2 1 |
|
|
|
|
|
вер |
|
||||||||
6. Найти относительную среднеквадратичную флуктуацию высоты столбика смачивающей жидкости в капилляре, опущенном в широкий сосуд. Плотность жидкости — , поверхностное натяжение — .
Ук а з а н и е . При изменении высоты столбика жидкости на некоторую величину Æ возникает возвращающая сила Æ 2, где — радиус капилляра. Избыточная потенциальная энергия — 2 Æ 2 2. Ее среднее значение должно быть равно Б 2.
|
2 1 2 |
|
|
|
1 2 |
|
Ответ: |
Æ |
|
Б |
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
||
7. В микроскоп рассматривают тонкий слой крови. Оценить, какое время
потребуется, чтобы заметить броуновское смещение эритроцитов, плавающих в плазме крови, если минимальное расстояние, которое можно зафиксировать,
составляет 10 6 м. |
|
|
||
Вязкость крови 4,5 10 3 Па с, эритроцит считать шариком радиуса |
||||
3 10 6 |
м. Температура 27 ÆC. |
|||
Ответ: |
3 2 |
15 с |
||
мин |
|
|
||
2 |
Б |
|||
|
|
|
|
|
|
8. Сферический сосуд радиуса 1 заполнен газом. Молярная масса газа — |
|
, |
температура — . Через |
трубочку радиуса 2 и длины газ поступа- |
ет |
в масс-спектрометр. Сечение молекул таково, что выполнены условия |
|
1 2 1 1 , где |
— концентрация газа. |
|
4.8 ] |
Задачи |
377 |
В некоторый момент времени в центре сосуда возникает примесь изотопа того же газа, мало отличающегося по массе. Оценить время, через которое масс-спектрометр сможет зафиксировать примесь.
Решение. Вначале газ должен продиффундировать от центра сосуда до входа в трубку. В соответствии с общим соотношением Æ 2 время, через
которое газ достигнет входа в трубку можно оценить как 1 12 2 13 12 2 12 1 2. Затем газ диффундирует по трубке. При оценке времени распространения по трубке вместо длины пробега 1 мы
должны подставлять величину 2, и значит, 2 2 2 2 3 2 2 1
2 3 1 2 21 Для полного времени распространения газа от центра сосуда до конца трубки получаем оценку 12 2 2 1 2.
9.Определить суммарную энергию вращательного движения молекул метана CH4, занимающего при давлении 105 Па объем 1 дм3.
Ответ: 1,5 150 Дж.
10.Энергия молекулы в магнитном поле может принимать три значения:
0 0, 4 1,2 . Определить энергию взаимодействия с магнитным полем моля таких молекул при температуре .
Ответ: 2 1 0,575
2 1
Г л а в а 5
НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
Классическая термодинамика описывает стабильность, равновесие. Однако вокруг нас совсем другой мир, мир флуктуаций, нестабильности, эволюции и катастроф, хаоса и сложнейших структур, диссипации и самоорганизации. Вблизи равновесия система однозначно реагирует на не слишком сильное возмущение, возвращаясь в состояние равновесия. При этом частицы, составляющие систему, взаимодействуют только на близких расстояниях и ничего «не знают» о частицах, расположенных достаточно далеко. В таких условиях вполне адекватной является модель изолированной, замкнутой системы, термодинамически равновесное состояние которой — состояние максимального хаоса. Однако все коренным образом меняется, если система далеко отклоняется от состояния равновесия. Она может стать неустойчивой, и тогда возврат к начальному состоянию необязателен.
Эта глава посвящена неравновесным процессам. Вначале мы рассмотрим особенности, появляющиеся при рассмотрении неравновесности в обычных газах, а затем перейдем к открытым системам, т. е. системам, постоянно обменивающихся с окружающей средой энергией и веществом.
5.1. Неравновесный газ
Одним из постулатов статистической физики является утверждение о существовании термодинамического (статистического) равновесия. Считается, что система, находящаяся при определенных условиях (при постоянных значениях внешних параметров и постоянной температуре окружающих тел), с течением времени рано или поздно придет в состояние равновесия. Если, например, мы наполним термоизолированный сосуд газом, то с течением времени происходит максвеллизация — процесс установления термодинамического равновесия, приводящий к формированию универсального распределения, сопровождающийся полной потерей информации о начальном виде функции распределения. Единственными сохранившимися данными о начальных условиях являются полное число частиц и полная энергия. Постулат о существовании равновесного состояния для газовой системы в определенных внешних условиях опирается на наши интуитивные представления, основанные на огромном опыте.
5.1 ] |
Неравновесный газ |
379 |
Однако при более глубоком рассмотрении эта фундаментальная закономерность представляется не столь уж очевидной. Вопрос о существовании равновесия в системе прежде всего с неизбежностью приводит к вопросу о временных интервалах, которые связаны с установлением равновесия, т. е. с масштабом времен, с которыми мы имеем дело. Неравновесное состояние фактически представляет собой особую, совершенно своеобразную систему, которая может обладать уникальными свойствами, зачастую не реализующимися в обычных равновесных условиях. Так, например, принципиально неравновесной системой является ударная волна, широко распространенное природное явление. Типично неравновесным процессом является, конечно, и взрыв.
Запас энергии молекулярного газа в состоянии равновесия распределен, образно говоря, по трем энергетическим «резервуарам», соответствующим поступательным, вращательным и колебательным степеням свободы. Эти резервуары сообщаются, и энергия довольно свободно переливается из одного в другой (за счет молекулярных столкновений), однако в среднем энергия каждого резервуара не меняется. Предположим теперь, что мы изменили (например, увеличили) запас энергии в одном из резервуаров. Ясно, что избыточная энергия начнет тотчас же переливаться в соседние, и в течение всего этого процесса газ будет оставаться неравновесным. Говорят также, что при этом происходят релаксационные процессы.
В обычных условиях неравновесность в газе возникает, если система подвергается внешнему воздействию. Так, потоки корпускулярного и электромагнитного излучения нарушают равновесие и химический состав верхних слоев земной атмосферы. Другой пример — поглощение мощного лазерного излучения в газах приводит к накоплению энергии на отдельных степенях свободы, возникает система с неравновесным распределением энергии, которая обладает особыми оптическими характеристиками, уникальной реакционной способностью. Химические реакции, например, процесс горения, сопровождаются появлением «горячих» частиц, имеющих неравновесное распределение энергии по поступательным и внутренним степеням свободы.
Подчеркнем еще раз то, что говорилось ранее при обсуждении процессов переноса, которые принципиально являются неравновесными процессами. В свете молекулярно-кинетических представлений процесс переноса в газах состоит в том, что молекулы, двигаясь хаотически, переносят через произвольно выбранное сечение ту или иную величину: кинетическую энергию — при теплопроводности, импульс — при внутреннем трении, концентрацию молекул — при диффузии. Для переноса всегда требуется наличие градиента макроскопического параметра, например, температуры, гидродинамической скорости или концентрации.
380 |
Неравновесные процессы |
[ Гл. 5 |
При этом появление градиентов приводит к малым возмущениям равновесной функции распределения, которые, в свою очередь, целиком определяют коэффициенты переноса. Другими словами, коэффициенты переноса являются макроскопическим проявлением поступательной неравновесности в газах.
Существует целый ряд явлений, в которых определяющая роль принадлежит малым отклонениям от состояния равновесия. К их числу относятся диссипативные процессы, связанные со второй (объемной) вязкостью в системе. Физическую природу появления при быстром сжатии или расширении новой силы трения (нового канала диссипации энергии), связываемой с объемной вязкостью, можно понять из следующих рассуждений. Если быстро сжать небольшой объем газа, то передаваемая в систему энергия вначале будет сосредоточена на поступательных степенях свободы, и только потом, спустя время релаксации, часть ее перейдет во внутренние (вращательные и, возможно, колебательные) степени свободы. Поскольку давление определяется только поступательным движением молекул, то вначале оно будет несколько выше, чем в случае, когда установится равновесие между поступательным и вращательным движением.
Этот эффект приводит к появлению избыточного гидростатического давления в сжатом газе и к дополнительному уменьшению давления в расширяющемся газе. Для преодоления этого избыточного давления, например при движении тела в газе, необходимо приложить дополнительное усилие. В газе как бы появляется новая сила трения, отличная от внутреннего трения, связанного со сдвиговой вязкостью. Коэффициент объемной вязкости выступает как количественная мера этой новой силы трения, связанной с нарушением равновесия при быстром изменении объема. Таким образом, коэффициент объемной вязкости является макроскопическим выражением неравновесности по внутренним степеням свободы. Смысл термина «объемная вязкость» очевиден. Он отражает факт появления диссипации при быстром изменении объема в многоатомных газах; в одноатомных газах вторая вязкость отсутствует.
Рассмотрим более подробно процесс установления равновесия в газе. Обмен энергией между поступательными и вращательными степенями свободы при столкновении молекул главным образом зависит от соотношения продолжительности столкновенияст и периода вращения 1 , где — частота вращения молекул. При условии
1 |
(5.1) |
за время столкновения молекула не успевает совершить ни одного оборота, поэтому столкновения носят мгновенный характер и называются неадиабатическими. На квантовом языке условие
