
1054
.pdf
Лекция 16. БОРАТНЫЕ И ФОСФАТНЫЕ СТЕКЛА
16.1. Боратные стекла
При нагреве борной кислоты H3BO3 в вакууме выше 500 °С получается оксид бора В2О3 в виде стеклующейся жидкости.
Температура плавления оксида бора составляет 450 °С (температура кипения –2250 °С), температура стеклования ~270 °C и с ростом содержания воды резко уменьшается.
Плотность стеклообразного оксида бора составляет 1,78–1,83 г/см3 и с ростом содержания воды резко снижается.
Диаграмма состояния системы Na2O–B2O3
Оксид бора В2О3 чрезвычайно гигроскопичен, и вода удаляется из расплава барботированием осушенного азота или инертного газа в течение 3–20 ч (полностью удалить воду из расплава не удается).
В стеклообразном оксиде бора существуют цепочки и слоистая структура из почти плоских пирамид, образованных треугольниками BO3/2.
Слоистая и цепочечная структуры предопределяют низкие температуры плавления и стеклования.
131

В щелочно-боратных системах бор образует как треугольники BO3/2, так и тетраэдры с отрицательным зарядом, в которых атом бора имеет координационное число 4 и несет отрицательный заряд ([BO4/2]–1).
Ионы щелочных металлов располагаются около каждо-
го тетраэдра [BO4/2]–1 для компенсации его отрицательного заряда.
Тетраэдры [BO4/2]–1 скрепляют линейную и слоистую структуры в трехмерный каркас.
Связи атомов бора в треугольниках BO3/2 очень близки к парным гибридным связям sp2, и угол связи O−B−О здесь очень близок к классическому значению 120°.
Тетраэдр BO4/2 образуется за счет образования бором sp3- гибридных парных связей, а необходимый для спаривания электрон приходит от натрия и связанного с ним кислорода по реакции
Для области 0–30 мол. % R2O значение количества бора в четверной координации N4 хорошо удовлетворяет зависи-
мости N4 = x/(100 – х).
Это приводит к тому, что бор в тройной координации образует очень плоскую треугольную пирамиду.

 Вид катиона здесь роли не играет.
Вид катиона здесь роли не играет. 

132


 В оптике щелочно-боратные стекла в чистом виде почти не применяются.
В оптике щелочно-боратные стекла в чистом виде почти не применяются.
В лабораторной практике рентгеноструктурных исследований иногда используется стекло Линдемана (содержит кроме B2O3 также Li2O, BeO, Al2O3 и другие добавки), прозрачное для рентгеновских лучей.


 Диаграмма состояния системы BaO–B2O3
Диаграмма состояния системы BaO–B2O3 


В практических составах оптических стекол в сочетании с другими оксидами (кроме B2O3) используются BaO, ZnO, CdO (сверхтяжелые кроны) и PbO (особые флинты, ОФ).
133

Во всех системах RO–B2O3 образуются устойчивые химические соединения (чаще всего бораты RO2B2O3), а со стороны B2O3 (начиная примерно с 3–5 % RO) существует область стабильного расслаивания в жидком состоянии.
Наибольшее значение для оптики имеют стекла системы RO–
B2O3–R′2O3, в которых R′2O3 –
оксид III группы (чаще всего La2O3 или Ga2O3), а в качестве оксида RO обычно используют-
ся ZnO, CdO и(или) PbO.
Область образования прозрачных стекол
(мол. %)
R2O |
До |
RO |
Начало |
Конец |
Li2O |
~ 30–43 |
MgO |
48,8 |
–50,0 |
|
|
|
|
|
Na2O |
~ 38 |
CaO |
27,0 |
41,0 |
K2O |
~ 38 |
SrO |
21,0 |
43,0 |
Rb2O |
~ 35 |
BaO |
16,4 |
40,0 |
Cs2O |
~ 40 |
PbO |
19,0 |
76,5 |
– |
– |
ZnO |
44,0 |
64,0 |
|
|
|
|
|
– |
– |
CdO |
39,0 |
55,0 |
Такие стекла отличаются особым сочетанием показателя преломления и диспер-
сии (nD ~ 1,64–1,87, νD ~ 53,6–47,5).
Из-за высокой прочности связей с кислородом, высоких координационных чисел лантана и отсутствия немостиковых связей стекла системы
ZnO–B2O3–La2O3 короткие и тугоплавкие.
Система |
nD |
νD |
|
|
|
B2O3–ZnO–La2O3 |
1,68–1,78 |
47,5–53,6 |
|
|
|
B2O3–CdO–La2O3 |
1,71–1,76 |
46,0–49,8 |
|
|
|
B2O3–PbO–La2O3 |
1,64–1,87 |
25,3–44,6 |
|
|
|
Стекла отличаются высокой химической устойчивостью, имеют высокие модули упругости и твердость.
ТБФ5 |
B2O3 |
La2O3 |
ZnO |
CdO |
TiO2 |
Ta2O5 |
WO3 |
nD |
νD |
|
|
|
|
|
|
|
|
|
|
||
47,41 |
12,88 |
13,44 |
15,68 |
3,2 |
1,9 |
5,48 |
1,8078 |
41,3 |
||
|
||||||||||
|
|
|
|
|
|
|
|
|
|
134
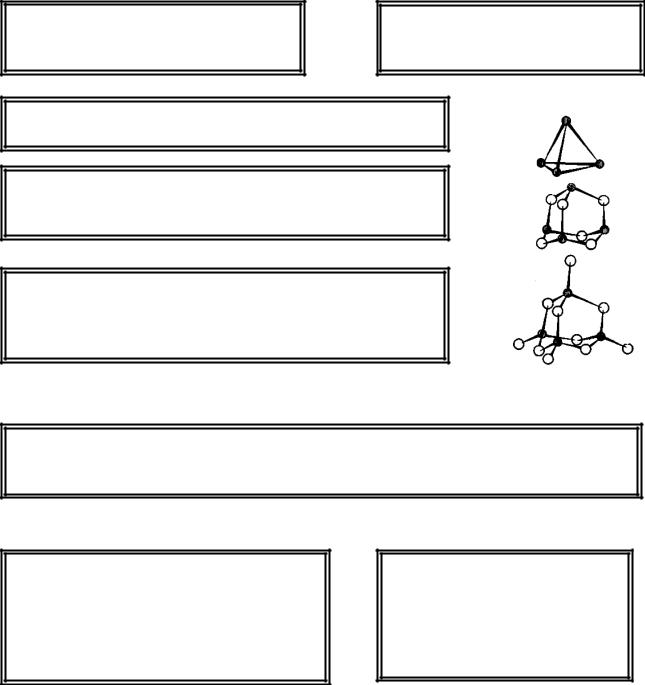
16.2. Фосфатные стекла
Оксид фосфора P2O5 является одним из важнейших стеклообразователей в практике оптического стекловарения.
В чистом виде в природе фосфор не встречается вследствие крайневысокой гигроскопичности.
Фосфор является элементом с переменной валентностью и в соединениях может быть 3-, 4- и 5-валентным.
Образование устойчивых окисных структур P2O3 и P2O5 происходит на базе структурного тетраэдра из атомов фосфора.
Локализация атомов кислорода вблизи середин каждого из шести ребер тетраэдра P4 приводит к образованию структурной единицы P4O6, соответствующей окислу
P2O3.
Дополнительное присоединение к каждому атому фосфора по атому кислорода за счет двойной связи Р=О приводит к образованию структурной единицы P4O10, соответствующей окислу P2O5.
В кристаллическом состоянии оксид фосфора P2O5 имеет три основные модификации: гексагональную, орторомбическую и тетрагональную, с температурами плавления 422, 550–570 и 580 °С соответственно.
Все модификации образуют стекла с nd = 1,5…1,52, но из-за чрезвычайно высокой гигроскопичности данных о свойствах этих стекол слишком мало.
135

С окислами щелочных и щелочноземельных элементов оксид фосфора образует устойчивые соединения – метафосфаты (1:1), пирофосфаты (2:1) и ортофосфаты (3:1).
Область стеклования
Оксид |
Li2O |
Na2O |
K2O |
MgO |
Мол. % |
0–60 |
0–60 |
0–47 |
0–60 |
|
|
|
|
|
Оксид |
CaO |
SrO |
BaO |
Ag2O |
Мол. % |
0–56 |
0–56 |
0–58 |
0–66 |
|
|
|
|
|
Оксид |
ZnO |
CdO |
PbO |
– |
|
|
|
|
|
Мол. % |
0–64 |
0–57 |
0–62 |
– |
|
|
|
|
|
Основу структуры щелочно-фосфатного стекла составляют цепочки и кольца, в которых ион щелочного металла находится около немостикового атома кислорода.

 Взаимодействие между цепочками и кольцами кулоновское, как в метасиликатах.
Взаимодействие между цепочками и кольцами кулоновское, как в метасиликатах. 

Щелочно-фосфатные стекла имеют низкие значения температуры стеклования Tg, и они довольно короткие.
Двухвалентные катионы делают связь между структурными элементами более прочной (повышается значение Tg), а сами стекла более длинными.
Из-за легкой растворимости метафосфатов присутствие щелочных металлов в составах оптических бесцветных стекол нежелательно.
136

Наиболее подходящими для практических целей являются стекла систем P2O5–
BaO–Al2O3 и P2O5–BaO– SiO2.


 Фосфатные кроны
Фосфатные кроны


Большинство составов фосфатных кронов (ФК, включая ТФК) основаны на системе
P2O5–BaO–Al2O3.
Введение в состав стекол оксида алюминия и оксида кремния уменьшает их способность к растворению в воде и кислотах.
Современные фосфатные стекла никогда не содержат щелочей, так как последние ухудшают их химическую устойчивость.
Оксид |
ФК13 |
ФК14 |
ФК24 |
ТФК11 |
|
|
|
|
|
Р2О5 |
63,00 |
49,44 |
48,72 |
41,47 |
BaO |
19,12 |
36,13 |
35,60 |
41,28 |
|
|
|
|
|
Аl2О3 |
7,79 |
3,26 |
3,21 |
– |
|
|
|
|
|
SiO2 |
4,54 |
2,60 |
2,57 |
– |
В2О3 |
2,71 |
2,67 |
2,63 |
10,95 |
|
|
|
|
|
La2O3 |
2,38 |
5,43 |
5,35 |
– |
|
|
|
|
|
Y2O3 |
– |
– |
1,52 |
– |
|
|
|
|
|
As2O3 |
0,46 |
0,47 |
0,40 |
– |
|
|
|
|
|
CaO |
– |
– |
– |
6,30 |
|
|
|
|
|
nd |
1,5468 |
1,5799 |
1,5816 |
1,6016 |
νd |
67,58 |
65,08 |
47,17 |
47,74 |
На основе фосфатных стекол производятся активные элементы оптических квантовых генераторов (содержат оксид неодима Nd2O3 и другие активаторы).
137


 На основе фосфатных стекол разработаны специальные светофильтры.
На основе фосфатных стекол разработаны специальные светофильтры. 

Ультрафиолетовые |
Содержат 66–85 % P2O5, 2–3 % B2O3, 3–7 % Al2O3, 5– |
|
17 % BaO, 4–7 % K2O, а в качестве красителей добавлено |
|
несколько процентов CoO и NiO |
Зеленые |
Основа имеет примерно такой же состав, что и в ультра- |
|
фиолетовых светофильтрах, но в качестве красителей ис- |
|
пользованы CuO и Cr2O3 |
Атермальный |
Не содержит красящих добавок, поскольку предназначен |
|
для отсечения теплового излучения. Требует принуди- |
|
тельного охлаждения и имеет сложную технологию изго- |
|
товления (Tg = 640 °С, высокая вязкость в области освет- |
|
ления) |
138

Лекция 17. ФТОРОСОДЕРЖАЩИЕ ОПТИЧЕСКИЕ СТЕКЛА
Фторидные стекла – это класс неоксидных оптических стекол, образованных фторидами различных металлов.
Высокочистые фторидные стекла (фтороцирконатные, фторалюминатные и др.) перспективны для изготовления оптических деталей и устройств, работающих в УФ-, видимом, ближнем и среднем ИК-диапазонах, а также в качестве элементной базы проходной и волоконной оптики (световоды, волоконные лазеры и др.).
Фторидные световоды с низкими оптическими потерями необходимы для создания волоконно-оптических датчиков, низкотемпературных пирометров, устройств лазерной микрохирургии, средств технической диагностики, в качестве активных сред ИК-лазеров.
Силовые фторидные световоды с высокой лучевой прочностью к лазерному излучению требуются для комплектации линий YAGEr3+ и других лазеров.
Оптические фторидные волокна, легированные редкоземельными элементами, наиболее перспективны для создания высокоэффективных воло- конно-оптических усилителей и лазеров.

 Фторалюминатные стекла перспективны для микроэлектроники.
Фторалюминатные стекла перспективны для микроэлектроники. 


 В качестве основы фторосодержащих стекол используется
В качестве основы фторосодержащих стекол используется

фтористый бериллий BeF2, структура ближнего порядка которого аналогична структу-
ре SiO2;
многокомпонентные системы, содер-
жащие ZrF4, HfF4, AlF3, GaF3, PbF2, NaF
и другие фториды, которые сами стекол не образуют.
139

17.1. Фторбериллатные стекла
Стеклообразный фтористый бериллий имеет низкую температуру стеклования (Tg = 310 °C) и является, как и кварцевое стекло, длинным.
Плотность стеклообразного фтористого бериллия при 20 °С составляет 2,08, а показатель преломления nD = 1,33 (как у воды).
Практическое значение имеют стекла, содержащие кроме BeF2 фториды щелочных и щелочноземельных металлов, а также фториды некоторых переходных металлов, поскольку они имеют оптические константы, близкие к константам флюорита
(CaF2).
Диаграммы состояния систем, образованных фтористым бериллием и фторидами щелочных металлов (LiF, NaF и др.), схожи с диаграммами состояния кремнезема с оксидами RO (CаO, MgO и др.). Однако образующиеся соединения имеют примерно в два раза более низкие температуры плавления.
Области стеклообразования в системах с LiF, NaF и KF со стороны BeF2 ограничены фазовым разделением жидкость – жидкость подобно тому, как это имеет место в силикатных системах.
Фторбериллатные стекла получают в закрытых крышкой платиновых тиглях из соли – фторобериллата аммония – при 800–900 °С:
В целом максимальное содержание второго компонента (фторида металла) во фторбериллатных стеклах может достигать ~60 мол. %.
(NH4 )2 BeF4 →2NH3 ↑+ BeF2,
сдобавлением фторидов других металлов
Высокая токсичность фтористого бериллия требует специальных условий производства, что не позволяет широко использовать фторбериллатные стекла на практике.
140
