
Журнал магистров. Masters journal N 2
.pdf
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси, т.е. концентраций всех реагентов, в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрация реагирующих веществ, тем больше скорость химической реакции [4]. В основе химической кинетики лежит основной постулат химической кинетики: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях [5]:
V k CАх СВу СDZ ...
Кинетические уравнения в химии зависят только от условий процесса. Реакциипервогопорядкахарактеризуютсякинетическимуравнениемвида
V k1CA. |
(1) |
||||||
Подставим в него выражение V |
|
dC |
, тогда |
|
|||
|
|
|
|||||
ист |
|
|
dT |
|
|||
|
|
|
|
||||
V k C |
|
|
dC |
. |
|
||
A |
|
|
|||||
1 |
|
|
dt |
|
|||
|
|
|
|
|
|||
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной [6]. Выразим t1/2 для реакции первого порядка, учитывая, что С = 1/2С0:
1 |
C0 |
|
lnC0 |
k1t, |
|
ln |
2 |
|
|||
|
|
|
|
|
|
отсюда
t1/2 ln2 .
k1
Как следует из полученного выражения, период полупревращения реакции первогопорядканезависитотначальнойконцентрацииисходноговещества.
Сравним кинетический подход в биомеханике и химии на основе кинетической схемы процесса биодеструкции одного из лекарственных средств – парацетамола. При биодеструкции парацетамола справедливо кинетическое уравнение первого порядка [7–9].
Для экстенсивных процессов
dx |
k(t)x, |
(2) |
|
dt |
|||
|
|
где k t at b, x t 0 x0 , где x0 – начальная концентрация субстрата.
211
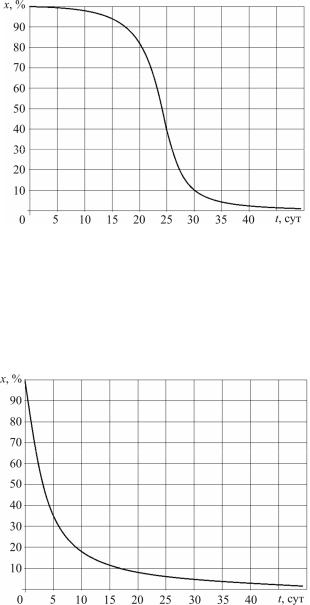
Пример экстенсивного процесса биодеструкции приведен на рис. 2. Интегрируя, получаем
|
|
a |
|
|
х х е |
b |
|
t t |
. |
|
2 |
|
||
0 |
|
|
|
|
Параметры кинетического уравнения а и b определяются на основании экспериментальных данных по процессу [8].
Рис. 2. Экстенсивный процесс биологической деструкции
Экстенсивный процесс характеризуется слабым уменьшением концентрации утилизируемого лекарственного средства в начальный период из-за адаптации актинобактерий в культуральной жидкости. Затем скорость процесса нарастаетсдальнейшимуменьшениемдонуля.
Для интенсивных процессов: а = 0, т.е. [7]. На рис. 3 отражен вариант прохождения интенсивного процесса.
Рис. 3. Интенсивный процесс биологической деструкции
212
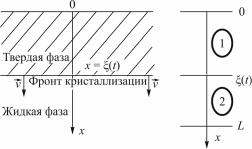
Интенсивные процессы характеризуются максимальной скоростью в начале биодеструкции с постепенным уменьшением до нуля.
Краевая задача, связанная с кинетическим уравнением. Краевая зада-
ча может определять параметры кинетического уравнения, и наоборот, параметры кинетического уравнения могут определять параметры краевой задачи, в частности граничные условия.
Рассмотрим связь краевой задачи с кинетическим уравнением на примере задачи Стефана. Фазовый переход может быть связан с кристаллизацией жидкости при ее охлаждении. В этом случае задачу обычно называют задачей о промерзании, имея в виду, что процесс замерзания воды при ее охлаждении относится кпроцессам такого класса. Рассмотрим постановку этой задачи, представленнуюМартисономиМаловым[10]. Расчетнаясхемаприведенанарис. 4.
. |
|
|
Теплота |
фазового |
перехода, |
||||
|
|
|
выделяющая |
при |
кристаллизации |
||||
|
|
|
жидкости, отводится вследствие те- |
||||||
|
|
|
плопроводности твердой фазы через |
||||||
|
|
|
граничнуюповерхностьx = 0 [10]. |
||||||
|
|
|
Явно |
|
выделяя |
движущийся |
|||
|
|
|
фронт кристаллизации, |
обозначим |
|||||
|
|
|
индексом1 |
величины, относящиеся |
|||||
|
|
|
к твердой |
фазе, |
а |
индексом 2 – |
|||
|
|
|
к жидкой фазе. Считая, что свойства |
||||||
Рис. 4. Область решения задачи |
среды при фазовом переходе изме- |
||||||||
няются скачком, запишем уравнение |
|||||||||
|
|
|
|||||||
|
|
|
теплопроводностидлядвухфаз: |
||||||
u |
a2 |
2u |
, t 0, 0 x t , |
|
|
|
(3) |
||
1 |
1 |
|
|
|
|||||
t |
1 |
x2 |
|
|
|
|
|
|
|
u2 |
a2 |
2u2 |
, t 0, t x , |
|
|
|
(4) |
||
t |
2 |
x2 |
|
|
|
|
|
|
|
где a12 и a22 – коэффициенты температуропроводности твердой и жидкой фаз
соответственно.
Учитывая, что в начальный момент времени существует только жидкая фаза, начальное условие для задачи запишем в виде
u2 x,0 u0 const, x 0. |
(5) |
Краевые условия задачи сформулируем следующим образом: |
|
‒ на границах области |
|
u1 uc const < 0 при х 0, |
(6) |
|
213 |

u2 u0 const 0 при х ; |
(7) |
||||||||||||
‒ на фронте фазового перехода |
|
|
|
|
|
|
|||||||
|
|
|
u1 |
|
x 0 |
u2 |
|
x 0 |
0, |
|
(8) |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
k |
u1 |
|
|
|
k |
u2 |
|
|
|
q* |
, |
||
|
|
|
|
|
|
||||||||
1 |
x |
|
x 0 |
2 x |
|
|
x 0 |
1 |
t |
|
|||
|
|
|
|
|
|||||||||
где q* – скрытая теплота кристаллизации, отнесенная к единице массы твердой фазы [10].
С помощью автомодельной переменной xt (преобразование Больцма-
на) приведем уравнения (3) и (4) к обыкновенным дифференциальным уравне-
ниямдляфункции u1 |
и u2 |
: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
1 |
|
du |
|
|
a2 |
d2u |
0, i 1,2. |
|
|
|
(9) |
|||||||
|
|
|
|
|
|
2 |
|
|
i |
|
|
i |
|
|
|
|||||||||
|
|
|
|
|
|
|
d |
|
|
i |
d 2 |
|
|
|
|
|
|
|
|
|||||
Полагая w |
dui |
, запишем уравнение (9) в виде |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
i |
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
1 |
|
dwi |
|
1 |
. |
|
|
|
|
(10) |
||||||
|
|
|
|
|
|
|
|
|
w |
|
2a2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
i |
|
|
|
|
|
|
Интегрируя выражение (10), получаем |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
w |
B |
|
exp |
|
2 |
, |
B |
const. |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
i |
|
|
|
i |
|
|
|
|
4a |
2 |
i |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
||
Интегрируя (1) еще один раз, находим общее решение уравнений (9) для |
||||||||||||||||||||||||
i = 1 и i = 2: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||
|
|
ui Ai Bi exp |
|
d Ai BiФ |
|
|
|
, |
||||||||||||||||
4a2 |
|
2а |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
i |
|
|
|
|
i |
|
|||
где Ф z |
2 |
z |
e 2 d , Ai , |
Bi const. |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Функцию Ф z erf z называют интегралом ошибок (функцией ошибок) [10]. Она часто встречается в задачах математической физики и поэтому затабулирована, как и ее производные и интеграл от нее.
Возвращаясь к переменным x и t, запишем найденные решения уравнений (3) и (4) в виде
214
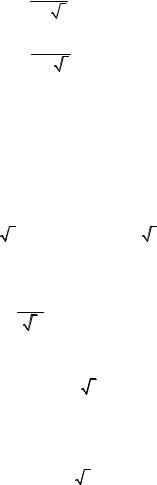
u1 x,t A1 u2 x,t A2
B1Ф
B2Ф
х , t 0, 0 x t , 2а1 t
х , t 0, t x . 2а2 t
Выполняя далее граничные условия (6) и (7), находим
A1 uc , A2 B2 u0 ,
гдеис – температуратвердойфазы; и0 – температуражидкойфазы.
Приэтомзамечаем, чтоначальноеусловие(4) такжебудетвыполнено[8]. Изусловия(8) нафронтефазовогоперехода, т.е. при x t , следует, что
|
t |
|
|
|
|
t |
|
|
|
|||
A1 |
B1Ф |
|
|
|
0, |
A2 |
B2 |
Ф |
|
|
|
0. |
2a1 |
|
2a2 |
|
|||||||||
|
|
t |
|
|
|
|
t |
|
||||
Каждое из этих уравнений может быть выполнено для любого t > 0 только в этом случае, если аргументы функции Ф(z) в этих равенствах не зависят
от времени. Это возможно, если tt const.
Врезультатерешенияможноопределитьдвижениефронтакристаллизации, гдехопределяетположениефронта:
x t t.
Для определения скорости движения фронта эта задача решена. В результатекинетическаязависимостьимеетвид
v d |
|
|
. |
|
2 t |
||||
dt |
|
|
Скорость уменьшается со временем, т.е. по мере утолщения слоя твердой фазы [10].
На основе численного решения и его аппроксимации для фронта получен параметр 4,035 м/с0,5 для условия данной задачи.
Оказалось, что если знать заранее кинетическое уравнение, то задача решается намного проще. В этом случае отсутствует внутренняя процедура итерации. Таким образом, использование кинетического уравнения в краевой задаче позволяет элегантнее и точнее решить задачу о фронте затвердевания.
При эксперименте по биологической деструкции лекарственного средства условия перемешивания в колбе практически одинаковы по объему культуральной жидкости, поэтому кинетическое уравнение для концентрации лекарственного средства связано с гидродинамикой жидкости в колбе одним параметром – интенсивностью перемешивания, от которого зависит скорость
215
биологической деструкции. В промышленных условиях определенный объем культуральной жидкости переходит из областей высокой интенсивности перемешивания в области низкой интенсивности и наоборот. Для перехода от анализа биодеструкции в лабораторных условиях к биодеструкции в промышленных условиях необходимо кинетику биодеструкции в переменных условиях связать с движением жидкости.
Биологическая деструкция в промышленных условиях. Для реализа-
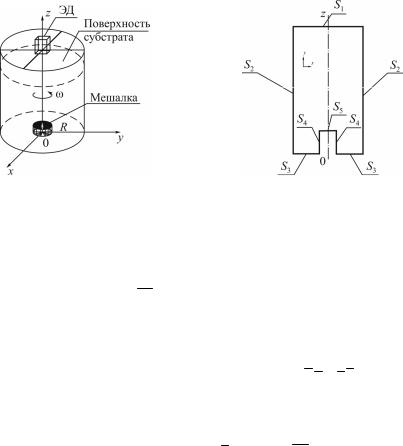
ции процесса биодеструкции с актинобактериями рода Rhodococcus в промышленных условиях была построена расчетная область биореактора с заданными геометрическими характеристиками (рис. 5). Поверхность емкости с культуральной жидкостью закрывается крышкой, над которой находится электродвигатель малой мощности. Электродвигатель ЭД вращает мешалку, и тем самым перемешивается вся культуральная жидкость.
Для решения этой задачи использована схема с границами (рис. 6).
Рис. 5. Расчетная область биореактора |
Рис. 6. Схема границ биореактора |
Для определения поля скоростей в биореакторе необходимо поставить задачу течения жидкости. Для этого воспользуемся уравнениями гидродина-
мики [12]:
‒уравнение движения vt v v 1 gradp v;
‒определяющее соотношение рI ;
‒уравнение несжимаемости divv 0;
‒геометрическое соотношение Коши 12 12 u u .
Граничные условия имеют вид (см. рис. 6):
‒ на свободной поверхности S1: n p, pi 0, i x, y, z;
ˆ
‒ на боковой поверхности S1: n T , vi 0, i 1,3;
216
‒ |
на дне S3 : vi 0, i |
1,3; |
|
|
|
|
|
|
|
|
|
‒ |
на боковой поверхности мешалки S4: vz |
0, vr |
0, |
v vˆ; |
|||||||
‒ |
на торце мешалки S5: v |
|
0, v 0, |
v |
|
vˆ |
r, |
|
|
||
z |
|
|
|
|
|||||||
|
|
|
|
r |
|
|
Rм |
|
|
||
|
|
|
|
|
|
|
|
|
|
||
где vˆ |
– окружная скорость на поверхности мешалки; |
Rм |
– радиус мешалки; |
||||||||
r – текущий радиус на торце мешалки. |
|
|
|
|
|
|
|||||
Пока не определена связь между кинетическим уравнением (2) и краевой задачей. Эта связь должна быть заложена в зависимость k(v) и k(w), в частности от gradv в поперечном направлении к линиям тока.
Реализации биодеструкции в лабораторных условиях при эксперименте на повторяемость идут по различным траекториям, т.е. процесс биодеструкции представляет собой случайный процесс. Следовательно, говорить о промышленной биодеструкции необходимо с учетом стохастического анализа.
Таким образом, необходимо проведение специальной серии экспериментов по влиянию на биодеструкцию скорости перемешивания, а также на повторяемость биодеструкции в лабораторных условиях. Исследовалась кинетика биодеструкции при изменении скорости. В кинетическом уравнении должна быть заложена зависимость k от интенсивности перемешивания ω. Это является первым аспектом.
Вторым аспектом является случайность процесса. Необходимо оценить с позиции теории вероятности гарантию утилизации в биореакторе с заданной вероятностью.
В таблице приведены результаты 12 опытов на повторяемость биологической деструкции дротаверина гидрохлорида, проведенных в Институте экологии и генетики микроорганизмов УрО РАН. В начальный момент (0 сут) концентрация во всех случаях составляет 100 %.
Повторяемость биологической деструкции дротаверина гидрохлорида (эксперимент от 14.02.14 г.)
Номер опыта |
5 сут |
10 сут |
k1(0; 5), |
k2(0; 10), |
kср, |
|
|
|
сут–1 |
сут–1 |
сут–1 |
1 |
39,46 |
8,24 |
0,19 |
0,25 |
0,22 |
2 |
43,14 |
5,49 |
0,17 |
0,29 |
0,23 |
3 |
35,82 |
9,89 |
0,21 |
0,23 |
0,22 |
4 |
40,21 |
10,99 |
0,18 |
0,22 |
0,20 |
5 |
42,53 |
3,30 |
0,17 |
0,34 |
0,26 |
6 |
58,51 |
11,54 |
0,12 |
0,22 |
0,16 |
7 |
33,25 |
10,44 |
0,22 |
0,23 |
0,22 |
8 |
21,39 |
1,10 |
0,31 |
0,45 |
0,38 |
9 |
64,18 |
5,49 |
0,09 |
0,29 |
0,19 |
10 |
50,20 |
≈ 0 |
0,14 |
∞ |
– |
11 |
83,51 |
2,25 |
0,04 |
0,38 |
0,21 |
12 |
80,41 |
5,49 |
0,04 |
0,29 |
0,17 |
217
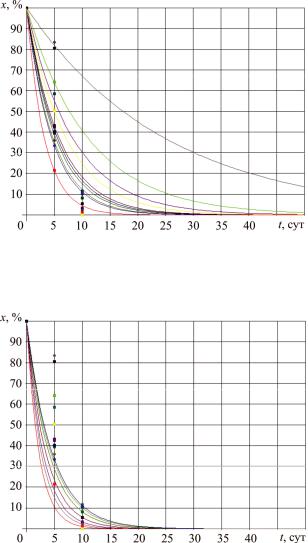
В ходе эксперимента показания снимались на 5-е и 10-е сутки. Для этих показаний рассчитаны константы реакций, с помощью различной методики.
На рис. 7‒9 приведены кинетические кривые биологической деструкции дротаверина гидрохлорида, полученные в эксперименте на повторяемость с различными коэффициентами в кинетическом уравнении (2).
Рис. 7. Процесс биологической деструкции дротаверина гидрохлорида: х x0 e k1t , кинетические кривые с коэффициентом k1, определенным по данным на 5-е сутки эксперимента
Рис. 8. Процесс биологической деструкции дротаверина гидрохлорида: х x0 e k2t , кинетические кривые с коэффициентом k2, определенным по данным на 10-е сутки эксперимента
218

На рис. 9 приведены кинетические кривые по усредненным коэффициентам на 5-е и 10-е сутки эксперимента (см. таблицу).
Все кинетические кривые относятся к интенсивным процессам, которые характеризуются максимальной скоростью в начале процесса с постепенным уменьшением до нуля. При большем значении k биодеструкция идет быстрее. Кривые на рис. 9 дают наиболее адекватную эксперименту картину развития процесса биологической деструкции в сравнении с кривыми рис. 7, 8, т.е. следуетиспользоватьусредненноезначениеkср параметракинетическогоуравнения.
Рис. 9. Процесс биологической деструкции дротаверина гидрохлорида: х x0 e k1t
Сделаем следующие выводы:
1. Поставлена связанная с кинетическим уравнением биологической деструкции краевая задача утилизации лекарственных средств в биореакторе.
2. Применение кинетического уравнения в совместной постановке с краевой задачей позволяет получить новый подход к решению (затвердевание жидкости) или более полную информацию о процессе (среднеинтегральная остаточная концентрация лекарственных средств в биореакторе в зависимости от времени процесса).
3. Произведен анализ кинетики биологической деструкции дротаверина гидрохлорида в эксперименте на повторяемость в лабораторных условиях. Исследованавыборкаиз12 реализаций, пригоднаядлястохастическогоанализа.
Список литературы
1. Селянинов А.А. Класс кинетически моделируемых биомеханических случайных процессов // Российский журнал биомеханики. – 2012. – Т. 16, № 4. –
С. 22–35.
219
2.Кучумов А.Г. Математическое моделирование и биомеханический подход к описанию развития, диагностики и лечения онкологических заболеваний // Российскийжурналбиомеханики. – 2010. – Т. 14, №4. – С. 42–69.
3.Селянинов А.А., Вихарева Е.В. Кинетика биодеструкции лекарственных средств – производных фенола, изохинолина и карбоновых кислот // Российский журналбиомеханики. – 2010. – Т. 14, №2. – С. 79–91.
4.Новоженов В.А. Введение в неорганическую химию: учеб. пособие. Барнаул: Изд-во Алтайск. ун-та, 2001. – 650 с.
5.Березин И.В., Клесов А.А. Практический курс химической и ферментативнойкинетики. – М.: Изд-воМоск. ун-та, 1976. – 320 с.
6.Кабанова Л.Ф. Кинетика химических реакций: метод. указ. для лабо- рат.-практ. занятий и самостоятельной работы. – Новосибирск: Изд-во СГУПС, 2007. – 38 с.
7.Кинетическая схема процесса биодеструкции парацетамола с истекшим сроком годности / Е.В. Вихарева, А.А. Селянинов, Ю.И. Няшин, И.Б. Ившина // Российскийжурналбиомеханики. – 2006. – Т. 10, №3. – С. 72–79.
8.Вихарева Е.В. Научно-методологический подход к утилизации фармацевтических отходов на основе биотехнологий и математического моделирования // Российский журнал биомеханики. – 2008. – Т. 12, № 3. – С. 15–23.
9.Математическая модель процесса биодеструкции парацетамола как открытой системы / Е.В. Вихарева, А.А. Селянинов, Ю.Л. Данилов, И.П. Рудакова, Т.А. Нечеухина, И.Б. Ившина, Ю.И. Няшин // Российский журнал биомеханики. – 2008. – Т. 12, № 2. – С. 41–54.
10.Мартинсон Л.К, Малов Ю.И. Дифференциальные уравнения математической физики. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2002. – 368 с.
11.Седов Л.И. Механика сплошной среды: в 2 т. – 6-е изд., стер. –
СПб.: Лань, 2004. – Т. 1. – 528 с.
Получено 1.09.2014
Петрова Светлана Александровна – магистрант, ПНИПУ, ФПММ,
гр. БМ-13-1м, e-mail: svetlana_bm@bk.ru.
Селянинов Александр Анатольевич – доктор технических наук, про-
фессор, ПНИПУ, ФПММ, e-mail: Prof.Selyaninov@yandex.ru.
220
