
Энерготехнология химических производств
..pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермский национальный исследовательский политехнический университет»
Д.В. Саулин
ЭНЕРГОТЕХНОЛОГИЯ ХИМИЧЕСКИХ ПРОИЗВОДСТВ
Утверждено Редакционно-издательским советом университета
в качестве конспекта лекций
Издательство Пермского национального исследовательского
политехнического университета
2016
УДК 536; 621.1; 662.6; 662.9 ББК 31.3
С12
Рецензенты:
канд. хим. наук, доцент Н.П. Углев (Пермский национальный исследовательский политехнический университет);
канд. техн. наук И.С. Пузанов (ООО «Пеноситал»)
Саулин, Д.В.
С12 Энерготехнология химических производств : конспект лекций / Д.В. Саулин. – Пермь : Изд-во Перм. нац. исслед. политехн.
ун-та, 2016. – 150 с.
ISBN 978-5-398-01536-2
Изложены основы технической термодинамики, приведены сведения по теории горения топлив, конструкциям сжигающих устройств, расчету материальных и тепловых балансов, экологическим проблемам сжигания топлив и их решению, оптимизации процессов, связанных с выработкой, потреблением и передачей тепла, а также задания для проведения индивидуальных расчетных работ, позволяющие закрепить знания, полученные при прослушивании лекционного материала.
Предназначено для студентов химико-технологических специальностей, изучающих курсы «Энерготехнология химических производств» и «Техническая термодинамика», преподаваемые в Пермском национальном исследовательском политехническом университете (ПНИПУ).
УДК 536; 621.1; 662.6; 662.9 ББК 31.3
ISBN 978-5-398-01536-2 |
© ПНИПУ, 2016 |
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ ...................................................................................................... |
4 |
1. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА...................................................................... |
6 |
1.1. Основные понятия и определения............................................................... |
6 |
1.2. Первый закон термодинамики.................................................................... |
10 |
1.3. Первый закон термодинамики для закрытой системы............................. |
13 |
1.4. Энтальпия..................................................................................................... |
17 |
1.5. Энтропия....................................................................................................... |
19 |
1.6. Теплоемкость............................................................................................... |
21 |
1.7. Термодинамические процессы в идеальном газе .................................... |
24 |
1.8. Термодинамические процессы с учетом фазовых переходов................. |
31 |
1.9. Термодинамические циклы с учетом фазовых переходов ...................... |
37 |
1.10. Эксергия. Использование низкопотенциальных источников тепла......... |
42 |
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ СЖИГАНИЯ ТОПЛИВА...................................... |
48 |
2.1. Топливо......................................................................................................... |
48 |
2.2. Материальный баланс горения топлива.................................................... |
51 |
2.3. Теплота сгорания топлива.......................................................................... |
56 |
2.4. Энтальпия, теплота и температура газового потока................................ |
58 |
2.5. Тепловой баланс энерготехнологического агрегата................................. |
60 |
2.6. Особенности сжигания газового топлива.................................................. |
65 |
2.7. Горелки для сжигания газового топлива и газофазных отходов............. |
70 |
2.8. Особенности сжигания жидкого топлива................................................... |
76 |
2.9. Горелки для сжигания жидкого топлива и жидких отходов...................... |
78 |
2.10. Особенности сжигания твердого топлива ............................................... |
81 |
2.11. Горелки и топки для сжигания твердого топлива.................................... |
84 |
3. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ СЖИГАНИЯ ТОПЛИВА................................. |
90 |
3.1. Методы подавления образования оксидов азота при сжигании |
|
топлива. Методы очистки газовых выбросов от оксидов азота. .............. |
93 |
3.2. Методы очистки газовых выбросов от оксида серы ............................... |
101 |
3.2.1. «Мокрые» способы очистки............................................................. |
101 |
3.2.2. «Сухие» способы очистки................................................................ |
106 |
3.3. Комплексная система очистки дымовых газов........................................ |
110 |
4. ЭНЕРГОТЕХНОЛОГИЧЕСКИЕ АГРЕГАТЫ....................................................... |
112 |
4.1. Котлы и вспомогательное оборудование: особенности |
|
конструкции и работы............................................................................... |
114 |
4.2. Паровые и газовые турбины..................................................................... |
126 |
4.2.1. Активные турбины паросиловых установок................................... |
129 |
4.2.2. Газотурбинные установки................................................................ |
135 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ................................................. |
138 |
ПРИЛОЖЕНИЯ.................................................................................................. |
139 |
3
ВВЕДЕНИЕ
Хорошо известно, что химическая промышленность является достаточно энергоемкой отраслью экономики. В ценовом выражении энергия может составлять до 60 % себестоимости химической продукции. Из всех отраслей экономики на долю химической промышленности приходится более 5 % потребляемой электроэнергии и более 6 % тепла. Кроме того, существуют технологии, которые используют значительную часть сырья на энергетические нужды. Наиболее яркими примерами могут быть агрегаты парового риформинга, технологии производства аммиака или метанола, которые вырабатываются из природного газа, воздуха и воды, а тепло, необходимое для протекания эндотермической реакции взаимодействия природного газа с водяным паром, получают за счет сжигания самого природного газа. Согласно регламентным данным для этих технологий количество природного газа, используемого в качестве топлива, на 15–25 % выше, чем количество природного газа, подаваемого в виде сырья. Аналогичные примеры химических технологий есть и в нефтепереработке, нефтехимии, органическом синтезе и т.п. Таким образом, в связи с тем что энергоносители составляют существенную часть в себестоимости продукции большинства химических производств, одним из основных направлений модернизации существующих технологий является снижение их энергоемкости.
В настоящее время на мировом рынке технологий многие инжиниринговые фирмы представляют различные варианты модернизации производств, которые позволяют экономить различное количество энергии. Как правило, производство после такой реконструкции требует более жесткой технологической дисциплины. Кроме того, немаловажным становится оперативное управление технологией, которое позволит избежать излишних затрат сырья и энергии.
Естественно, это приводит к тому, что повышенные требования начинают предъявляться к качеству инженерной подготовки технологических кадров, которые в будущем будут управлять производством и проводить его модернизацию. В связи с этим, наряду с общей химической технологией, процессами и аппаратами химической технологии, экономикой и другими науками, энерготехнология – об-
щеинженерная дисциплина, изучающая методы получения, преобразования, передачи и использования энергии и связанные с этим
4
аппараты и устройства, – приобретает все большее значение в цикле общеинженерных дисциплин.
Цель преподавания дисциплины «Энерготехнология» – изучение принципов и методов получения, преобразования, передачи и использования энергии и связанных с этим аппаратов и устройств, а также принципов термодинамического анализа и его применения при изучении работы химико-технологических и энерготехнологических аппаратов и схем различной степени сложности.
Данная дисциплина преподается студентами старших курсов химико-технологических специальностей, так как требует наличия знаний по следующим предметам:
–общая и неорганическая химия (строение вещества, природа химических связей, межмолекулярные взаимодействия);
–физика (молекулярно-кинетическая теория газов, теория жидкого и твердого состояния, циклы в идеальном газе);
–физическая химия (весь курс);
–процессы и аппараты химической технологии (весь курс);
–общая химическая технология (весь курс).
5
1. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
1.1. Основные понятия и определения
Энергией называется общая мера различных форм движения материи, которые способны превращаться друг в друга. Термодинамика – это наука об энергии и ее свойствах. Она изучает законы превращения энергии в различных процессах, проходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Если применить понятие «макроскопические системы» к технологическим системам, то тогда следует говорить о технической термодинамике, которая изучает закономерности взаимного превращения теплоты и работы, а также свойства тел, участвующих в этом превращении, и процессов, протекающих в различных аппаратах и технологических машинах.
В изучаемых ранее курсах физики и физической химии было показано, что теплота и работа являются двумя формами передачи энергии от одного тела к другому. Мерой энергии, передаваемой этими двумя эквивалентными формами передачи энергии, в системе СИ является джоуль. Однако в большинстве химических технологий часто приходится иметь дело не с массой вещества (кг или м3), а с его потоком или расходом (кг/с или м3/с), который несет с собой некое количество энергии и может за ее счет совершить некоторую работу. Поэтому в технологии большую роль играет не теплота и работа, а количество джоулей передаваемой теплоты или количество джоулей совершаемой работы в единицу времени (Дж/с, или ватт), т.е. поток энергии, или мощность. Обмен энергией в форме теплоты или работы может осуществляться только между термодинамическими системами.
Существуют следующие типы термодинамических систем:
–открытые, которые обмениваются веществом с другими системами (рис. 1.1, б);
–закрытые, у них обмен веществом с другими системами отсутствует (рис. 1.1, а);
–изолированные (замкнутые), не обменивающиеся с другими системами ни веществом, ни энергией;
–адиабатные, у которых отсутствует теплообмен с другими системами (бывают открытые и закрытые).
6

а |
б |
Рис. 1.1. Примеры термодинамических систем: а – закрытой; б – открытой
Состояние рабочего тела или системы характеризуется величи-
нами, которые называются термодинамическими параметрами со-
стояния. Основными термодинамическими параметрами состояния, которые наиболее широко используются в технической термодинамике, являются:
–температура T, К;
–давление P, Па;
–удельный объем v, м3/кг;
–внутренняя энергия U, Дж;
–энтальпия Н, Дж;
–энтропия S, Дж/К.
Различают интенсивные и экстенсивные параметры состояния. К интенсивным параметрам состояния относят те, величина которых не зависит от размера термодинамической системы, а к экстенсивным – параметры состояния, величина которых зависит от размеров термодинамической системы. Например, температура и давление являются интенсивными параметрами состояния, а внутренняя энергия термодинамической системы или ее энтальпия – экстенсивными. Необходимо отметить, что удельные величины экстенсивных параметров состояния являются уже интенсивными, например удельная внутренняя энергия (u = U/n, Дж/моль) или удельная энтальпия (h = Н/n, Дж/моль). В связи с этим при описании термодинамических процессов обычно используют интенсивные параметры состояния.
В упрощенном виде, достаточном для термодинамического анализа большинства технологических систем, состояние рабочего тела может быть однозначно определено тремя параметрами состояния. В данном случае, если заданы любые два термодинамиче-
7
ских параметра, то любой третий параметр состояния системы может быть однозначно определен:
v = f1 ( p,T ); T = f2 ( p,v ); p = fN (v,T ).
Наиболее широко используемое уравнение, которое связывает три основных параметра состояния (T, p и v), называется уравнением Менделеева–Клапейрона, или уравнением состояния идеального газа:
|
pV |
|
p V |
|
||
1 1 |
= |
|
2 2 |
= R = const, |
(1.1) |
|
|
T1 |
|
|
|||
|
|
|
T2 |
|
||
которое для 1 кг рабочего тела можно записать так: |
|
|||||
pv = RT |
или p = ρRT, |
(1.2) |
||||
а для 1 кмоля рабочего тела – |
|
|
|
|||
|
|
|
pvμ = RμT, |
(1.3) |
||
где Rμ = 8,314 кДж/(кмоль К); vμ – молярный объем идеального газа при стандартных термодинамических условиях (vμ = 22,4 м3/кмоль).
Следует немного сказать о стандартных условиях, т.е. об условностях, которые широко применяются в промышленности. Так, наиболее распространены следующие стандартные условия:
– термодинамические или физические стандартные условия
(STP – standard temperature and pressure) по ISO, параметры кото-
рых совпадают с тройной точкой воды: давление 760 мм рт. ст., или 101,325 кПа, и температура 0 °С, или 273,15 К; при этих параметрах объем 1 моля газа равен 22,414 л;
–стандартные условия (STP) по IUPAC: давление 100,325 кПа
(0,9869 атм, или 1 бар) и температура 0 °С, или 273,15 К;
–стандартные условия в газовом хозяйстве РФ: 760 мм рт. ст.,
или 101,325 кПа, и температура 20 °С, или 293,15 К;
– стандартные условия в справочниках термодинамических величин: давление 100 кПа, или 1 бар, и температура 298 К.
Таким образом, стандартные условия, которые применяются в различных отраслях промышленности разных стран мира, могут отличаться друг от друга, поэтому, как правило, эти условия приводятся в технологическом регламенте, проекте производства или на рабочих чертежах, что необходимо учитывать при проведении инженерных расчетов.
8
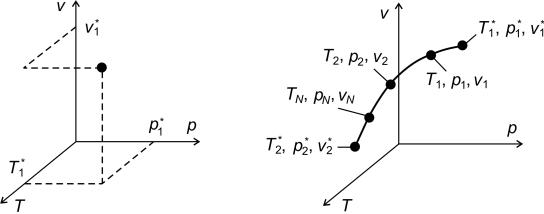
В общем виде состояние термодинамической системы, находящейся в равновесии при заданных параметрах состояния p1*, v1*, T1*, можно изобразить в виде точки (рис. 1.2).
Однако при подводе или отводе энергии от равновесной термодинамической системы параметры ее состояния изменятся, и она займет новое положение с координатами p2*, v2*, T2*, т.е. произойдет термодинамический процесс (рис. 1.3).
Рис. 1.2. Термодинамическое |
Рис. 1.3. Равновесный |
состояние системы |
термодинамический процесс |
Термодинамические процессы бывают обратимыми и необратимыми. Обратимый процесс допускает возвращение рабочего тела или системы в первоначальное состояние без каких-либо изменений в окружающих термодинамических системах, а необратимый этого не допускает по причине взаимодействия рабочего тела с другими термодинамическими системами, например по причине отдачи или получения от них энергии.
Как известно, существуют также равновесные и неравновесные термодинамические процессы. Равновесный процесс – это бесконечно медленный процесс, в ходе которого система всегда находится в состоянии термодинамического равновесия, т.е. скорость достижения системой состояния термодинамического равновесия много выше, чем скорость изменения ее параметров (например, медленное сжатие газа в цилиндре поршнем, при котором давление газа по объему будет устанавливаться быстрее, чем скорость перемещения поршня). Таким образом, при проведении равновесного процесса система будет проходить через множество промежуточных равно-
весных «точек» (p1, v1, T1), (p2, v2, T2), (pN, vN, TN), которые будут образовывать линию равновесного термодинамического процесса
9
(см. рис. 1.3). Таким образом, только равновесный термодинамический процесс можно изобразить в термодинамических коорди-
натах. К неравновесным процессам обычно относят реальные процессы, в ходе которых равновесное состояние термодинамической системы не достигается, т.е. параметр изменяется быстрее, чем термодинамическая система достигает состояния равновесия.
Следует отметить, что все реальные процессы являются неравновесными и необратимыми, а рассмотрение их как равновесных и обратимых является необходимой для проведения их анализа идеализацией физической ситуации.
Другим допущением, встречающимся при рассмотрении термодинамических процессов, является понятие «идеальный газ», в котором молекулы газа представляют собой бесконечно малые материальные точки, имеющие только кинетическую энергию и не взаимодействующие между собой. Реальные газы отличаются от идеальных, поэтому для численного определения величины данного отличия вводят параметр, называемый коэффициентом сжимаемости. Использование данного параметра в термодинамических расчетах позволяет более точно рассчитать свойства реальных газов и их изменения в термодинамических процессах.
Для идеального газа коэффициент сжимаемости:
z = |
pv |
= 1. |
(1.4) |
|
|||
|
RT |
|
|
Для реальных газов коэффициент сжимаемости является функцией температуры и давления, и его значение, как правило, меньше единицы, за исключением области очень высоких температур и давлений.
1.2. Первый закон термодинамики
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии и представляет собой приложение этого фундаментального закона к термодинамическим системам.
Закон сохранения энергии гласит, что сумма всех видов энергии изолированной системы есть величина постоянная:
Ei = const, |
(1.5) |
dEi = 0, |
(1.6) |
где Ei – означает i-й вид энергии.
10
