
Энерготехнология химических производств
..pdfВ отличие от твердых, жидкие топлива являются продуктами переработки нефти при температуре до 300–370 °С. Сначала из нефти выделяется около 1 % сжиженного газа, а затем остаток разделяют на бензиновую, керосиновую и дизельную фракции. Жидкий остаток с температурой кипения более 350–370 °С называется мазутом, который может использоваться как топливо, а может перерабатываться далее. Обычно глубина переработки нефти определяется техническими и экономическими параметрами. Состав мазута сильно зависит от состава нефти, однако в среднем он следующий:
СР = 84–86 % масс., НР = 10–12 % масс., SР = 0,5–4,5 % масс., АР = 0,1–0,2 % масс., W Р < 1,5 % масс.
Газовое топливо бывает ископаемым и искусственным:
–природный газ (в основном CH4);
–попутный газ, получаемый при добыче нефти (меньше CH4
ибольше высших углеводородов);
–сжиженный газ, получаемый при переработке нефти (используется для бытовых целей в составе 50 % пропана и 50 % бутана,
азимой − 75 и 25 % соответственно);
–коксовый и доменный газы, содержащие как углеводороды,
так и СО и Н2;
– биогаз, получаемый при брожении органического топлива, и др.
2.2. Материальный баланс горения топлива
Как было сказано ранее, каким бы сложным ни был состав углеводородного топлива, при его полном сгорании углерод окисляется до CO2, водород – до H2O, а сера – до SO2 по следующим уравнениям реакций:
H2 + 0,5O2 = H2O, C + O2 = CO2,
S + O2 = SO2.
Полное сгорание подразумевает, что кислорода воздуха должно хватить для протекания этих реакций, поэтому для заданного рабочего состава топлива можно легко рассчитать теоретически необходимое для полного сгорания топлива количество кислорода и соответствующий объем воздуха Vвозд0 , нм3/кг:
V 0 |
= 0,033(2,67CР + 8HР + SР |
− OР ), |
(2.1) |
возд |
сум |
|
|
51
а также объемы образовавшихся продуктов сгорания: CO2, SO2 и
H2O (в нм3/кг):
VCO |
= 0,01867CР, |
(2.2) |
|
2 |
|
VSO2 |
= 0,00700SРсум, |
(2.3) |
VH O = 0,1118HР + 0,0124W Р. |
(2.4) |
|
2 |
|
|
Сумма образовавшегося объема углекислого и сернистого газов называется объемом сухих трехатомных продуктов сгорания:
VRO2 = VCO2 + VSO2 . |
(2.5) |
Быстро и равномерно смешать поток воздуха с потоком топлива практически невозможно, поэтому в топку приходится подавать большее количество воздуха, чем необходимо по стехиометрии. Отношение количества воздуха, действительно подаваемого в топку
(V |
возд |
), к теоретически необходимому количеству (V 0 |
) называется |
||
|
|
|
возд |
|
|
коэффициентом избытка воздуха: |
|
||||
|
|
α = |
Vвозд |
. |
(2.6) |
|
|
|
|||
|
|
|
V 0 |
|
|
|
|
|
возд |
|
|
При нормальной организации топочного процесса всегда α > 1, причем чем совершеннее топка и лучше происходит перемешивание топлива и воздуха в горелочном устройстве, тем меньше необходимо подавать избыточного воздуха. Как правило, для хороших горелочных устройств α ≈ 1,03–1,10, а для плохих α ≈ 1,30–1,50 и более.
Так как в топку подается большее количество воздуха, чем необходимо по стехиометрии, часть поданного воздуха в процессе горения не участвует, а транзитом проходит через топку, увеличивая тем самым объем дымовых газов и унося тепло. При стехиометрическом сжигании удельный объем дымовых газов (в нм3/кг) равен сумме объемов продуктов горения и объему инертов воздуха (азота, аргона и т.п.):
Vг = VRO2 + VH2O + Vинерт0 = VRO2 + VH2O + 0,79Vвозд0 . |
(2.7) |
52
Удельный объем дымовых газов с учетом избытка подаваемого воздуха (с учетом количества инертов и избыточного кислорода) рассчитывается по формуле
V = V |
+ V |
+ 0,79αV 0 |
+ 0,21(α− 1) V 0 |
, |
(2.8) |
||
г |
RO2 |
H2O |
возд |
возд |
|
|
|
где 0,79αV 0 |
– удельный объем инертов воздуха; 0,21(α − 1)V 0 |
– |
|||||
возд |
|
|
|
|
|
возд |
|
удельный объем избыточного кислорода.
При известном количестве сжигаемого топлива (Gтопл, кг/ч) расход дымовых газов (Gг, нм3/ч) и необходимый расход воздуха (Gвозд, нм3/ч) можно рассчитать по формулам
Gвозд = GтоплVвозд, |
(2.9) |
Gг = GтоплVг. |
(2.10) |
При известных объемах продуктов сгорания легко рассчитать состав дымовых газов (в % об.), состоящих из смеси СО2, Н2О, N2,
O2 и SO2:
|
|
|
|
|
|
VCO |
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
СО2 |
= 100 |
|
|
|
|
|
, |
|
|
|
|
(2.11) |
|||||
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2О = 100 |
VH2O |
|
|
, |
|
|
|
|
(2.12) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SО2 |
= 100 |
VSO2 |
|
, |
|
|
|
|
(2.13) |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,21(α − 1)V 0 |
|
|
0,21(Vвозд |
− Vвозд0 ) |
|
|||||||||||||
О2 |
= 100 |
|
|
возд |
= 100 |
|
|
|
|
|
|
. |
(2.14) |
|||||||
|
Vг |
|
|
|
|
Vг |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Содержание в воздухе инертных газов (аргона и др.) можно ус- |
||||||||||||||||||||
ловно суммировать с концентрацией азота, тогда: |
|
|
|
|
||||||||||||||||
|
|
|
0,79V |
|
|
|
|
|
|
|
0,79αV 0 |
|
|
|
|
|||||
|
N2 |
= 100 |
возд |
= 100 |
|
|
|
|
|
|
возд |
. |
(2.15) |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
Vг |
|
|
|
|
|
|
|
|
|
|
|
|
Vг |
|
|
|
|
Если топливо находится в газообразном виде, достаточно точно известен его молекулярный состав (в % об.), поэтому нет необходимости его пересчитывать на СР, НР, ОР и SP (% масс.), а можно производить расчет материального баланса через объемы индивиду-
53
альных веществ. В этом случае не нужно использовать приближенные формулы, так как при известном молекулярном составе топлива можно использовать точные зависимости.
В связи с тем что большинство газовых топлив в основном со-
стоит из СН4, С2Н6, С3Н8, С4Н10, Н2 и СО, то химизм процесса горения топлива можно описать следующими основными уравнениями
реакций (на одну молекулу газа из состава топлива): СН4 + 2О2 = СО2 + 2Н2О,
С2Н6 + 3,5О2 = 2СО2 + 3Н2О,
С3Н8 + 5О2 = 3СО2 + 4Н2О,
С4Н10 + 6,5О2 = 4СО2 + 5Н2О,
Н2 + 0,5О2 = Н2О, СО + 0,5О2 = СО2.
Рассмотрим порядок составления материального баланса на примере. Допустим, в топке при α = 1,3 полностью сжигается 1000 нм3/ч топлива с составом 94 % об. СН4, 1,5 % об. С2Н6, 0,5 % об. С3Н8,
3 % об. Н2, 1 % об. N2.
Таким образом, в топке сжигается 940 нм3/ч СН4, 15 нм3/ч С2Н6, 5 нм3/ч С3Н8, 30 нм3/ч Н2, 10 нм3/ч N2.
Следующую часть расчета материального баланса лучше производить табличным способом (табл. 2.1).
Таблица 2 . 1 Пример расчета материального баланса табличным способом
|
Расход |
Для горения |
При горении |
При горении |
||
Вещество |
топлива, |
необходимо О2, |
образуется СО2, |
образуется Н2О, |
||
|
нм3/ч |
нм3/ч |
нм3/ч |
|
нм3/ч |
|
СН4 |
940 |
2 · 940 = 1880 |
1 · 940 |
= |
940 |
2 · 940 = 1880 |
С2Н6 |
15 |
3,5 · 15 = 52,5 |
2 · 15 |
= |
30 |
3 · 15 = 45 |
С3Н8 |
5 |
5 · 5 = 25 |
3 · 5 = 15 |
4 · 5 = 20 |
||
Н2 |
30 |
0,5 · 30 = 15 |
– |
|
|
1 · 30 = 30 |
N2 |
10 |
– |
– |
|
|
– |
Σ |
1000 |
1972,5 |
985 |
|
1975 |
|
Таким образом, для стехиометрического сжигания 1000 нм3/ч топлива необходимо воздуха (принимается, что в воздухе содержится 21 % об. О2 и 79 % об. N2 с инертами, или 0,21 и 0,79 соответственно)
54
1972,5 нм3/ч О2, что соответствует 1972,5 / 0,21 = 9392,86 нм3/ч.
При α = 1,3 объем воздуха составит
9392,86 · 1,3 = 12 210,7 нм3/ч (2564,25 нм3/ч О2 и 9646,45 нм3/ч N2).
Тогда расчетный объем дымовых газов будет составлять:
♦СО2 – 985 нм3/ч;
♦Н2О – 1975 нм3/ч;
♦ N2: 10 нм3/ч (из топлива) + 9646,45 нм3/ч (из воздуха) =
=9656,45 нм3/ч;
♦О2: 2564,25 нм3/ч (с воздухом) – 1972,5 нм3/ч (на горение) =
=591,75 нм3/ч.
Σ равна 13 208,2 нм3/ч.
Расчетный состав дымовых газов:
♦СО2: 985 / 13 208,2 = 7,46 % об.;
♦Н2О: 1975 / 13 208,2 = 14,95 % об.;
♦N2: 9656,45 / 13 208,2 = 73,11 % об.;
♦О2: 591,75 / 13 208,2 = 4,48 % об.
Таким образом, соотношение необходимого количества воздуха к расходу топлива (при α = 1,3) будет равно 12,2 нм3/нм3, а количество дымовых газов – 13,2 нм3/нм3. Естественно, эти значения при других коэффициентах избытка воздуха (α) и других составах топлива будут другие.
По результатам расчетов можно сделать вывод, что количество подаваемых на сжигание газов в основном определяется количеством воздуха. Известно, что основу воздуха составляет азот, не участвующий в процессе горения, который проходит через топку транзитом и приводит к потерям тепла, так как температура дымовых газов всегда выше температуры входящего воздуха. Кроме того, образовавшийся дымовой газ содержит около 15 % об. водяных паров, что при отсутствии серосодержащих соединений соответствует температуре точки росы 55–65 °С, поэтому при охлаждении дымовых газов возможно выделение жидкой фазы, что может вызвать некоторые технологические затруднения.
55
2.3. Теплота сгорания топлива
Теплота сгорания топлива – это количество теплоты, выделяющейся при полном сгорании 1 кг массы твердого или жидкого топлива или 1 нм3 газового топлива при нормальных физических условиях (удельная теплота сгорания топлива). Различают высшую и низшую теплоту сгорания топлива. Разберем эти понятия более подробно.
Выше было показано, что дымовые газы содержат водяные пары, образовавшиеся в результате горения углеводородов. Температура точки росы дымовых газов (температура начала конденсации воды) составляет 55–65 °С. Если дымовые газы охладить ниже температуры точки росы, то часть водяных паров будет конденсироваться. При конденсации водяных паров будет выделяться значительное количество тепла (до 2,5 МДж/кг конденсата), равное теплоте испарения воды при заданной температуре.
Так как большинство энергетических установок выбрасывают дымовые газы с температурой более 100 °С, то нет необходимости учитывать теплоту конденсации. В связи с этим теплота, выделяющаяся при горении топлива при условии, что содержащиеся в дымовых газах водяные пары не конденсируются (теплота химической ре-
акции), называется низшей теплотой сгорания топлива, QHP .
Для твердых и жидких топлив низшая теплота сжигания QHP (МДж/кг) может быть рассчитана по эмпирическому уравнению,
называемому уравнением Менделеева:
QHP = 0,339CP + 1,030HP − 0,109(OP − SPОРГ+К ) − 0,025W P. (2.16)
Низшая теплота сгорания газовых топлив QHP (МДж/нм3 ) рассчи-
тывается по сумме тепловых эффектов реакций горения в зависимости от состава топлива (% об.):
QHP = 0,3582CH4 + 0,6375C2H6 + 0,9125C3H8 + 0,5906C2H4 + (2.17) +1,190C4H10 + 0,1264CO + 0,108H2 + 0,234H2S.
Высшая теплота сгорания топлива QВР (МДж/кг) учитывает не
только теплоту горения, но и теплоту полной конденсации водяных паров, содержащихся в дымовых газах. Таким образом, QВР – это сумма низшей теплоты сгорания и теплоты конденсации водяных паров:
QBP = QHP + 0,025(9HP + W P ). |
(2.18) |
56
Расчеты показывают, что за счет конденсации водяных паров из дымовых газов в зависимости от состава топлива, его энергетической ценности и глубины конденсации можно получить до 10–15 % теплоты дополнительно.
Для теплотехнических расчетов используется как высшая, так
инизшая теплота сгорания. Однако в России принято использовать только низшую теплоту сгорания топлива, т.е. конденсация воды в отечественных энерготехнологических агрегатах в принципе не допускается. За рубежом при расчетах иногда может использоваться высшая теплота сгорания топлива, поэтому можно предположить, что зарубежные энергетики допускают возможность использования теплоты конденсации, поэтому при выборе зарубежного оборудования следует обратить на это особое внимание. Таким образом, КПД котла в России будет равен 100 % при температуре дымовых газов, равной температуре точки росы воды. Соответственно, при использовании теплоты конденсации КПД будет выше 100 %. Следует добавить, что при использовании высшей теплоты сгорания расчеты тепловых балансов для теплотехнических агрегатов будут полностью соответствовать стандартным расчетам тепловых балансов в химической технологии.
Так как топливо может быть в различных агрегатных состояниях
ииметь разный состав, то для сравнения энергетической ценности различных видов топлива при его добыче и для экономических расчетов используется понятие «условное топливо». Количество топлива в пересчете на условное принято измерять в тоннах условного топлива (т у. т.). Теплота сгорания одного килограмма условного то-
плива (Qусл) принята 29,35 МДж/кг, или 7000 ккал/кг. Пересчет расхода любого топлива (В) на расход условного топлива (Вусл) можно осуществить по формуле
Вусл = В |
QP |
|
|
H |
. |
(2.19) |
|
|
|||
|
Qусл |
|
|
Кроме понятия условного топлива, существуют приведенные (удельные) характеристики, которые используются для сравнения различных теплоэнергетических агрегатов, например, по количеству (массе) выбрасываемой серы или золы (г/МДж). При умножении приведенной характеристики на вырабатываемую мощность теплоагрегата (МВт) можно легко получить выброс того или иного компонента (г/с).
57
2.4. Энтальпия, теплота и температура газового потока
Известно, что одной из основных задач инженера-технолога является проведение технологических расчетов. Необходимость расчетов возникает при оптимизации и управлении процессами горения и теплопередачи или при модернизации энерготехнологических агрегатов. Если учесть, что процессы горения и последующей теплопередачи, как правило, протекают в изобарных условиях, то параметром состояния, который может характеризовать теплоту дымовых газов, является их энтальпия, или теплосодержание. Из курса физической химии известно, что для расчета энтальпии идеального газа при некоторой температуре Т можно воспользоваться следующей формулой:
Т |
|
H = НТ0 + СPdT, |
(2.20) |
Т0 |
|
где Т0 – стандартная температура (обычно 298 К, но может быть любой); НТ0 – энтальпия газа при стандартной температуре (константа);
СР – изобарная теплоемкость идеального газа или идеальной газовой смеси, которая, в свою очередь, может быть определена по правилу аддитивности:
k |
|
CP = xiCPi , |
(2.21) |
i
где xi и CPi – мольная доля и изобарная теплоемкость i-го компонента.
При этом физическая теплота потока вещества будет рассчитываться по формуле
Qпот = HGпот. |
(2.22) |
Так как Т0 и, соответственно, НТ0 в принципе могут быть любыми
(но константами), то для инженерных расчетов, которые допускают некоторые допущения, эту формулу можно преобразовать в приближенную:
Н ≈ СРТ, |
(2.23) |
тогда
Qпот ≈ GпотСРТ. |
(2.24) |
58
Данное уравнение достаточно широко используется в инженерной практике при расчетах тепловых балансов, процессов передачи тепла и т.п.
Более сложной задачей является нахождение температуры потока по его известному теплосодержанию. Это объясняется тем, что изобарная теплоемкость (СР) является нелинейной функцией от температуры (СР = f(T)), поэтому уравнение
T ≈ |
Qпот |
, |
или Т ≈ |
Qпот |
, |
(2.25) |
|
|
|||||
GпотСP |
|
Gпотf (T ) |
|
|||
является трансцендентным. Из курса высшей математики известно, что трансцендентные уравнения могут быть решены различными математическими методами, например: методом итераций, методом перебора или с помощью функции «Поиск решения» в MS Excel. Однако их применение требует определенных навыков и может вызывать некоторые затруднения.
В инженерной практике для решения этой задачи (как и для решения подобных задач, например при расчете теплообменников) можно использовать Н,Т-диаграмму, которая используется в теплоэнергетике для расчета адиабатной температуры сжигания (температуры дымовых газов при сжигании топлива без учета теплопотерь) и теоретической температуры сжигания топлива сжигания (температуры дымовых газов при сжигании топлива при α = 1 и без учета теплопотерь) по величине его теплотворной способности без учета физической теплоты, вносимой в топку с потоками воздуха и топлива.
Пример использования этой диаграммы для технологических расчетов представлен на рис. 2.1.
Порядок расчетов температуры потока по его теплосодержанию:
1.При известном составе потока (х) в координатах СРT–T строится график (рис. 2.1).
2.При известных теплоте потока (Q1), расходе потока (G1) находится соотношение Q1/G1, которое приблизительно равно СР1Т1 (так
как Q ≈ GСРТ).
3. Используя это соотношение в графике, можно легко найти соответствующую температуру потока (Т1).
59
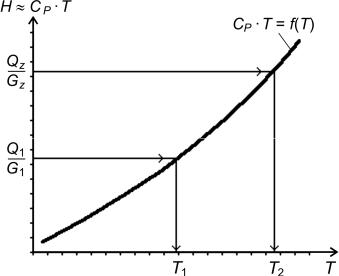
Рис. 2.1. Метод нахождения температуры потока по его теплосодержанию
Используя этот порядок расчетов можно достаточно просто и быстро проводить другие технологические расчеты без использования сложных математических методов.
2.5.Тепловой баланс энерготехнологического агрегата
Вхимической промышленности широко используются следующие энерготехнологические агрегаты: паровые и водогрейные котлы, печи и разнообразные утилизаторы тепла. Основным отличием котлов от печей является то, что в паровых и водогрейных котлах теплота передается промежуточным теплоносителям, а в печах – непосредственно обрабатываемому материалу. В зависимости от конструкции и предназначения утилизаторы тепла могут вырабатывать как горячую воду или пар (функция котлов), так и подогревать технологические потоки (функция печей).
Конструкция печей существенно отличается от конструкции котлов, однако независимо от типа установки печи и котлы имеют одинаковый модуль, предназначенный для сжигания топлива (реакции глубокого окисления молекул топлива кислородом воздуха), топку или химический реактор.
Взависимости от технологического режима энерготехнологические установки предназначены для выработки определенного количества горячей воды или пара, нагрева заданного количества материала до определенной температуры в течение определенного количества времени, т.е. для выработки требуемого количества теплоты.
60
