
Лабораторный практикум по общей химической технологии
..pdf
Результаты лабораторной работы
Время |
Температура |
Концентрация раствора |
Степень |
||||
от начала |
CNaисх2CO3 , |
CNaкон2CO3 |
CNaOкон Н , |
каустифи- |
|||
каустифика- |
|||||||
каустифика- |
ции, ºС |
г/л |
|
|
г/л |
кации, |
|
ции, мин |
|
г/л |
моль/л |
% |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исследование кинетики процесса каустификации
Реакция каустификации может быть описана бимолекулярной реакцией типа А + В = 2С + Д, дифференциальное уравнение которой имеет вид
−dCdτA = k CA CB .
Если CA =CB , то данная реакция может описываться уравнением
−dCdτA = k CA2 .
После преобразования и интегрирования правой и левой части получим
|
|
|
|
1 |
|
= |
|
1 |
+k τ. |
||
|
|
|
|
|
|
|
|
||||
|
|
|
CA |
|
CA0 |
||||||
Данное уравнение является уравнением прямой в коорди- |
|||||||||||
натах |
1 |
−τ. Прямая на оси ординат отсекает отрезок, чис- |
|||||||||
|
|||||||||||
|
CA0 |
|
|
|
|
|
|
|
|
||
ленно равный величине |
|
|
1 |
|
, а тангенс угла наклона прямой |
||||||
|
CA |
||||||||||
|
|
|
|
|
|
|
|
||||
коси абсцисс – величине k, т.е. величине константы скорости.
Взадачу лабораторной работы входит определение величины константы скорости реакции. Для этого по полученным экспериментальным значениям концентрации Na2CO3 (моль/л)
61
строят зависимость |
1 |
от продолжительности процесса кау- |
|
||
|
CA |
|
стификации. В общем виде данная зависимость представляет собой прямую, не проходящую через начало координат.
Опыты проводят при различных температурах и в каждом случае находят соответствующую константу скорости реакции. По полученным данным определяют кажущуюся энергию активации согласно уравнению Аррениуса:
|
k |
|
E |
|
1 |
|
1 |
|
|
ln |
1 |
= |
|
|
|
− |
|
|
, |
k2 |
R |
|
|
||||||
|
|
T2 |
|
T1 |
|
||||
где k1 – константа скорости при T1 ; |
k2 |
– константа скорости |
|||||||
при T2 ; E – энергия активации процесса; R – универсальная
газовая постоянная.
По величине энергии активации делают вывод об области протекания, о путях интенсификации процесса.
Контрольные вопросы
1.Перечислите основные стадии аммиачного способа производства кальцинированной соды.
2.Каковы физико-химические основы процесса каустификации?
3.По каким показателям контролируют процесс каустификации?
Список литературы
1.Крашенинников С.А. Технология соды. – М.: Химия, 1988. – 304 с.
2.Зайцев И.Д., Ткач Г.А., Стоев Н.Д. Производство со-
ды. – М.: Химия, 1986. – 312 с.
3.Чарыков А.К. Математическая обработка результатов химического анализа. – М.: Химия, 1984. – 168 с.
62
Лабораторная работа № 7
ИССЛЕДОВАНИЕ ПРОЦЕССА АДИАБАТИЧЕСКОЙ АБСОРБЦИИ ХЛОРОВОДОРОДА
Цель работы – изучение процесса получения соляной кислоты из хлороводорода без охлаждения абсорбера.
Теоретические сведения
Растворение хлороводорода в воде – это процесс гидратации молекул хлороводорода и перевод их в ионное состояние в растворе соляной кислоты. Подобно химической реакции этот процесс сопровождается большим выделением тепла и, следовательно, повышением температуры образующейся соляной кислоты. При больших объемах абсорбируемого газа и небольших тепловых потерях количества выделяющегося тепла достаточно для нагревания раствора до температуры кипения. Так как хлороводород существует в жидкой фазе в виде практически нелетучих ионов, то в разбавленных растворах соляной кислоты более летучим компонентом является вода. За счет теплоты абсорбции происходит кипение разбавленных растворов соляной кислоты, испарение воды и концентрирование до образования азеотропной смеси, содержащей 20,24 % НС1 при атмосферном давлении.
В лабораторных условиях при небольших объемах абсорбируемого газа и сравнительно высоких потерях тепла в окружающую среду, абсорбер невозможно нагреть за счет тепла абсорбции до температур, близких к температуре кипения. Однако в начальный период абсорбции, когда скорость процесса велика и хлороводород поглощается водой практически полностью, происходит заметное повышение температуры образующейся соляной кислоты. С течением времени абсорбции кон-
63
центрация соляной кислоты возрастает, а прирост температуры раствора постепенно снижается.
Для каждой температуры существует определенная равновесная (максимальная) концентрация соляной кислоты, которая зависит от состава абсорбируемого газа. В результате длительного процесса абсорбции система приходит в состояние равновесия, и концентрация соляной кислоты, достигнув максимального значения, становится постоянной. При ограниченном времени абсорбции равновесная концентрация не достигается.
Максимально возможная концентрация кислоты будет увеличиваться с понижением температуры абсорбции, так как растворимость хлороводорода в воде возрастает. Следовательно, для получения более концентрированной кислоты благоприятно охлаждение абсорбера для отвода тепла, выделяющегося в процессе хемосорбции. На этом принципе основана работа промышленных установок, использующих в качестве хладагента оборотную воду.
Снижение концентрации хлороводорода в газе отрицательно сказывается на качестве соляной кислоты. Для получения концентрированной кислоты необходимо высокое содержание хлороводорода в абсорбируемом газе. Концентрация хлороводорода в газе зависит от способа его получения. В лабораторных условиях получение газа осуществляют путем разложения поваренной соли концентрированной серной кислотой. При использовании в качестве реагента 93%-й серной кислоты теоретически в составе газа должно находиться
83 % (об.) НС1 и 17 % (об.) Н2О.
Показателем интенсивности процесса является величина движущей силы процесса абсорбции:
∆P = PHCl −PHCl* ,
64
где PHCl – парциальное давление хлороводорода в газе, поступающем на абсорбцию; PHCl* – равновесное давление хлорово-
дорода над абсорбирующим раствором соляной кислоты.
В начальный момент абсорбции хлороводорода водой PHCl* = 0, следовательно, ∆P = PHCl , т.е. в этот момент движу-
щая сила максимальна. При повышении концентрации раствора соляной кислоты и температуры увеличивается равновесное
давление PHCl* , что приводит к снижению скорости абсорбции
в результате уменьшения движущей силы.
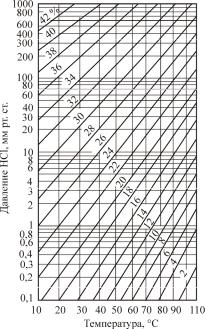
Влияние температуры абсорбции и концентрации раствора (мас. %) на равновесное давление хлороводорода над соляной кислотой показано на рис. 1.
Рис. 1. Зависимость равновесного давления НСl от температуры и концентрации соляной кислоты
65
По данным рис. 1 можно определить равновесное давле-
ние хлороводорода (PHCl* , мм рт. ст.) при любых условиях абсорбции, а затем рассчитать движущую силу процесса.
Допустим, на абсорбцию подается хлороводород с концентрацией 80 % об. При барометрическом давлении 747 мм рт. ст. Парциальное давление НСl составит РНCl = 747 · 0,8 = = 597,6 мм рт. ст. Этой величине будет равна начальная движущая сила абсорбции хлороводорода водой. При протекании процесса абсорбции с течением времени будет изменяться температура и возрастать концентрация образующейся соляной кислоты, что приведет к уменьшению движущей силы процесса.
При экспериментальном исследовании процесса абсорбции хлороводорода водой в различные промежутки времени измеряют температуру раствора и отбирают пробы кислоты для определения концентрации НС1. Полученные данные (t, СHCl) позволяют определить равновесное давление НС1 над раствором в момент отбора пробы.
Например, при температуре 70 °С концентрация соляной кислоты равна 13 %. Согласно рис. 1 равновесное давление НСl над этой кислотой PHCl = 1 мм рт. ст. При использовании газа, содержащего 80 % (об.) НС1, парциальное давление, как рассчитано выше, составит PHCl = 596,7 мм рт. ст., а отсюда
может быть найдена движущая сила ∆P = 596,7 – 1,0 = = 595,7 мм рт. ст. или в пересчете на современную систему СИ
∆P = 595,7 · 133,3 = 79 406,8 Па.
Схема установки и порядок проведения работы
Схема лабораторной установки для получения и абсорбции хлороводорода приведена на рис. 2.
66
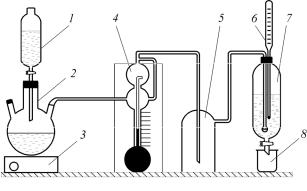
Рис. 2. Схема лабораторной установки: 1 – воронка с серной кислотой; 2 – реакционная колба с поваренной солью для получения хлороводорода; 3 – колбонагреватель; 4 – реометр; 5 – брызгоуловитель; 6 – термометр; 7 – абсорбер; 8 – стаканчик для сбора проб
Выделяющийся по реакции хлористый водород равномерно подают через реометр 4 в абсорбер 7, в который предварительно наливают 80 мл воды. Постоянный расход хлороводорода задается преподавателем. Регулирование расхода выделяющегося хлороводорода осуществляется изменением подачи серной кислоты. Газ из реометра 4 с постоянной скоростью проходит брызгоуловитель 5, а затем через отверстия барботера поступает в абсорбер 7.
В начале опыта записывают температуру воды в абсорбере, которая контролируется термометром 6. Первые порции хлороводорода будут постепенно заполнять систему и вытеснять воздух из установки. Нерастворяющийся в воде воздух будет барботировать через слой жидкости в виде крупных пузырьков. Как только хлороводород начнет поступать в абсорбер, барботаж прекратится вследствие полного поглощения хлороводорода водой непосредственно на выходе из барботера. В этот момент отмечают начало опыта. Далее, поддерживая постоянный расход хлороводорода, проводят в течение заданного времени процесс абсорбции и отбор проб соляной кисло-
67

ты из абсорбера в приготовленные бюксы с крышками. Режим отбора и количество отобранных проб задаются преподавателем.
Прекращение опыта осуществляют в следующем порядке. Прекращают подачу серной кислоты, отключают нагрев колбонагревателя 3, отсоединяют абсорбер с помощью муфты и нейтрализуют остатки хлороводорода щелочью. Охлажденные до комнатной температуры пробы соляной кислоты взвешивают на весах с точностью до 0,001 г и определяют концентрацию НС1 в кислоте по методике, приведенной ниже.
Результаты эксперимента представляют в виде таблицы.
Результаты исследований по абсорбции НСl водой
Время |
Температура |
Концентрация |
Равновесное |
Движущая |
|
τ, мин |
t, ºС |
кислоты CHCl, |
давление |
сила |
|
абсорбции |
|||||
|
|
% |
РНСl, кПа |
||
|
|
∆РНСl, кПа |
|||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Для анализа результатов строят графики зависимости t,
CHCl, ∆РHCl от τ.
Методика анализа
Перед началом опыта взвешивают 6–7 чистых сухих стеклянных бюксов с крышками, маркированных цифрами. В соответствии с заданием в каждый бюкс через определенный промежуток времени отбирают 10–15 капель раствора, так чтобы навеска составляла 1–1,5 г. Чтобы в пробу кислоты не попали остатки предыдущей пробы, находящиеся в носике абсорбера, предварительно сливают в пустой стакан 6–7 капель жидкости. Отобранные пробы закрывают крышками и охлаждают до комнатной температуры, а затем взвешивают с точностью до
68
0,01 г. По результатам взвешивания рассчитывают массу взятой пробы кислоты.
Для разбавления полученных навесок растворов берут столько же чистых мерных колб емкостью 100 мл, маркированных цифрами. Каждую навеску раствора переносят в мерную колбу через воронку. Чтобы исключить потери раствора при разбавлении, сначала обмывают дистиллированной водой крышку бюкса над воронкой, а затем сливают в воронку из бюкса раствор и 4–5 раз промывают бюкс дистиллированной водой. После тщательной промывки бюкса раствор в мерной колбе перемешивают и доводят дистиллированной водой до метки, закрывают колбу пробкой и снова тщательно перемешивают. Так поступают с каждой пробой.
Для титрования кислоты берут чистые конические колбы, в которые пипеткой 10 мл отбирают из каждой мерной колбы пробу раствора. Для точности анализа при отборе проб пипетку необходимо промывать от остатков предыдущего раствора. Чтобы отобрать следующую пробу, пипетку не моют водой, а тщательно вытирают снаружи фильтровальной бумагой и выдувают остатки предыдущей жидкости. Затем в нее отбирают из мерной колбы небольшое количество следующего раствора, обмывают этим раствором стенки пипетки и сливают промывной раствор в ненужную емкость. В промытую этим раствором пипетку отбирают для титрования 10 мл раствора в коническую колбу.
Тирование проб соляной кислоты проводят 0,1 н. раствором щелочи в присутствии индикатора метилоранжа. В каждую коническую колбу с пробой добавляют 80 мл дистиллированной воды, 3–5 капель индикатора и титруют 0,1 н. раствором NaOH до перехода окраски от розовой в оранжевую, характерную для нейтральной среды. Чтобы уменьшить ошибку при титровании, колбу с первой оттитрованной пробой оставляют для сравнения цвета при титровании всех последую-
69
щих растворов. В процессе анализа определяют объемы растворов NaOH, пошедших на титрование каждой пробы.
Расчет концентрации НСl в растворе (С, мас. %) проводят по формуле
C = T N K V 100 100, m 10
где С – концентрация соляной кислоты, мас. %; Т = 0,0365 – титр 0,1 н. раствора NaOH по НС1, г/см3; N – нормальность раствора NaOH; K – коэффициент поправки; V – объем раствора NaOH, пошедший на титрование, мл; т – масса пробы соляной кислоты
В задание может быть включено получение соляной кислоты определенной концентрации или установление зависимости температуры кипения кислоты от ее концентрации. В последнем случае в абсорбер необходимо установить пробоотборник для взятия проб кислоты в процессе опыта.
Контрольные вопросы
1.Теоретические основы рассматриваемого процесса:
• термодинамический анализ химических реакций;
• статический анализ фазового состояния системы;
• кинетический анализ рассматриваемых процессов;
• обоснование оптимальных условий.
2.Схема установки:
•назначение и принцип работы элементов установки;
•подключение;
•условия безопасной работы.
3.Что положено в основу обработки результатов эксперимента?
4.Проанализировать полученные данные, сделать выводы.
5.Дать сравнительную оценку лабораторной установки
сдействующей технологической схемой.
70
