
Лабораторный практикум по общей химической технологии
..pdfКонтрольные вопросы
1.Химизм процесса обжига серосодержащего сырья.
2.Факторы, влияющие на скорость и степень обжига.
3.Как рассчитать количество выгоревшей серы и определить скорость ее выгорания?
4.Дайте определение понятия лимитирующей стадии процесса.
5.Опишите процесс обжига колчедана как пример гетерогенного процесса в системе газ – твердое.
Список литературы
1.Амелин А.Г. Технология серной кислоты. – М.: Химия, 1971. – 495 с.
2.Справочник сернокислотчика / под ред. К.М. Малина. –
М.: Химия, 1971. – 744 с.
3.Технология серной кислоты / К.М. Малин, Н.Л. Аркин, Г.К. Боресков, М.Г. Слинько. – М.; Л.: Госхимиздат, 1950. – 570 с.
4.Руководство к практическим занятиям по технологии неорганических веществ / М.Е. Позин [и др.]. – М.: Химия, 1986. – 368 с.
5.Лабораторный практикум по общей химической технологии / под ред. В.С. Бескова. – М.: БИНОМ Лаборатория заня-
тий, 2010. – 279 с.
21
Лабораторная работа № 3
ХИМВОДОПОДГОТОВКА (ИОННЫЙ ОБМЕН)
Цель работы – ознакомиться с процессом ионообменного умягчения воды, определить эффективность умягчения.
Теоретические сведения
Вода – одно из наиболее распространенных и стабильных веществ на Земле. В химической промышленности воду применяют для самых разнообразных целей, в технологических процессах – для охлаждения и нагревания: в качестве растворителя, для промывки продуктов с целью очистки от примесей. Значительное количество воды в виде водного пара используется для обогрева аппаратов, а также в производстве синтезгаза для получения аммиака.
Природные воды обычно содержат примеси различных минеральных, органических веществ и растворенные газы. При оценке качества воды прежде всего предъявляют требования в отношении ее жесткости. Под жесткостью понимают содержание растворенных в воде солей кальция и магния. Единица жесткости соответствует содержанию 20,04 мг/дм3 Са2+ или 12,16 мг/дм3 Mg2+. Жесткость воды подразделяется на временную, постоянную и общую.
Временная (карбонатная) жесткость обусловлена при-
сутствием в воде гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые нормальные или основные карбонаты, выпадающие в осадок.
Постоянная (не карбонатная) жесткость создается все-
ми другими растворимыми солями кальция и магния, чаще всего сульфатами и хлоридами, которые остаются при кипячении воды в растворенном состоянии.
22
Общая жесткость – сумма временной и постоянной жесткости.
Особенно высокие требования предъявляются к составу воды, применяемой в паровых котлах. Наличие примесей в воде вызывает образование накипей на стенках котла из плотной массы солей, а именно CaCО3, Mg(OH)2 и CaSO4 в различных формах. При этом теплопроводность стенок котла ухудшается, а вынужденные перегревы приводят его к преждевременному износу. По этой причине воду очищают от примесей.
Очистка воды (деминерализация) состоит в полном или частичном удалении растворенных в ней солей. Умягчение воды – частичное удаление солей кальция и магния, которое осуществляется химическими и физико-химическими методами.
Химические методы умягчения воды.
Известково-содовый метод проводят в два этапа. На пер-
вом этапе обработку воды проводят гашеной известью при температуре 70 °С для устранения солей временной жесткости, связывания СО2 и ионов железа. Химизм процессов характеризуется следующими реакциями:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 3H2O,
Mg(HCO3)2 + Ca(OH)2 = CaCO3↓+ Mg(OH) 2 + 2H2O,
FeSO4 + Ca(OH)2 = Fe(OH) 2↓+ CaSO4,
CO2 + Ca(OH)2 = CaCO3↓+ H2O.
На втором этапе обработку воды проводят раствором кальцинированной соды для устранения солей постоянной жесткости:
MgSO4 + Na2CO3 = MgCO3 + Na2SO4, MgCl2 + Na2CO3 = MgCO3 +2NaCl, CaSO4 + Na2CO3 = CaCO3 + Na2SO4.
Известково-содовый метод обеспечивает остаточное содержание солей кальция и магния до 0,3 мг-экв/дм3.
23
Для более полного удаления ионов кальция и магния применяют фосфатный метод, который основан на ничтожно малой растворимости фосфатов кальция и магния:
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2 + 6NaHCO3,
3Mg(HCO3)2 + 2Na3PO4 = Mg3(PO4)2 + 6NaHCO3.
Остаточное содержание солей кальция и магния в очищенной воде составляет менее 0,03 мг-экв/дм3.
Данный способ отличается высокой стоимостью. В условиях действующего производства умягчение воды первоначально проводят известково-содовым методом с последующей доочисткой тринатрийфосфатом.
Физико-химические методы умягчения воды.
Баромембранные методы водоподготовки. Группа баро-
мембранных методов включает в себя обратный осмос, нанофильтрацию, ультрафильтрацию и микрофильтрацию.
Обратный осмос – один из наиболее перспективных методов очистки воды, преимущества которого заключены в малых энергозатратах, простоте конструкций аппаратов и установок, малых их габаритах и простоте эксплуатации; применяется для обессоливания вод с солесодержанием до 40 г/л, причем границы его использования постоянно расширяются.
Нанофильтрация используется для отделения красителей, пестицидов, гербицидов, сахарозы, некоторых растворенных солей, органических веществ, вирусов и др.
Ультрафильтрация применяется для отделения некоторых коллоидов, вирусов (в том числе полиомиелита), угольной сажи, разделения на фракции молока и др. Ультрафильтрация заимствовала у обратного осмоса способы получения мембран, а также во многом подобна ему и по аппаратному исполнению. Отличие заключается в гораздо более высоких требованиях к отводу от мембранной поверхности концентрированного раствора вещества, способного формировать в случае ультрафильтрации гелеобразные слои и малорастворимые осадки.
24
Ультрафильтрация по схеме ведения процесса и параметрам – промежуточное положение между фильтрованием и обратным осмосом. Ультрафильтрацию в отличие от обратного осмоса используют для разделения систем, в которых молекулярная масса растворенных компонентов намного больше молекулярной массы растворителя.
Микрофильтрация используется для отделения некоторых вирусов и бактерий, тонкодисперсных пигментов, пыли активных углей, асбеста, красителей, разделения водомасляных эмульсий и т.п.
Ионный обмен. Одним из эффективных способов деминерализации воды является ионный обмен. Принцип умягчения и водоочистки методом ионного обмена заключается в том, что ионообменная смола, вступая в реакцию с растворенными в воде солями, отдает ионы. Основная причина обмена частицами между жесткой водой и фильтровой загрузкой заключается в разности концентрации ионов. Ионы солей стремятся попасть в раствор ввиду того, что в растворе отсутствуют подобные ионы. Согласно принципу сохранения электронейтральности ионы жесткой воды стремятся пробраться внутрь гранул засыпки.
Умягчение воды методом ионного обмена происходит следующим образом. Жесткая вода проходит через фильтры умягчения воды, внутри которых засыпаны ионообменные смолы. Ионообменные смолы разделяются на катиониты (в воду выделяются положительно заряженные частицы) и аниониты (выделяются частицы, заряженные отрицательно). Для умягчения воды методом ионного обмена в основном используются катиониты.
Рабочий цикл ионитного фильтра заканчивается в результате истощения объемной емкости смолы, после чего ее необходимо регенерировать.
Объемная емкость – это способность ионита поглощать определенное количество ионов в данных условиях. Различают
25
статическую (или равновесная), динамическую и полную обменные емкости.
Статическая обменная емкость характеризует общее число ионогенных групп, приходящихся на единицу объема ионита. Статическая обменная емкость (СОЕ) определяется в статических условиях.
Динамическая обменная емкость (ДОЕ) характеризует использование части ионогенных групп, определяется проскоковой концентрацией при движении раствора (электролита) через слой ионита.
Полная обменная емкость (ПДОЕ) определяется числом функциональных групп, способных к ионному обмену, в единице массы воздушно-сухого или набухшего ионита (мг-экв/г или мг-экв/л). Она является постоянной величиной, которую указывают на паспорте ионита, и не зависит от концентрации или природы обменивающегося ионита. ПДОЕ изменяется (уменьшается) из-за термического, химического или радиационного воздействия.
Описание установки и методика проведения работы
Схема лабораторной установки для определения обменной емкости анионита представлена на рис. 1.
Установка состоит из колонки 4, заполненной смолой, напорной емкости 1 с очищаемой водой и сборника фильтра 8. В нижнюю часть колонки вставлен фильтр 6, не пропускающий зерен ионита и обладающий малым сопротивлением фильтрации. Колонку соединяют с напорной емкостью 1 с помощью стеклянной трубки 2 и резинового шланга с винтовым зажимом 3.
Методика проведения работы заключается в следующем. Предварительно колонку заполняют дистиллированной водой так, чтобы уровень ее над смолой был постоянным и составлял 10–15 см. Устанавливают заданную скорость фильтрации с по-
26
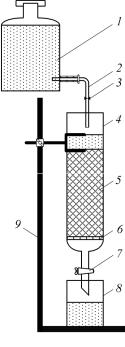
мощью винтового зажима 7. Избыточное количество воды удаляют, оставляя 1 см воды над поверхностью смолы, не изменяя положение винтового зажима. Протекание воды останавливают с помощью зажима Мора.
Рис. 1. Схема лабораторной установки: 1 – напорная емкость с очищаемой водой; 2 – стеклянная трубка; 3 – винтовые зажимы; 4 – адсорбционная колонка; 5 – поглотитель; 6 – фильтр; 7 – винтовой зажим; 8 – стакан для отбора проб; 9 – штатив
Затем колонку заполняют очищаемой водой из напорной емкости 1 с помощью винтового зажима 3 так, чтобы уровень воды над смолой не превышал 10–15 см. Снимают зажим Мора.
Фильтрат непрерывно собирают порциями в несколько измерительных цилиндров. Количество и объем отбираемых проб задает преподаватель.
27
В зависимости от вида используемого ионита (анионита или катионита) применяют разные методы контроля проб.
Определение обменной емкости анионита
В лабораторной работе используется анионообменная смола в ОН-форме (анионит). Процесс обработки воды анионитом заключается в связывании анионов сильных и слабых кислот по следующим реакциям:
R-OH + Cl– = R-Cl + OH–,
2(R-OH) + SO24+ = 2(R-SO4) + 2OH–.
Когда ионы ОН– будут вытеснены, начнется проскок ионов Cl– , SO24− и содержание анионов кислот в воде после
фильтрата будет постепенно подниматься до уровня их содержания в исходной воде. Для восстановления обменной емкости анионита его регенерируют раствором щелочи.
Метод контроля на хлор-ион. Методы анализа на хлор-
ион основаны на образовании слабодиссоциированной хлорной ртути при добавлении к раствору, содержащему хлориды, ионов ртути (II) виде азотнокислой ртути. В качестве индикатора используют смешанный индикатор (смесь дифенилкарбазона и бромфенолового синего) или нитропруссид натрия.
Определение хлор-иона с дифенилкарбазоном. В качестве индикатора в коническую колбу на 250 см3 отбирают 5 см3 исследуемой воды. Добавляют 50 см3 дистиллированной воды, 6–8 капель смешанного индикатора, затем по каплям 0,2 н. раствора азотной кислоты до перехода окраски из сине-зеленой в желтую и приливают еще кислоту, доводя значение рН до 2,0. Для сильно кислых проб, окрашивающих после прибавления индикатора в желтый цвет, необходимо добавить 0,1 н. раствор NaOH до появления сине-зеленой окраски. Затем пробу подкисляют азотной кислотой и титруют 0,01 н. раствором
28
нитрата ртути (II) до перехода окраски из желтой в фиолетовую. Количество хлоридов в пересчете на хлор рассчитывается по формуле
C = |
A K 0,01 1000 |
, |
(1) |
Cl |
5 |
|
где СCl – количество хлоридов, мг-экв/дм3; А – расход 0,01 н. раствора азотнокислой ртути, пошедшей на титрование исследуемой пробы, см3; K – коэффициент поправки раствора нитрата ртути; 0,01 – нормальность раствора нитрата ртути;
Определение хлор-иона с нитропруссидом натрия в каче-
стве индикатора. В коническую колбу на 250 см3 помещают 2 см3 анализируемой пробы, добавляют 50 см3 дистиллированной воды и 2 см3 0,2 н. раствора азотной кислоты для создания рН, равного 2–3 (контроль по универсальной индикаторной бумаге). Далее приливают 6–8 капель нитропруссида натрия и титруют 0,01 н. раствором нитрата ртути (II) до устойчивой неисчезающий мути. Концентрацию хлор-иона рассчитывают по формуле (1).
Метод контроля щелочности. Для определения щелоч-
ности в коническую колбу на 250 см3 помещают 5 см3 анализируемой воды и 50 см3 дистиллированной воды. Затем приливают 2–3 капли метилового оранжевого и титруют 0,1 н. раствором серной кислоты до перехода окраски раствора из желтого в оранжевую. Щелочность воды рассчитывается по формуле
X = V 0,1 1000 |
, |
(2) |
5 |
|
|
где Х – щелочность воды, мг-экв/дм3; V – объем кислоты, пошедший на титрование, см3.
Результаты исследований записываются в табл. 1.
29

|
|
|
|
|
|
|
Таблица 1 |
|
|
|
Результаты работы ОН-анионита |
|
|
||||
|
|
|
|
|
|
|
||
Характеристика |
Характеристика воды после анионита |
|||||||
исходной воды |
||||||||
|
|
|
|
|
||||
Содержание |
|
Щелоч- |
Объем |
|
Содержание |
|
Щелоч- |
|
|
|
|
||||||
хлор-иона, |
|
ность, |
пропущенной |
|
хлор-иона, |
|
ность, |
|
мг-экв/дм3 |
|
мг-экв/дм3 |
воды, см3 |
|
мг-экв/дм3 |
|
мг-экв/дм3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обработка результатов.
Динамическая обменная емкость анионита (мг-экв/дм3)
в растворе хлорида натрия вычисляется по формуле
ДОЕ – = ΣV CCl , |
(3) |
OH Vс
где ΣV – объем фильтрата, пропущенный через ионит до появления ионов хлора, см3; СCl– – концентрация хлор-ионов в очи-
щаемом растворе хлорида натрия, мг-экв/дм3; Vс – объем смолы, см3.
Полная динамическая обменная емкость вычисляется по формуле
ПДОЕ – = |
V CCl −ΣV CCl |
, |
(4) |
|
|||
OH |
Vс |
|
|
|
|
|
|
где V – общий объем фильтрата, пропущенный через ионит, см3; СCl – концентрация хлор-ионов в последней пробе раствора, мг-экв/дм3; ΣV – объем порций фильтрата после появления ионов хлора в растворе, см3; СCl – концентрация хлор-ионов в фильтре, мг-экв/дм3; Vс – объем смолы, см3
Степень очистки воды определяется по уравнению
Хоч = |
С0 −Сi |
100 %, |
(5) |
|
|||
|
С0 |
|
|
30
