
Лабораторный практикум по общей химической технологии
..pdfразца. Их заносят в табл. 2 и используют для расчета интегральных характеристик гранулометрического состава.
Таблица 2
Результаты ситового анализа
|
Размер |
Раз- |
Масса |
Масса |
Масса |
Содержа- |
Сред- |
Но- |
отвер- |
мер |
тары, |
тары с |
фрак- |
ние |
ний |
мер |
стий |
фрак- |
г |
навеской, |
ции, |
фракции, |
размер |
тары |
сита, |
ции, |
|
г |
г |
% |
зерен, |
|
мм |
мм |
|
|
|
|
мм |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для расчета доли частиц, оставшихся на каком-либо сите определенного размера, суммируют процентное содержание всех фракций со средним размером зерен более размера ячейки данного сита. При этом доля частиц, прошедших через это же сито, определяют как разность между 100 % и долей оставшихся частиц.
Полученные данные используют для построения дифференциальных и интегральных кривых распределения частиц по размерам.
На основе результатов анализа определяют преобладающий размер зерен, средний размер частиц и однородность дисперсного материала, которая характеризуется коэффициентом отклонения.
По результатам ситового анализа делают выводы о гранулометрической характеристике исследованного дисперсного материала.
51
Контрольные вопросы
1.Что такое обогащение сырья и для чего его проводят на производстве?
2.Каковы методы обогащения сырья?
3.В чем суть ситового анализа?
4.Что показывают интегральные и дифференциальные кривые распределения частиц?
5.На какие показатели влияет гранулометрический со-
став?
6.Что такое монодисперсный и полидисперсный продукт? Как, пользуясь рис. 1, можно определить монодисперсный или полидисперсный продукт?
Список литературы
1.Коузов П.А. Основы анализа дисперсного состава промышленных пылей и измельченных материалов. – Л.: Химия, 1974. – 278 с.
2.Общая химическая технология: учеб. для вузов / А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. – 3-е изд., перераб. – М.: Академкнига, 2007. – 527 с.
52
Лабораторная работа № 6
ПОЛУЧЕНИЕ ГИДРОКСИДА НАТРИЯ КАУСТИФИКАЦИЕЙ СОДОВОГО РАСТВОРА
Цель работы – исследование зависимости степени каустификации содового раствора от времени процесса, концентрации исходного содового раствора и температуры. Определение констант скорости процесса и энергии активации.
Теоретические основы процесса
Гидроксид натрия, или каустическая сода (каустик), широко применяется в производстве искусственных волокон, моющих средств, органических красителей, в бумажном и текстильном производствах, в технологии оксида алюминия, синтетического фенола и др.
Получают гидроксид натрия электрохимическим и химическим способами.
Электрохимический способ осуществляют электролизом водных растворов хлорида натрия. В результате образуется раствор гидроксида натрия, упариванием которого получают раствор либо твердый гидроксид натрия. Побочные продукты – газообразные хлор и водород.
Химические методы – ферритный и известковый, предпочтение отдают известковому способу.
Ферритный способ заключается в смешении сухой соды с измельченным оксидом железа в соотношении 1:3 и прокаливании смеси при температуре 1000 °С. При этом образуется плав – феррит натрия:
Na2CO3 + Fe2O3 = Na2O Fe2O3 + CO2.
Плав разлагают горячей водой с образованием раствора гидроксида натрия и оксида железа:
53

Na2O Fe2O3 + H2O = 2NaOH + Fe2O3.
Известковый способ получения NaOH заключается в смешении водных растворов соды и извести (реакция каустификации):
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH.
Эта реакция является обратимой и при определенных условиях (концентрации, температуре) наступает состояние равновесия, реакция превращения Nа2СО3 в NaOH не доходит до конца. Равновесие реакции определяется соотношением между растворимостями гидроксида и карбоната кальция или значе-
ниями концентраций ионов ОН– и CO32− в растворе. Константа равновесия Kс определяется из следующего соотношения:
K = [CaCO3 ] [NaOH]2 . c [Ca(OH)2 ] [Na2CO3 ]
Поскольку концентрации [СаСО3] и [Са(ОН)2] можно принять постоянными, то константа равновесия будет опреде-
ляться отношением концентраций ионов ОН– и CO32− , т.е.
|
|
– |
2 |
|
|
Kc = |
OH |
|
|
. |
|
|
2– |
|
|||
|
|
||||
|
CO3 |
|
|
||
Степень каустификации, т.е. доля соды, превратившейся в гидроксид, увеличивается с уменьшением концентрации соды в исходном растворе.
При повышении температуры значение константы равновесия уменьшается, так как реакция каустификации является экзотермической. Следовательно, более полное превращение Nа2СОЗ в NaOH будет наблюдаться в интервале температур 15–20 °С. На практике процесс ведут при температуре 80–100 °С. Повышение температуры способствует увеличе-
54
нию скорости процесса, получению хорошо фильтрующегося осадка.
Скорость процесса зависит от свойств и количества применяемой извести, т.е. размеров частиц, наличия примесей. В качестве примесей известь содержит SiО2, Al2O3, Fе2O3, MgO. Каждая примесь по-разному влияет на процесс, замедляя процесс гашения, уменьшая скорость осаждения шлама. Уменьшение количества примесей улучшает технологический процесс. Интенсивное перемешивание суспензии способствует ускорению процесса растворения гидроксида кальция, что приводит к увеличению скорости процесса.
Таким образом, оптимальными условиями каустификации являются: концентрация соды 250 г/л, температура 80 °С, интенсивное перемешивание. При этом степень каустификации, т.е. отношение количества соды, перешедшей в гидроксид натрия, ко всему ее количеству, участвующему в реакции, дости-
гает 90–95 %.
Технологический процесс производства гидроксида натрия состоит из следующих стадий:
•приготовление известкового молока;
•приготовление содового раствора;
•каустификация содового раствора;
•отделение СаСО3 от раствора;
•упаривание раствора;
•фильтрация щелока и отделение выпавших солей
Nа2СО3 и Na2SО4;
•окончательное упаривание раствора до получения плава
NaOH.
Порядок выполнения работы
Перед выполнением работы необходимо провести анализ исходных реагентов (соды и извести), чтобы правильно рассчитать их количество для проведения процесса каустификации.
55
Анализ извести. Пробу извести массой 20 г растирают в фарфоровой ступке до тонкого порошка. Для анализа берут навеску 0,1 г на аналитических весах, переносят в коническую колбу емкостью 250 мл, добавляют 50 мл дистиллированной воды, тщательно взбалтывают, затем титруют 0,1 н. раствором соляной кислоты в присутствии 2–3 капель фенолфталеина до появления устойчивого розового окрашивания. Титрование необходимо проводить медленно, так как известь плохо растворяется в воде и переходит в раствор по мере титрования.
Содержание активной извести выражают в массовых процентах:
= V 0,0028
CCaO a 100 %,
где CCaO – концентрация активной извести, мас. %; V – коли-
чество кислоты, пошедшее на титрование, мл; а – навеска извести, г; 0,0028 – количество СаО, соответствующее 1 мл 0,1 н. раствора кислоты, г.
Анализ исходного раствора соды. Концентрацию карбона-
та натрия в исходном содовом растворе определяют титрованием. Для этого пипеткой берут 5 мл анализируемого раствора в мерную колбу вместимостью 50 мл. Раствор доводят дистиллированной водой до метки и взбалтывают. Из мерной колбы 5 мл полученного раствора переносят пипеткой в коническую колбу вместимостью 250 мл, добавляют 50 мл дистиллированной воды, 2–3 капли метилового оранжевого и титруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в розовую. Объем V (мл) соляной кислоты, израсходованный на титрование, эквивалентен количеству Nа2СО3.
Концентрацию карбоната натрия в растворе определяют по формуле
CNaисхCO |
|
= V 0,0053 K 1000 10 |
, |
2 |
3 |
5 |
|
|
|
56
где CNaисх2CO3 – концентрация Nа2СОЗ в растворе, г/л; V – объем
0,1 н. раствора HCl, пошедший на титрование, мл; 0,0053 – количество Nа2СОЗ, соответствующее 1 мл точно 0,1 н. раствора HCl, г; K – коэффициент поправки.
Методика проведения процесса каустификации
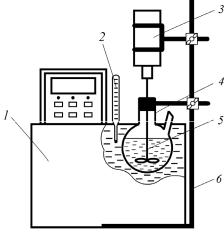
Лабораторная установка, представленная на рисунке, состоит из водяного термостата с блоком автоматического регулирования температуры, реактора каустификации, представляющего собой стеклянную круглодонную двухгорловую колбу, мешалки с регулируемым числом оборотов, штатива для крепления реактора и термометра для контроля текущей температуры.
Рис. Схема лабораторной установки: 1 – жидкостный термостат; 2 – термометр; 3 – мешалка; 4 – реактор каустификации;
5 – мешалка; 6 – штатив
Для проведения опыта в реактор 4 заливают заданное количество (100–150 мл) проанализированного содового раствора, помещают его в термостат 1, запускают мешалку 3 и вклю-
57
чают нагрев термостата (температуру и концентрацию раствора задает преподаватель). Когда температура достигнет заданной величины (в пределах 50–90 °С), в реактор через боковое отверстие загружают небольшими порциями в течение 2–3 мин необходимое (рассчитанное) количество извести и отмечают время начала процесса каустификации (с момента загрузки извести).
Количество извести, необходимое для проведения каустификации, рассчитывают по уравнению с учетом концентрации активной извести, найденной анализом концентрации содового раствора и количества этого раствора, взятого для опыта.
Процесс ведут в течение 45–60 мин, отбирая через каждые 15 мин пробы реакционной смеси для анализа. Пробы отбирают пробоотборником в количестве 10 мл (в цилиндр с делениями). Каждую из отобранных проб отфильтровывают (можно с помощью вакуум-насоса), замеряют объем фильтрата. Отбирают пипеткой 5 мл фильтрата, переносят его в мерную колбу вместимостью 50 мл и доводят дистиллированной водой до метки. Фильтрат анализируют на содержание общей щелочности, гидроксида и карбоната натрия.
В зависимости от задания проводят опыты по каустификации с одной и той же концентрацией исходного содового раствора при разных температурах либо при одной и той же температуре, но при различной концентрации соды в исходных растворах.
После окончания опыта останавливают мешалку, выключают нагрев термостата, удаляют реакционный сосуд из термостата.
Анализ растворов, получаемых в результате каустификации
Определение общей щелочности. Определение суммы
NaOH и Nа2СОЗ производят титрованием пробы анализируе-
58
мой жидкости соляной кислотой в присутствии метилового оранжевого. Для этого отбирают из мерной колбы пипеткой 5 мл раствора и помещают в коническую колбу вместимостью 250 мл, добавляют 50 мл дистиллированной воды, 2–3 капли метилового оранжевого и титруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в розовую. Количество (а, мл) соляной кислоты, пошедшее на титрование пробы, отвечает общей щелочности, т.е. сумме NaOH + Nа2СО3.
Определение концентрации гидроксида натрия. При при-
бавлении раствора хлорида бария к жидкости, содержащей едкий натр и карбонат натрия, ион CO32− осаждается с образованием нерастворимого карбоната бария по реакции
Ва2+ + CO32− = ВаСО3↓
При титровании осажденной пробы соляной кислотой в присутствии фенолфталеина можно найти содержание ионов ОН–, эквивалентное первоначальному содержанию NaOH в пробе.
Это титрование следует вести весьма осторожно, не оставляя долго раствор на воздухе и не взбалтывая его по следующим причинам: раствор, содержащий ионы ОН– и Ва2+, поглощает из воздуха диоксид углерода, в результате чего может уменьшиться определяемое количество NaOH; осадок ВаСО3 может частично реагировать с соляной кислотой.
Для определения едкого гидроксида натрия 5 мл раствора из мерной колбы отбирают пипеткой в коническую колбу вместимостью 250 мл, добавляют 50 мл дистиллированной воды
и2 мл 10%-го раствора хлорида бария. После осаждения карбоната бария к пробе добавляют 3–4 капли фенолфталеина
итотчас же титруют 0,1 н. раствором соляной кислоты при осторожном перемешивании.
Объем соляной кислоты (b, мл), пошедший на титрование пробы, отвечает содержанию в ней гидроксида натрия:
59
CNaOH = b 0,004 K 1000 10 |
, |
5 |
|
где CNaOH – концентрация NaOH в растворе, г/л; b – объем 0,1 н. раствора HCl, пошедший на титрование, мл; 0,004 – количество
NaOH, соответствующее 1 мл точно 0,1 н. раствора HСl, г; K – коэффициент поправки.
Определение концентрации карбоната натрия. Концен-
трацию карбоната натрия в пробе вычисляют как разность между общей щелочностью раствора и содержанием в нем гидроксида натрия, т.е. содержание в пробе карбоната натрия отве-
чает (а – b) мл 0,1 н. раствора соляной кислоты: |
|
|
Cр |
= (а− b) 0,0053 K 1000 10 |
, |
Na2CO3 |
5 |
|
|
|
|
где CNaр 2CO3 – концентрация Nа2СОЗ в растворе, г/л; 0,0053 –
количество Nа2СО3, соответствующее 1 мл точно 0,1 н. раствора HCl; K – коэффициент поправки.
По полученным аналитическим данным рассчитывают степень каустификации по формуле
a = |
CNaисхCO |
3 |
− CNaр |
CO |
100 %, |
2 |
|
2 3 |
|||
Cисх |
|
||||
|
|
|
|||
|
|
Na2CO3 |
|
|
|
где СNaисх2CO3 – концентрация Nа2СО3 в исходном содовом рас-
творе, г/л; CNaр 2CO3 – концентрация Nа2СО3 в растворах, полу-
чаемых при каустификации (через 15, 30, 45, 60 мин), г/л. Результаты работы оформляют в виде таблицы.
60
