
Лабораторный практикум по общей химической технологии
..pdfгде Хоч – где степень очистки, %; С0 – содержание загряз-
няющего компонента в исходном растворе; Сi – содержание загрязняющего компонента в пробе фильтрата.
Экспериментальные данные представить в виде графических зависимостей степени очистки от объема пропускаемой воды.
Определение обменной емкости катионита
В лабораторной работе используется катионит в Н-форме. Н-катионирование служит для глубокого умягчения воды. Обмен катионов протекает по реакциям:
2 Н(кат.) + СаCl2 → 2 HCl + Ca (кат.), 2 Н(кат.) + MgCl2 → 2 HCl + Mg (кат.), 2 Н(кат.) + CaCO3 → H2CO3 + Ca (кат.).
Когда ионы Н+ вытеснены, начнется проскок ионов Са2+ и Mg2+, и жесткость воды после фильтров будет постепенно подниматься до жесткости исходной воды. Для восстановления умягчающей способности катионита его регенерируют растворами хлорида натрия или кислоты.
Методика определения жесткости воды. В коническую колбу на 250 см3 помещают 5 см3 анализируемой воды, добавляют 10 см3 буферного раствора и 2–3 капли индикатора хром темно-синий. Раствор титруют 0,01 н. раствором трилона Б до перехода окраски из розового в синий цвет.
Концентрацию ионов кальция или магния рассчитывают по формуле
= V N 1000
CCa a ,
где ССа – кальцевая жесткость воды, мг-экв/дм3; V – объем раствора трилона Б, пошедший на титрование, см3; N – нормальность раствора трилона Б; а – аликвота пробы, см3.
31
Результаты записываются в табл. 2.
|
|
|
Таблица 2 |
Результаты работы Н-катиона |
|||
|
|
|
|
Жесткость исходной |
Объем пропущенной |
Жесткость воды |
|
|
3 |
3 |
после катионита, |
воды, мг-экв/дм |
|
воды, см |
мг-экв/дм3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обработка результатов. Обработку результатов проводят по формулам (3)–(5), при этом вместо концентрации ионов хлора подставляют концентрацию ионов кальция и магния.
Определение кислотности (аналогично определению щелочности).
Контрольные вопросы
1.Применение воды в химической промышленности.
2.Характеристика атмосферных, поверхностных и подземных вод.
3.Характеристика примесей, содержащихся в воде. Их отрицательное воздействие на технологические процессы.
4.Жесткость воды, виды жесткости.
5.Очистка воды от механических и коллоидных примесей.
6.Химические методы умягчения воды.
7.Физико-химические методы умягчения воды.
32
Список литературы
1.Гребенюк В.Д. Обессоливание воды ионитами. – М.:
Химия, 1980. – 256 с.
2.Теоретические основы деминерализации пресных вод / М.М. Сенявин, Р.Н. Рубинштейн [и др.]. – М.: Наука, 1988. – 324 с.
3.Практикум по общей химической технологии / под ред. И.П. Мухленова. – М.: Высшая школа, 1979. – 421 с.
33
Лабораторная работа № 4
КАРБОНИЗАЦИЯ AMМИАЧНО-СОЛЕВОГО РАСТВОРА
Цель работы – лабораторное изучение процесса карбонизации аммиачно-солевого раствора; исследование влияния времени, состава газа и температуры на степень карбонизации аммиачно-солевого раствора.
Теоретические сведения
Большинство химических реакций, используемых в хими- ко-технологических процессах, протекает с участием веществ, находящихся в разных фазах (газ – жидкость, газ – твердое вещество, твердое вещество – жидкость и т.д.). Такие процессы называются гетерогенными.
Вэтих системах химическая реакция является одной из стадий гетерогенного процесса и протекает после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность.
Вобщем виде механизм гетерогенного процесса можно представить состоящим из следующих стадий:
1) диффузия реагентов к поверхности раздела фаз;
2) химическая реакция, происходящая на поверхности раздела фаз;
3)десорбция или обратная диффузия продуктов реакции
вреакционный объем.
Скорость гетерогенных процессов в общем виде описыва-
ется уравнением
ϑ= K F ∆C,
где K – константа скорости реакции; F – поверхность контакта фаз; ∆C – движущая сила процесса.
Помимо основных факторов увеличения скорости процесса (температура, давление, концентрация реагентов) необходимо создать развитую поверхность контакта фаз.
Аммиачный способ получения соды заключается в насыщении раствора поваренной соли (305–310 г/л) аммиаком до концентрации NH3 около 85 г/л. Полученный аммонизированный рассол подвергают карбонизации в барботажных карбонизационных колоннах, в которых газ, содержащий до 45–50 % СО2, барботирует через столб жидкости, подаваемой сверху колонн. Для карбонизации используют газ из печей обжига известняка (печной газ) в смеси с газом печей кальцинации бикарбоната натрия (сушильный газ). Процессы, происходящие при карбонизации аммонизированного рассола, можно представить следующим суммарным уравнением:
NaCl + NH3 + CO2 + H2O = NaHCO3 + NH4Cl,
NH3 + CO2 + H2O = NH 4 НCO3 ,
NH4HCO3 + NaCl = NaHCO3 + NH4Cl.
Бикарбонат натрия, выпадающий в осадок, отделяют от маточного раствора на вакуум-фильтрах и прокаливают в печах, получая кальцинированную соду:
2NaHCO3 = Na2CO3 + H2O + CO2.
Процесс карбонизации аммиачно-солевого раствора является основной, центральной операцией в производстве соды, и от условий проведения карбонизации зависит выход и качество продукции.
В данной работе рассмотрена система газ – жидкость на примере абсорбции диоксида углерода аммонизированным раствором (поглотитель) с образованием твердой фазы.
Установка для процесса карбонизации аммиачно-солевого раствора представлена на рис. 1. Карбонизатором 4 служит стеклянный сосуд, снабженный барботирующим устройством
35
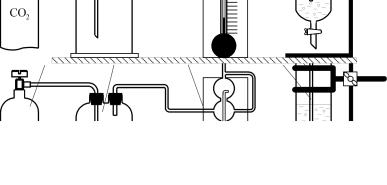
для подачи газа – диоксида углерода. Отбор пробы осуществляют через кран, расположенный в нижней части карбонизатора.
Рис. 1. Схема установки для карбонизации аммиачко-солевого раствора: 1 – баллон с диоксидом углерода; 2 – буферный сосуд; 3 – реометр; 4 – карбонизатор; 5 – трубка для подачигаза; 6 – штатив
Методика проведения работы заключается в следующем: в карбонизатор 4 заливают аммонизированный рассол заданной концентрации. Затем в реактор подают диоксид углерода из баллона через буферную емкость. Подача газа в карбонизатор 4 служит началом проведения опыта. Расход газа фиксируют реометром 3 и поддерживают его постоянным во все время проведения опыта. Через равные промежутки времени (задает преподаватель) отбирают пробы жидкости (2–5 мл) на анализ. Перед отбором пробы образовавшиеся в процессе карбонизации кристаллы бикарбоната натрия отделяют от жидкой фазы фильтрованием.
Приготовление аммонизированного рассола
Для проведения процесса карбонизации необходим аммонизированный раствор хлорида натрия состава 250–300 г/л NaCl и 80–90 г/л NH3. Аммиак вводят в раствор в виде амми-
36
ачной воды. Расчет количества аммиака проводят согласно основному уравнению реакции и содержанию хлорида натрия в исходном растворе. При этом необходимо учитывать концентрацию аммиака в аммиачной воде и плотность раствора аммиачной воды.
Методика обработки экспериментальных данных
Определение свободного и полусвязанного аммиака по ме-
тоду прямого титрования. Метод заключается в титровании пробы анализируемой жидкости сильной кислотой в присутствии метилового оранжевого. При этом свободный и полусвязанный аммиак нейтрализуется кислотой:
NH4OH +HCl = NH4Cl +H2O,
NH4HCO3 +HCl = NH4Cl +H2O +CO2 ,
(NH4)2CO3 + 2HCl = 2NH4Cl +H2O +CO2 .
Для анализа 1 см3 анализируемой жидкости отбирают пипеткой в заранее приготовленную коническую колбу с 40– 50 см3 дистиллированной воды и 2–3 каплями метилового оранжевого и титруют 0,1 или 1 н. раствором НСl (до перехода желтой окраски в розовую).
Содержание свободного и полусвязанного аммиака в растворе (г/л) вычисляют по формуле
NH3св = |
α 0,017 N 1000 |
, |
|
1 |
|
где α – количество кислоты, пошедшее на титрование, см3; 0,017 – количество NH3, соответствующее 1 см3 0,1 н. раствора кислоты, г; N – нормальность раствора.
Определение общего содержания аммиака по методу об-
ратного титрования. Метод заключается в обработке пробы раствора, в которой перед этим определялся прямой титр, из-
37
бытком титрованного раствора сильного основания, например NaOH, в результате чего связанный аммиак переходит в свободный:
NH4Cl + NaOH = NaCl + NH4OH,
(NH4 )2 CO3 + NaOH = Na2CO3 + NH4OH.
После отгонки свободного аммиака из раствора кипячением непрореагировавший избыток сильного основания титруют кислотой.
Нейтральный раствор, полученный после предыдущего определения прямого титра (из 1 см3 анализируемого раствора), разбавляют дистиллированной водой до примерно 100 см3 и прибавляют 50 см3 титрованного 0,1 н. раствора NaOH. После этого раствор кипятят до исчезновения запаха аммиака и затем оттитровывают избыток раствора едкого натра 0,1 н. раствором НС1 в присутствии метилового оранжевого.
Содержание NH3oбщ (г/л) составляет:
NH3общ = |
(50 −α) 0,017 1000 |
, |
|
1 |
|
где α – количество 1 н. раствора НСl, пошедшее на титрование, см3.
Определение диоксида углерода в растворе газообъемным методом. При определении диоксида углерода по этому методу определенный объем анализируемого раствора обрабатывают 10%-м раствором серной кислоты и измеряют объем выделившегося диоксида углерода.
Схема установки для анализа раствора на содержание диоксида углерода представлена на рис. 2.
Реакционный сосуд 5 – это коническая колба, в которую помещают точно отобранную пипеткой пробу жидкости в количестве 1–2 мл. Реакционный сосуд соединен с измерительной бюреткой, в которой измеряется объем выделившегося ди-
38
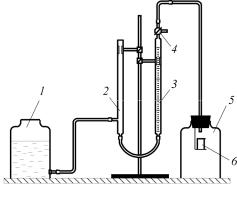
оксида углерода. Компенсационная трубка 2 и уравнительная склянка 1 заполнены насыщенным раствором хлорида натрия, в который добавлено несколько капель кислоты и метилового оранжевого.
Рис. 2. Прибор для определения содержания диоксида углерода в растворе: 1 – уравнительная склянка; 2 – компенсационная трубка; 3 – бюретка; 4 – трехходовой кран; 5 – реакционный сосуд; 6 – стаканчик
Подача кислоты для разложения пробы осуществляется из пробирки с отверстиями. Колбу закрывают пробкой, сообщают ее при помощи крана с измерительной бюреткой и встряхивают таким образом, чтобы кислота вылилась из пробирки и смешалась с пробой раствора. Для полноты разложения необходимо колбу встряхивать несколько раз. Образующийся при этом диоксид углерода переходит в измерительную бюретку. Окончание реакции фиксируется визуально – по установлению постоянного уровня жидкости в бюретке 3.
Объем выделившегося диоксида углерода (V) пересчитывают на объем сухого газа (V0) при 0 °С и 760 мм рт. ст. по формуле
V = V 273 (P − p) |
, |
|||
0 |
760 |
(273 |
+ t) |
|
|
|
|||
39
где V – объем выделившегося диоксида углерода, мл; P – барометрическое давление при измеренной температуре, мм рт. ст.;
p – давление паров воды при |
измеренной |
температуре, |
||
мм рт. ст.; 760 – нормальное давление, мм рт. ст.; |
t – темпера- |
|||
тура, °С. |
|
|
|
|
Содержание диоксида углерода ( GCO2 (г/л)) рассчитывают |
||||
по формуле |
|
|
|
|
GCO2 = |
1000 V0 |
44 |
, |
|
22410 |
n |
|
||
|
|
|
||
где n – объем анализируемой жидкости, мл.
Значения давления паров воды над насыщенным раствором хлорида натрия для различных температур берут из справочной литературы.
Степень карбонизации раствора К (%) вычисляется как отношение количества диоксида углерода в карбонизованном растворе (г/л) к содержанию аммиака в исходном растворе
(г/л):
К = [CO2 ]:[NH3 ] 100,
Степень использования аммиака определяют по формуле
U |
NH3 |
= |
[NH3 ]св |
100, |
|
|
|||||
|
[NH3 |
]общ |
|
||
|
|
|
|||
где [NH3 ]cв – содержание связанного аммиака в растворе, г-экв/л; [NH3 ]общ – содержание общего аммиака в растворе,
г-экв/л.
Для расчета степени использования аммиака по указанной формуле в нее подставляют данные анализа по содержанию связанного и общего аммиака в растворе.
Полученные экспериментальные данные заносят в таблицу.
40
