
ИздательствоКазанский национальный исследовательский технологический университетISBNГод2006Страниц15Уровень образованияБакалавриат, Магистратура. Современные проблемы специальной технической химии
.pdfУправление промышленности боеприпасов и спецхимии Федерального агентства по промышленности Научный совет РАН по химии, технологии и применению энергонасыщенных конденсированных систем Научный совет РАН по горению и взрыву
Академия наук Республики Татарстан Республиканское химическое общество им. Д.И. Менделеева Казанский государственный технологический университет
Современные проблемы специальной технической химии
Материалы докладов Международной научно-технической и методической конференции
(6-8 декабря 2006 года)
Казань – 2006
УДК 662.1:662.2:662.3
Современные проблемы специальной технической химии: Матер. докл. Казан.
гос. технол. ун-т. Казань, 2006. с
Представлены материалы докладов, заслушанных на Международной научно- технической и методической конференции «Современные проблемы специальной тех- нической химии», проведенной Управлением промышленности боеприпасов и спецхи- мии Федерального агентства по промышленности, Научным советом РАН по химии, технологии и применению энергонасыщенных конденсированных систем, Научным советом РАН по горению и взрыву, Академией наук Республики Татарстан, Республи- канским химическим обществом им.Д.И.Менделеева, Казанским государственным технологическим университетом 6-8 декабря 2006 года.
В докладах отражены результаты экспериментальных и теоретических исследова- ний в области специальной технической химии и конверсии.
Сопредседатели конференции
С.Г.Дьяконов, Ф.П.Мадякин, Ю.М.Михайлов, Г.В.Сакович.
Программный комитет
С.Г.Дьяконов (председатель), В.П.Барабанов, А.А.Берлин, Э.С.Бука, Н.М.Вареных, М.Б.Генералов, А.С.Дудырев, В.Ф.Жилин, Л.В.Забелин, В.В.Калашников, Е.В.Калганов, Ф.П.Мадякин, Б.В.Мацеевич, А.Г.Мержанов, Ю.М.Михайлов, Э.Ф.Охрименко, Г.В.Сакович, В.А.Тартаковский, А.Ю.Цевадзе, Е.С.Шахиджанов, И.А.Якушев.
Оргкомитет
Ф.П.Мадякин (председатель), В.Н.Аликин, Х.З.Гиниятов, Д.Б.Демьяненко, А.П.Денисюк, В.П.Ильин, В.Ф.Комаров, И.В.Крауклиш, Н.И.Лаптев, А.Н.Липанов, Н.А.Лебедев, В.Ю.Мелешко, С.А.Поваров, Н.Г.Пузырев, М.С.Резников, Г.В.Романов, А.Е.Салько, В.Ф.Сопин, В.Н.Стрельников, Ю.В.Фролов, В.А.Харитонов, И.В.Целинский, И.Н.Шакиров, Н.А.Шахов, Н.А.Шумилов, Р.С.Яруллин.
Секретариат
Т.И.Копьева, И.А.Маркелова, Н.А.Тихонова.
Проведение конференции поддержали:
ИПХЭТ СО РАН, г.Бийск; РХТУ им. Д.И.Менделеева, г.Москва; СПТИ, г.Санкт- Петербург; Сам.ГТУ, г.Самара; Сиб.ГТУ, г.Красноярск; БТИ, г.Бийск; МГУИЭ, г.Москва; Военная академия РВСН, г.Москва; ОАО «Техническая химия», г.Москва; ФГУП КНИИМ, г.Пушкино; ФГУП «Кристалл», г.Дзержинск; ФГУП НИИХП, г.Казань; ОАО «Татнефтехиминвест-холдинг»; НИИПМ, г.Пермь; ФГУП «ЧПО им.В.И.Чапаева», г.Чебоксары; Казанский казенный пороховой завод
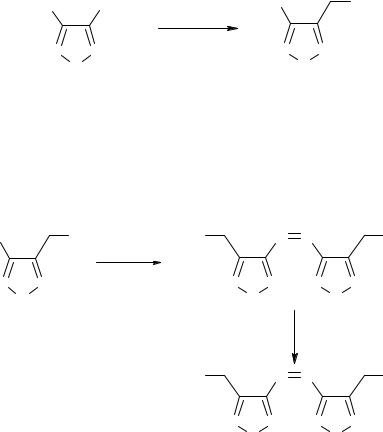
3-АМИНО-4-ГИДРОКСИМЕТИЛФУРАЗАН В СИНТЕЗЕ ЭНЕРГОЁМКИХ СО- ЕДИНЕНИЙ
Е. К. Когачева, В. Г. Нестеров, С. Д. Шапошников, С. Ф. Мельникова, И. В. Целинский.
Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский пр., 26. E-mail: shapsd@rambler.ru
В химии гетероциклических соединений весьма активно развивается класс произ- водных фуразана. Это связано с открытием практически интересных свойств этих со- единений, начиная с различных видов биологической активности и кончая высокоэнер- гетическими характеристиками. Особое внимание исследователей привлекают произ- водные фуразанов, содержащие реакционоспособные заместители, которые необходи- мы для построения различных полигетероциклических систем. Поэтому, разработка препаративного способа получения 3-амино-4-гидроксиметилфуразана (1) и изучение его реакционоспособности представляет значительный интерес. Анализ литературных данных показал, что исходными соединениями для синтеза гидроксиметилфуразанов могут служить соответствующие сложные эфиры фуразанкарбоновых [1]. Поэтому, в качестве исходного синтона нами был выбран метиловый эфир 3-аминофуразан-4- карбоновой кислоты (2), при восстановлении которого боргидридом натрия в этаноле получен 3-амино-4-гидроксиметилфуразан (1) почти с количественным выходом (96%).
H N |
COOMe |
NaBH4 |
H2N |
|
OH |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
EtOH |
N |
N |
|
2 |
|
1 |
||||
O |
|
|
O |
|
||
Гидроксиметильное производное (1) представляет собой белый легкоплавкий кристал- лический продукт (т. пл. 41-420С), хорошо растворяющийся в воде, спирте, полярных органических растворителях и плохо в хлорорганических растворителях. 3-Амино-4- гидроксиметилфуразан (1) содержит 2 реакционоспособные функциональные группы, которые можно использовать для построения различных гетероциклических систем.
Окисление 3-амино-4-гидроксиметилфуразана (1) гипохлоритом натрия в вод-
ной среде приводит к 3,3΄-бис(гидроксиметил)-4,4΄-диазенофуразану (3) с выходом
80%.
H2N |
OH |
NaOCl |
HO |
N |
N |
OH |
|
|
|
|
|
|
|
N N |
1 |
H2O |
N |
N |
N |
N |
O |
|
O |
|
O |
3 |
|
|
|
|
|
|
NO+ |
|
|
|
|
|
|
2 |
|
|
|
|
O2NO |
N |
N |
ONO2 |
|
|
|
N |
N |
N |
N 4 |
|
|
|
O |
|
O |
|
Необходимо отметить, что окисления гидроксиметильной группы в этих условиях не наблюдается, даже при увеличении количества окислителя и времени выдержки. Нит-
рование азосоединения позволяет получить соответствующее нитроксиметильное про- изводное (4).
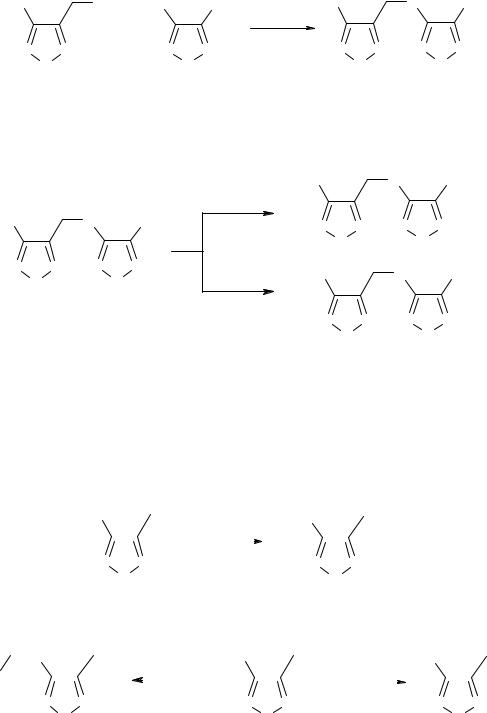
Спирт (1) в присутствии поташа вступает в реакцию нуклеофильного замещения с 3-амино-4-нитрофуразаном (5) с образованием 3-амино-4-(4-аминофуразан-3- илоксиметил)фуразана (6) с выходом 78%.
H2N |
OH O2N |
NH2 |
K2CO3 |
H2N |
|
O |
NH2 |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
ДМФА |
N O |
N |
N O N 6 |
||
N O N |
|
N O N 5 |
||||||
1 |
|
|||||||
Наличие двух NH2-групп в последнем, способствует синтезу различных высоко- энергетических соединений. При окислении диамина (6) концентрированной переки- сью водорода в трифторуксусной кислоте получено динитропроизводное (7) с выходом
73%, а при нитровании концентрированной азотной кислотой – нитрамин (8) с выходом
55%.
|
|
|
H2O2 |
O2N |
|
O |
NO2 |
|
|
|
|
|
|
|
|
|
|
H2N |
O |
NH |
ТФУК |
N |
N |
N |
N |
7 |
|
|
2 |
||||||
|
|
|
|
|
O |
|
O |
|
N O N |
N O N 6 |
HNO3 |
O2NHN |
|
O |
NHNO2 |
||
|
|
|
|
N |
N |
N |
N |
8 |
|
|
|
|
|
O |
|
O |
|
Эфир (7) представляет собой белое кристаллическое соединение с т. пл. 71-72ºС, d 1,79 г/см3. Обладает низкой чувствительностью к удару (10 кг, 25 см) – 20%, нижний предел чувствительности к трению > 4000 кг/см2. Он достаточно термически устойчив: по дан- ным ДТА при температуре 220ºС наблюдается некоторая потеря веса за счёт испарения, разложение же наступает при температуре > 250ºС.
Ацилирование спирта (1) избытком уксусного ангидрида при комнатной темпе- ратуре в условиях кислотного катализа идёт как по NH2, так и по СH2ОН-группе с об- разованием 3-ацетамидо-4-ацетоксиметилфуразана (9) с выходом 75%.
H2N |
|
|
OH |
|
|
|
H |
|
|
|
||
|
|
Ac2O |
Ac |
|
N |
|
|
OAc |
||||
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
H+ |
|
|
N |
N |
||||||
|
O |
1 |
|
|
|
|
O |
9 |
||||
3-Амино-4-гидроксиметилфуразан (1) при кипячении реагирует с хлористым тио- нилом. 3-Амино-4-хлорметилфуразан (10) выделен с выходом 92%. В присутствии N,N-
диметилформамида во взаимодействие вступает и аминогруппа. |
|
|
|
|
|
||||||||||||||
|
|
|
N |
|
|
|
Cl |
SOCl2 |
H2N |
|
|
OH |
SOCl |
H2N |
|
|
Cl |
||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Me2N |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
ДМФА |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
N |
|
N |
|
|
N |
N |
|
N |
N |
|||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
O |
|
|
|
|
O |
1 |
|
|
O |
10 |
|||||
Можно предположить, что в аминофуразане (10) атом хлора будет достаточно подвижен в реакциях с нуклеофилами. В тоже время необходимо отметить, что соеди- нение (10) гидролитически стабильно: при хранении на воздухе и кристаллизации из воды не гидролизуется.
Изучение взаимодействия 3-амино-4-хлорметилфуразана (10) с азидом натрия по- казало, что реакция нуклеофильного замещения протекает в вводно-спиртовой среде с образованием 3-азидометил-4-аминофуразана (11) с выходом 86%.
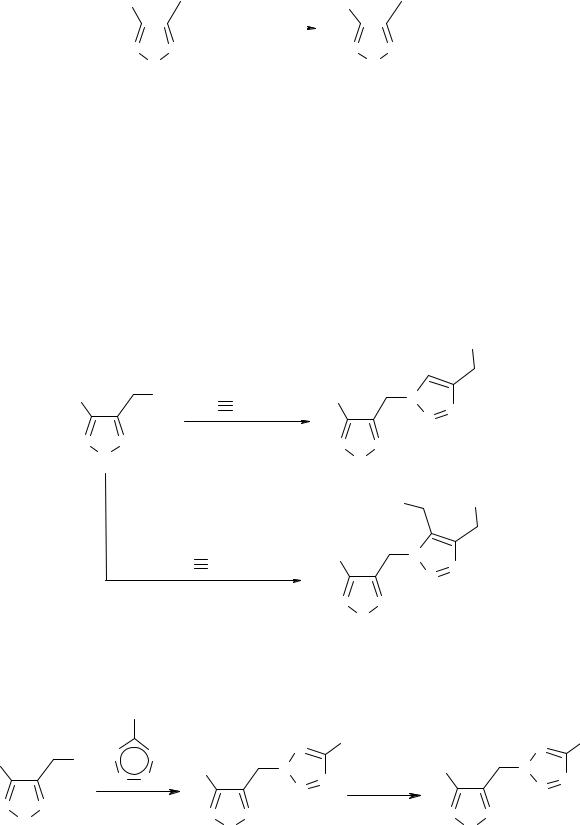
H2N |
|
|
Cl |
NaN3 |
H2N |
|
|
N3 |
||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
EtOH-H2O |
N |
N |
||||||
|
O |
10 |
|
|
O |
11 |
||||
По данным дифференциальнотермического анализа 3-азидометил-4-
аминофуразан (11) плавится при 550С и уже при ~750С начинает интенсивно испарять- ся.
Нами изучено поведение 3-азидометил-4-аминофуразана (11) в реакциях 1,3- диполярофильного циклоприсоединения с 1,4-бутиндиолом и пропаргиловым спиртом. Установлено, что взаимодействие азида (11) с 1,4-бутиндиолом в кипящем толуоле проходит за 2 ч. Целевой 3-амино-4-(4,5-бис(гидроксиметил)-1,2,3-триазол-1- илметил)фуразан (12) выделен с выходом 60%. В аналогичных условиях с пропаргило- вым спиртом образуется смесь двух изомеров 4(5)-гидроксиметильных производных 1,2,3-триазола в соотношении 5:4. Проведение синтеза в системе трет-бутиловый спирт
– вода при комнатной температуре в присутствии аскорбината меди привело к единст- венному продукту циклоприсоединения – 3-амино-4-(4-гидроксиметил-1,2,3-триазол-1- илметил)фуразану (13) с выходом 54%. Образования другого изомера виц-триазола в реакционной массе не удалось зафиксировать.
|
|
|
|
|
|
|
|
OH |
H2N |
N3 |
|
HC |
CCH2OH |
H2N |
|
N |
N |
|
|
|
|
|
N |
|||
N |
N |
|
|
CuAsc |
N |
N |
|
|
|
t-BuOH-H2O |
13 |
||||||
O |
11 |
O |
|
|||||
|
|
|
|
|
|
HO |
|
OH |
|
HOCH2C |
CCH2OH |
H2N |
|
N |
N |
||
|
|
|
N |
|||||
|
|
толуол |
N |
N |
|
|
||
|
|
|
|
|
12 |
|||
|
|
|
|
|
O |
|
||
|
|
|
|
|
|
|
|
|
Нагревание 3-амино-4-хлорметилфуразана (10) с тетрагидратом натриевой соли 5- нитротетразола в ДМФА приводит к 3-амино-4-(5-нитротетразол-2-илметил)фуразану (14). Соответствующее динитропроизводное (15) получено окислением последнего концентри- рованной перекисью водорода в трифторуксусной кислоте.
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
H N |
|
Cl N |
- N |
|
|
|
N |
|
NO2 |
|
|
|
N |
NO2 |
|
|
H2N |
|
|
N |
|
|
O2N |
|
|
N |
|
||||
2 |
|
|
N |
N |
|
|
N |
H2O2 |
|
|
N |
||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
N |
|
|
|
N |
|||||
N |
N |
|
|
|
|
|
|
|
|
|
|
|
|
||
10 |
ДМФА |
N |
|
N |
14 |
|
ТФУК |
N |
|
N |
15 |
|
|||
O |
|
O |
|
O |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Тетразол (15) обладает достаточно высокой чувствительностью к удару (10 кг, 25 см) –
96%, имеет т. пл. 70-71°С и по данным ДТА быстро разлагается при температуре выше 185°С. Расчётная плотность 1,85 г/см3.
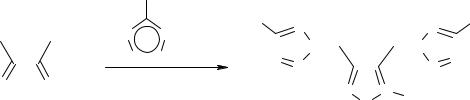
3,4-Бис(5-нитротетразол-2-илметил)фуроксан (16), полученный из
бис(бромметил)глиоксима (17) по нижеследующей схеме, ещё более чувствителен к удару (3 см, 10 кг – 100%) и плавится с бурным разложением при 163-165°С.
|
|
|
|
|
|
|
|
|
NO2 |
|
O2N |
N |
|
|
|
|
|
|
|
|
|
N |
|
NO2 |
||
Br |
|
|
|
|
|
Br |
N - |
N |
+ |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Na |
|
|
N |
|
|
|
|
|
|
N |
|
|
|
||||||||||||
|
|
|
|
|
|
|
N |
|
N |
N |
|
|
|
|
|
|
|
N |
||||||||
|
|
|
|
|
|
|
1. ДМФА, 100оС |
N |
|
|
|
|
+ |
|
|
|
N |
|||||||||
HON |
NOH |
|
|
|
|
|
|
|
||||||||||||||||||
|
N N |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
17 |
|
|
|
2. N O , эфир |
|
|
|
|
|
O |
|
|
16 |
|
||||||||||||
|
|
|
2 |
|
4 |
|
|
|
|
|
|
O |
|
|
|
|
|
|
||||||||
ЛИТЕРАТУРА.
1.Блиннников А. Н., Куликов А. С., Махова Н. Н. и др.// Изв. АН. Сер. хим. – 1996. –
№7. – С. 1782.
4-НИТРО-2-R-1,2,3-ТРИАЗОЛ-1-ОКСИДЫ. СИНТЕЗ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
С. Д. Шапошников, С. Ф. Мельникова, И. В. Целинский.
Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский пр., 26. E-mail: shapsd@rambler.ru
1,2,3-Триазол-1-оксиды и их производные, имеющие несколько реакционных цен- тров, являются интересными синтонами для целого ряда органических соединений. Они представляют также значительный интерес в качестве основы для построения раз- личных полиазотистых энергоёмких соединений. Вместе с тем, несмотря на вековую историю их открытия, химия производных этого класса гетероциклических соединений исследована сравнительно мало. Поэтому новые данные по методам синтеза и свойст- вам представителей 1,2,3-триазол-1-оксидов не только внесут определённый вклад в химию гетероциклических соединений, но и позволят более глубоко оценить возмож- ности их практического использования. В последнее время, наибольший интерес при- влекают нитропроизводные 1,2,3-триазол-1-оксидов [1-4]. Однако до сих пор не описа- ны препаративные методы синтеза 4-нитро-2-арил(гетарил)-1,2,3-триазол-1-оксидов. 4- Нитро-2-фенил-1,2,3-триазол-1-оксид (1а) может быть получен окислением фенилгид- разона (2а) гексацианоферратом (III) калия в щелочной среде [4]. Однако данный спо- соб малопригоден для препаративных целей, так как выход продукта (1а) не превышает 30% и необходима очистка его колоночной хроматографией. Модификация условий окисления, в частности замена гидроксида натрия на раствор аммиака и проведение ре- акции в водной среде, позволила нам существенно упростить процесс получения, ис- ключить колоночную хроматографию и повысить выход целевого соединения (1а) до
96%. В аналогичных условиях нами были синтезированы и другие 2-арил-4-нитро- 1,2,3-триазол-1-оксиды (1б-е) с высокими выходами (84-90%).
|
|
|
|
|
|
O2N |
|
|
|
|
|
|||
O2N |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
N |
N |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
O |
|
|
||||||
N |
|
|
NOH |
K3[Fe(CN)6] |
|
|
|
N |
1а-е |
|||||
|
|
|
|
|
|
|
||||||||
|
|
NH4OH |
|
|
|
R |
||||||||
|
NH |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
R |
|
2а-к |
|
|
O2N |
NH2 |
||||||||
|
|
|
|
|
|
|
|
|
N+ |
|
|
|||
|
|
|
|
|
|
N |
|
|||||||
|
|
|
|
|
|
O |
|
|||||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3ж-к |
||||
|
|
|
|
|
|
|
|
R |
||||||
R = Ph (a), 4-MeOC6H4 (б), 3-MeC6H4 (в), 2-MeC6H4 (г), 3-ClC6H4 (д),
H3C |
H2N |
|
|
||
4-ClC6H4 (е),4-NO2С6H4 (ж), 3-NO2C6H4 (з), |
|
|
(и), |
|
(к) |
|
|
|
|||
N N |
N |
|
N |
||
|
O |
|
O |
||
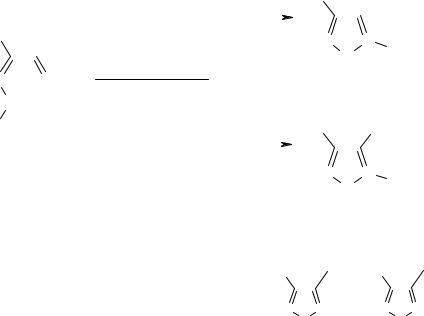
Однако введение в реакцию гидразоноксимов (2ж-к), содержащих в качестве за- местителей 4- или 3-нитрофенильную и 4-R-фуразан-3-ильные группы, привело к не- ожиданным результатам. В этом случае продуктами реакции оказались 5-амино-4-
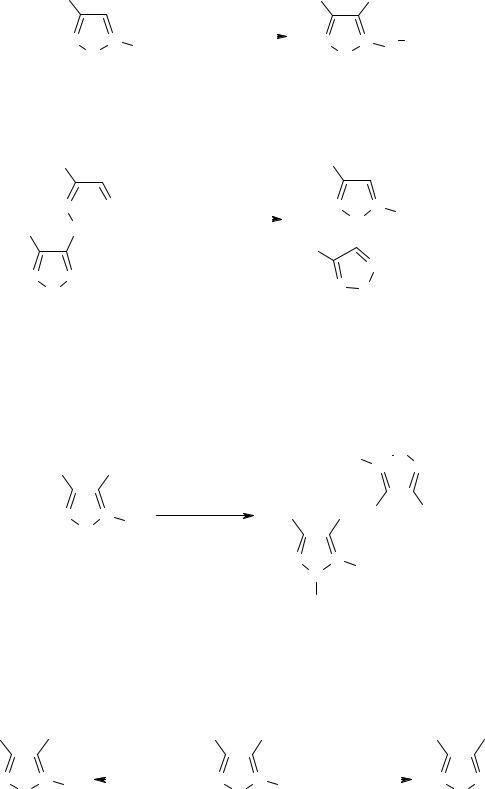
нитро-2-R-1,2,3-триазол-1-оксиды (3ж-к). Более того, при последовательной обработке в водно-спиртовой среде аммиаком и гексацианоферратом (III) калия 4-нитро-1,2,3-
триазол-1-оксиды (1а-е) превращаются в 5-амино-4-нитро-1,2,3-триазол-1-оксиды (3а-
е).
O2N |
|
|
|
|
|
O2N |
|
|
NH2 |
||
|
|
N+ |
|
|
|
1. NH4OH |
|
|
N+ O |
||
N |
|
|
|
|
N |
|
|
||||
|
|
|
|
||||||||
O |
|
|
|
|
|
||||||
N |
|
|
|
|
2. K3[Fe(CN)6] |
N |
|
||||
|
|
1а-е |
3а-е |
||||||||
|
|
||||||||||
R |
|
|
R |
||||||||
2-(4-R-Фуразан-3-ил)-4-нитро-1,2,3-триазол-1-оксиды (1и,к) были получены с хорошим выходом при окислении соответствующих гидрозоноксимов (2и,к) тетрааце- татом свинца в среде органического растворителя.
O2N |
|
|
|
|
O2N |
|
|
|
||
N |
NOH |
|
Pb(OAc)4 |
N N+ |
|
|||||
O |
|
|
||||||||
R |
NH |
|
|
|
N |
|
|
|
||
|
|
|
|
|
|
|||||
|
|
|
R |
|
|
|
|
|
||
|
2и,к |
|
|
|
|
N |
1и,к |
|||
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||
N N |
R = Me (и), NH2 (к) |
N O |
|
|
|
|||||
O |
|
|
|
|
||||||
Интересные результаты получены при изучении реакции окисления 5-амино-4- нитро-2-фенил-1,2,3-триазол-1-оксида (3а). Так, при обработке последнего водным рас- твором перманганата калия в 20%-ной серной кислоте при комнатной температуре с выходом 87% образуется соответствующее азосоединение (4), которое, как и следовало ожидать, отличается сравнительно низкой растворимостью в органических растворите- лях и достаточно высокой температурой плавления (218-219°С).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O2N |
NH2 |
|
|
|
|
|
O |
|
|
|
N+ N N |
|||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
N+ |
|
KMnO4 |
O2N |
|
N |
|
|
N |
|
|
NO2 |
||||
N |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
N |
O |
|
20% H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3а |
|
|
|
|
+ |
|
|
|
|
|
|
4 |
|
||
|
Ph |
|
|
N |
|
N |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
O |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
Ph
Окисление аминогруппы до нитро в триазол-N-оксиде (3а) протекает менее од- нозначно. Так, при действии на аминосоединение (3а) концентрированной перекисью водорода в 98%-ной серной кислоте в присутствии вольфрамата натрия при комнатной температуре, наряду с другими побочными продуктами, образуется 4,5-динитро-2- фенил-1,2,3-триазол-1-оксид (5) с выходом ~38%. Увеличение кислотности среды или повышение температуры приводит к снижению выхода целевого соединения (5)
O2N |
NO2 |
|
O2N |
NH2 |
|
|
|
O2N |
NO2 |
|||||||||||
|
|
|
N+ |
|
|
|
H2O2 конц |
|
|
|
|
N+ |
|
|
|
H2O2 конц |
|
|
|
N |
N |
|
|
|
|
N |
|
|
|
N |
|||||||||||
O |
|
|
H2SO4 |
|
O |
|
|
CF3COOH |
||||||||||||
|
N |
|
|
|
|
|
|
N |
|
|
|
|
|
N |
|
|||||
|
|
|
5 |
|
|
|
|
|
|
3а |
|
|
|
6 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Ph |
|
|
|
|
|
|
Ph |
|
|
|
|
Ph |
|||||||
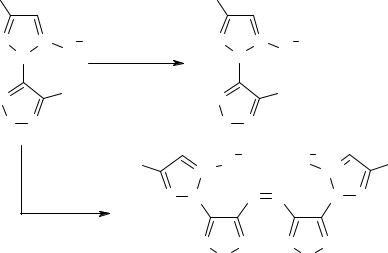
При проведении же окисления 5-амино-4-нитро-2-фенил-1,2,3-триазол-1-оксида (3а) в среде трифторуксусной кислоты, образования динитропроизводного (5) не уда- лось зафиксировать даже с помощью тонкослойной хроматографии. Основным продук- том реакции оказался 4,5-динитро-1,2,3-триазол (6). Такое направление реакции можно объяснить тем, что в средах с высокой кислотностью происходит протонирование ис- ходного (3а) по семиполярному кислороду и, вследствие этого, окисление протекает по аминогруппе. В непротонированном 5-амино-1,2,3-триазол-1-оксиде (3а) электрофил атакует в первую очередь N→O. Структура полученных соединений доказана с помо- щью спектроскопии ЯМР 1Н, 13С, ИК и подтверждена элементным анализом.
Более гладко протекает окисление аминогруппы при фуразановом цикле в про- изводном (1к). Обработка последнего концентрированной перекисью водорода в триф- торуксусной кислоте приводит к образованию 2-(4-нитрофуразан-3-ил)-4-нитро-1,2,3- триазол-1-оксида (7). При окислении же перманганатом калия в соляной кислоте полу- чен соответствующий диазен (8).
O2N |
|
|
|
O2N |
|
|
|
|
|
|
|
|
N |
N+ |
O |
H2O2 конц |
|
N |
N+ |
O |
|
|
|
|
|
|
N |
|
|
|
|
|
N |
|
|
|
|
|
N |
|
NH2 |
CF3COOH |
|
N |
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
O |
N |
1к |
|
|
O |
N |
7 |
|
|
|
|
|
|
|
|
O N |
N |
+ |
O |
O |
N |
+ |
NO |
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|||
|
KMnO4 |
N |
N |
|
|
N |
N |
N |
N |
|
||
|
HCl |
|
N |
|
|
N |
N |
N |
8 |
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
O |
|
O |
|
|
|
|
Таким образом, в работе описан простой способ получения 4-нитро-2-арил(гетерил)- 1,2,3-триазол-1-оксидов, которые могут представлять значительный интерес в качестве энергонасыщенных полиазотистых соединений.
ЛИТЕРАТУРА.
1.Годовикова Т. И., Игнатьева Е. Л., Голова С. П., Кузьмин В. С., Хмельницкий Л.
И.// ЖОрХ. - 1997. - Т. 33. - В. 8. - С. 1209-1215.
2.Годовикова Т. И., Возчикова С. А., Игнатьева Е. Л., Хмельницкий Л. И.,
Корсунский Б. Л.// ХГС. - 2003. - №4. - С. 548-551.
3.Годовикова Т. И., Возчикова С. А., Игнатьева Е. Л., Хмельницкий Л. И.,
Корсунский Б. Л.// ХГС. - 1999. - №10. - С. 1356-1362.
4.Шафеев М. А., Альмухамедов А. А., Щербаков В. В., Гареев Г. А., Верещагин Л.
И.// ЖОрХ. - 1994. - Т. 30. - В. 6. - С. 918-922.
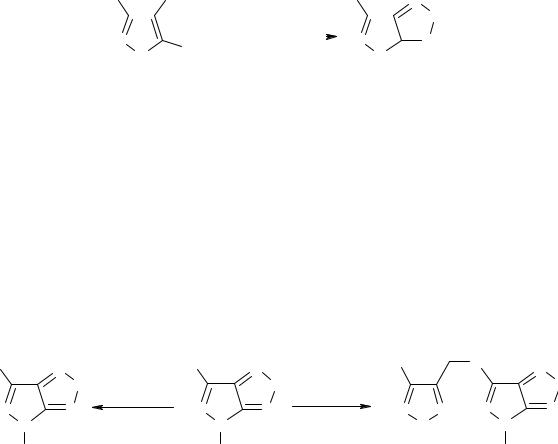
СИНТЕЗ И СВОЙСТВА 6-НИТРО-4-R-ПИРАЗОЛО[3,4-с]ФУРАЗАНОВ
Д. А. Зайцев, С. Д. Шапошников, С. Ф. Мельникова, И. В. Целинский.
Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский пр., 26. E-mail: shapsd@rambler.ru
Аннелирование фуразанового с другим пятичленным гетероциклом предполага- ет наличие значительной энергии напряжения в молекуле. Поэтому подобные структу- ры представляют определённый интерес, в том числе и для химии энергонасыщенных соединений [1]. В продолжение наших работ [2,3] по изучению пиразоло[3,4- c]фуразановой системы был синтезирован ряд новых производных этого класса гетеро- циклических соединений. Из литературы известно, что одним из основных методов создания подобных структур является окисление соответствующих 5-амино-4- нитрозопиразолов [1] гипохлоритом натрия. Изучение этой реакции на примере 5- амино-3-нитро-4-нитрозо-1-фенилпиразола (1) показало, что 6-нитро-4- фенилпиразоло[3,4-с]фуразан (2) образуется с максимальным выходом (75%) в среде водного тетрагидрофурана при комнатной температуре.
O2N |
NO |
O2N |
|
N |
||||||
|
|
|
|
NaOCl |
|
|
|
|
|
O |
N |
|
N |
||||||||
|
|
|
N |
|||||||
|
|
|
|
|||||||
NH2 ТГФ-H2O |
|
|
||||||||
|
N |
|
N |
|
|
|
||||
|
|
|
1 |
|
|
|
|
2 |
||
|
Ph |
|
Ph |
|||||||
Можно предположить, что в 6-нитро-4-фенилпиразоло[3,4-с]фуразане (2) нитро- группа будет достаточно подвижна в реакциях с нуклеофилами, вследствие сильного электроноакцепторного влияния фуразанового цикла.
Реакционноспособность нитрогруппы в соединении (2) изучена на примере его взаимодействия с О- и N-нуклеофилами. Так, при обработке пиразолофуразана (2) спиртовыми растворами гидроксида калия образуются соответствующие 6-метокси- (3а) и 6-этокси-4-фенилпиразоло[3,4-с]фуразаны (3б). Реакция протекает в достаточно мягких условиях (2-х часовое кипячение в спирте) и целевые соединения (3а,б) полу- чаются с хорошими выходами (81 и 86%, соответственно). Ещё одним интересным примером замещения нитрогруппы О-нуклеофилом в 6-нитро-4-фенилпиразоло[3,4- с]фуразане (2) служит взаимодействие последнего с 3-амино-4-гидроксиметилфураза- ном. 6-(4-Аминофуразан-3-илметокси)-4-фенилпиразоло[3,4-с]фуразан (4) синтезиро- ван с выходом 60% при проведении реакции в кипящем ацетоне (2 ч) в присутствии по-
таша. |
|
|
|
|
|
|
|
|
|
AlkO |
N |
|
O2N |
N |
H2N |
|
O |
N |
|
|
O |
KOH |
|
O |
K2CO3 |
|
|
O |
|
N |
N |
N |
N |
N |
N |
N |
|||
AlkOH |
N |
||||||||
N |
|
|
N |
ацетон |
O |
N |
|
||
Ph |
3а,б |
|
|
Ph 2 |
|
|
Ph |
4 |
Alk = Me (а), Et (б)
Относительно легко проходит взаимодействие пиразолофуразана и с азид- ионом. Так, кипячение (2) в водно-спиртовой среде с азидом натрия позволяет полу- чить 6-азидо-4-фенилпиразоло[3,4-с]фуразан (5) с выходом 92%. Нуклеофильное заме-
