
- •Аминокислоты, белки, ферменты
- •Задание 2. Определение аминных групп методом формольного титрования
- •Задание 3. Качественные реакции на белки
- •Задание 4. Фракционирование белков сульфатом аммония
- •Задание 5. Определение автолитической активности пшеничной муки
- •Задание 6. Определение активности каталазы муки
- •Задание 7. Качественная реакция на α-амилазу муки
- •Задание 8. Определение активности липаз
- •Липиды Задание 9. Качественные реакции на жиры и масла
- •Углеводы Задание 10. Выделение крахмала
- •Задание 11. Качественные реакции на сахара.
- •Витамины Задание 12. Качественные реакции на жирорастворимые витамины.
- •Витамин а
- •Витамин д
- •Задание 13. Качественная реакция на витамин с.
- •Задание 14. Колориметрическое определение витамина в2.
- •Нуклеиновые кислоты Задание 15. Получение нуклеопротеидов
- •Задание 16. Качественные реакции на вещества, входящие в состав нуклеопротеидов
- •Промежуточные продукты обмена веществ Задание 17. Обнаружение этилового спирта
- •Задание 18. Качественная реакция на альдегиды
- •Рекомендуемая литература
- •Оглавление
Задание 5. Определение автолитической активности пшеничной муки
Протеазы относятся к группе гидролаз, они катализируют гидролитическое расщепление белковых веществ по месту пептидных связей.
Реакция ферментативного гидролиза белков обратима. Протеазы принято подразделять на протеиназы и пептидазы. Протеиназы ведут гидролиз непосредственно нативных (природных) белков. Это папаин, трипсин, пепсин. При этом следует отметить, что они, кроме гидролиза белков, гидролизуют и различные полипептиды и депептиды. Пептидазы действуют только на пептиды и обладают специфичностью действия. Их действие на субстрат зависит от расположения в нем определенных химических группировок. По характеру своего действия они делятся на аминопептидазы и карбоксипептидазы.
Оборудование и реактивы: пшеничная мука, толуол, 0,1 н р-р NaОН, фенолфталеин – 0,1 %, глицин – 0,25 % р-р, формольная смесь, термостат, фильтр, весы, мерные колбы, конические колбы, пипетки на 2 и 5 мл, бюретка на 10 мл.
Ход работы. К 50 г пшеничной муки приливают 500 мл нейтрализованной воды (рН 7,0) и 0,5 мл толуола. Смесь инкубируют 1 ч при 37оС в термостате. Во время инкубации смесь тщательно перемешивают. Затем доводят до 1 л, фильтруют и в фильтрате определяют азот аминокислот формольным титрованием. Параллельно ставят контрольный опыт, в котором формольное титрование проводят до инкубирования.
Количество азота аминокислот (Х), образующегося при действии протеолитических ферментов, содержащихся в 100 г исследуемого продукта (мг), определяют по формуле:
Х =
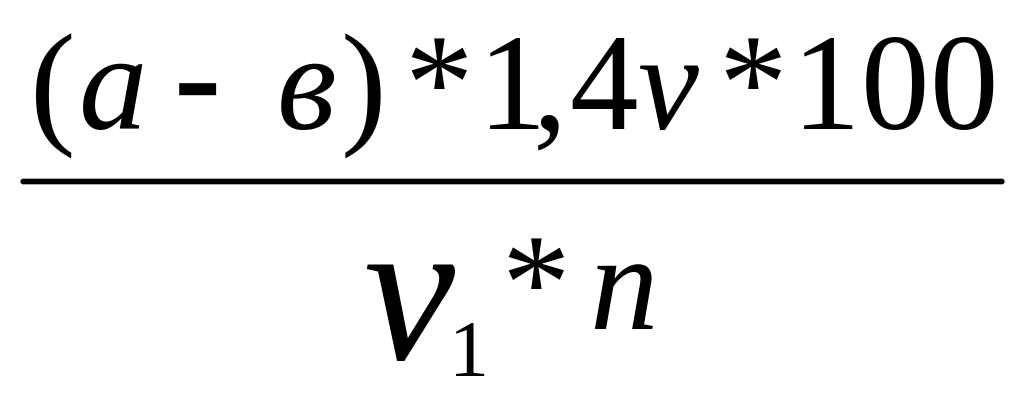
Где а – количество0,1 н раствора NaОН, пошедшее на титрование опыта, мл;
в – количество 0,1 н раствора NaОН, пошедшее на титрование контроля, мл;
V1 – количество фильтрата, взятого для определения аминного азота;
V – количество полученной болтушки (в мерной колбе), мл;
n – навеска исследуемого материала, г.
Задание 6. Определение активности каталазы муки
Каталаза разлагает перикись водорода по уравнению
2 Н2О2 2Н2О + О2
Перекись водорода – ядовитое для клеток вещество; она образуется в окислительно-восстановительном процессе при восстановлении молекулярного кислорода. Каталаза – двухкомпонентный фермент. Одним компонентом его является гематин, который представляет собой окисленную простетическую группу гемоглобина крови. Каталаза парализуется синильной кислотой, сероводородом, фторидами. Количественное определение каталазы основано на учете перекиси водорода путем титрования ее перманганатом калия. Реакция проходит по уравнению
2 КМnO4+ 5 Н2О2 + 4 Н2SО4 2 КН SО4 + 2 Мn SО4 + 8 Н2О + 5 О2
О количестве перекиси водорода, разрушенной ферментом, судят по разности количества (мл) 0,1 КМnO4, израсходованного для титрования в контрольном и рабочем опытах.
Оборудование и реактивы: 1 % р-р перекиси водорода, 0,1 н р-р КМnO4, 10 % р-р Н2SО4, мука, аналитические весы, колбы конические, фильтры, колбы мерные на 100 мл, горелки.
Ход работы. Отвешивают на аналитических весах 2 г муки и помещают в мерную колбу на 100 мл. В колбу приливают дистиллированную воду, перемешивают, добавляют 2-3 капли толуола, доводят до метки и смесь настаивают 2 ч при комнатной температуре. После настаивания жидкость отфильтровывают через складчатый фильтр и в фильтре сразу же определяют каталазу. Отбирают четыре пробы прозрачного фильтрата по 20 мл каждая: 2 опытные и две контрольные; последние кипятят 5 мин для инактивации фермента. К опытным и контрольным пробам прибавляют по 20 мл дистиллированной воды, по 3 мл 1 % перикиси водорода, предварительно нейтрализованной 0,1 н раствором NaОН, и сотавляют на 30 мин при комнатной температуре. Затем добавляют по 5 мл 10% серной кислоты и оставшуюся перекись водорода титруют 0,1 н КМnO4. Об активности каталазы судят по количеству миллиграммов перикиси водорода, которое разрушилось в течение 30 мин ферментом, содержащимся в 1 г исследуемого материала. Активность каталазы определяют по формуле
Ак =
![]()
где а – количество 0,1 н КМnO4, израсходованное для титрования контроля,мл;
в - количество 0,1 н КМnO4, израсходованное на титрование рабочего опыта, мл (1 мл 0,1 н КМnO4 эквивалентен 1,7 мг Н2О2);
n – навеска исследуемого материала, г.
Пример расчета. Взята навеска муки 2,1675 г. На титрование контроля пошло 12,51 мл КМnO4, опыта – 9,86 мл. Количество фильтрата (20 мл), взятое для титрования, соответствует 2,1675х20 0,4335 г муки. Подставляем полученные данные в формулу
100
Ак =
![]()
