
Шестак Вакуумная техника. Концепция разреженного газа 2012
.pdf
должны оказаться в правой камере, а холодные – в левой, что противоречит второму началу термодинамики, так как в этом случае энтропия в замкнутой системе уменьшится. Кажущийся парадокс был легко разрешен путем учета «энергопотребления демоном Максвелла».
Получается, что любой вакуумный насос подобен «демону Максвелла», но с «уточненным заданием» – пропускать любые по энергии молекулы из левой (вакуумной) части в правую и не пропускать молекулы из правой (атмосферной) части системы в левую.
Именно так происходит откачка или удаление молекул из камеры, то есть насос позволяет осуществить разрежение газа в левой части камеры. Данный подход позволяет сравнить вакуумный насос, откачивающий молекулы из объема, с хо-
лодильной машиной – циклической тепловой машиной87,
предназначенной для «отъема» энергии из рабочего объема. Как и для функционирования «демона Максвелла» или
тепловой машины, вакуумному насосу необходима энергия, поступающая от внешнего источника и затрачиваемая на извлечение или перераспределение молекул, что соответствует
второму закону или второму началу термодинамики88.
На рис. 1.2.8 приведена зависимость, позволяющая оценить величину внешней работы при откачке объемов насосами разных типов, имеющих одинаковую скорость откачки, но работающих в разных диапазонах разрежения89.
Показанная на рисунке линия тренда – экспонента, что вполне объяснимо для вакуумной |
техни- |
ки, так как в первый момент в 50 л, откачиваемых насосом в 1 секунду, содержится |
около |
1,4 · 1024 мол, по мере откачки число молекул снижается по экспоненциальной зависимости и при |
|
разрежении, соответствующем, например, 10–2 Па, в 50 л будет содержаться только около 1,4 · 1017 мол, что и объясняет существенное падение потребляемой извне мощности.
Данные усреднены для насосов: механических (группа А – диапазон низкого вакуума), двухроторных или насосов Рутса (группа В – диапазон среднего вакуума), диффузионных паромасляных и турбомолекулярных (группа С – диапазон высокого вакуума), криогенных (группа D – диапазон сверхвысокого вакуума)90.
Рис. 1.2.8. Мощность, пропорциональная работе Q, совершаемой над газом,
и потребляемая вакуумными насосами («от розетки») при работе в разных областях разрежения
87Общие сведения о термодинамике тепловых насосов см. URL: http://www.ad.ugatu.ac.ru/knbase/ g_infotn.htm.
88Второе начало термодинамики здесь рассматривается как физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
89См. также в кн.: Саксаганский Г.Л. Электрофизические вакуумные насосы. М.: Энергоатомиздат, 1988,
с. 17, рис. 3.11.
90URL: http://www.tako-vakuum.ru/pumpen.php
61

Энтропия ансамбля молекул. Второй закон или второе начало термодинамики
Формулировка второго начала термодинамики, основанная на понятии энтропии и гласящая, что
энтропия изолированной системы не может уменьшаться (закон неубывания энтропии) наибо-
лее подходит для вакуумной техники. Из такой формулировки следует, что если термодинамическую систему открыть (вакуумные системы всегда открытые), энтропию можно уменьшать (увеличивать) или, обобщая, регулировать.
Рассмотрим более подробно понятие «энтропия». Больцман постулировал, что энтропия системы может относиться к количеству возможных «микросостояний» (микроскопических статистических состояний), согласующихся с их термодинамическими свойствами:
ъ |
(1.2.2) |
S = k lnΩ, |
|
|
ъ |
где Ω является числом микросостояний для системы, которые возможны в имеющемся макро- скопическом состоянии (статистический вес состояния ансамбля N молекул Ω = 10N).
Для идеального газа в сосуде микросостояние определено как координаты и импульсы (моменты количества движения) каждой входящей в ансамбль молекулы с массой m. То есть определяется значение внутренней энергии газа, для чего кинетические энергии молекул суммируются.
Энтропия S является термодинамической функцией состояния и при заданной температуре Т
можно записать |
|
S Т = UТД , Дж. |
(1.2.3) |
То есть увеличение разрежения Di или, что то же самое, уменьшение количества молекул в объеме V в термодинамических терминах означает снижение энтропии.
Откачка вакуумной системы приводит к снижению энтропии молекулярной системы
При рассмотрении энтропии как функции числа микросостояний можно говорить о системе как имеющей меньшую или большую возможность конфигурирования (реализация возможных состояний), то есть мы можем говорить об энтропии и как о мере «беспорядка» или хаоса в системе. Для газа наиболее вероятным состоянием, соответствующим максимуму энтропии, является равномерное распределение молекул – полная хаотизация. При хаосе за счет максимального количества возможностей конфигурирования реализуется максимальный «беспорядок». Любой порядок, устанавливаемый даже на время, снижает энтропию.
Для «упорядоченных» систем энтропия как мера «беспорядка» уменьшается за счет того, что, например, при неравномерном распределении молекул возникнет диффузионный поток молекул в направлении минимальной концентрации, что приведет к снижению внутренней энергии ансамбля молекул за счет ориентации вектора скорости в направлении переноса и соответствующего перераспределения энергии по степеням свободы.
Исходя из второго начала термодинамики при неизменной температуре молекул Т можно рассматривать давление p как «удельную концентрацию энергии» в объеме V:
p = UТД/V = S Т/V, Дж/м3.
При таком подходе к термину «давление», не рассматривая давление как отношение силы F к площади поверхности А, на которую она действует, и не рассматривая поверхность вообще, возможно найти строгое физическое объяснение тому обстоятельству, почему в вакуумной технике столь широко применяется в качестве параметра газа именно параметр «давление»
По существу, давлением является удельная внутренняя энергия газа. Для изотропного газа она везде по объему V постоянна.
Внутренняя энергия имеет размерность «джоуль», это означает, что можно говорить о мере «беспорядка» (хаоса) в системе, выраженной величинами с размерностью «джоуль/градус». «Упоря-
62

доченный хаос» обладает меньшей энергией – при одинаковой температуре в ансамбле упорядочен-
ных молекул меньше энергии (джоулей), чем в хаотизированном!!!91
Хаотизация замкнутых систем приводит к отсутствию локальных и других неоднородностей, к отсутствию процессов переноса массы, энергии, движения и т.п. в системе. Иными словами, к установлению в системах устойчивого равновесия или квазиравновесия92. Неравновесие системы и ее продолжительность зависят от характера возмущения какого-либо параметра, а также времени, необходимого для релаксации (релаксация – процесс установления равновесия или ликвидации источника возмущения системы, при котором в системе происходит диссипация энергии).
При вакуумной откачке объемов молекулярная плотность на входе вакуумного насоса как минимум в два раза меньше средней по объему (за счет того, что молекулы «уходят» в одном направлении – в насос, см. рис. 1.2.6), в результате равновесие ансамбля молекул нарушается и возникает скорее статистический, чем диффузионный, поток молекул, направленный внутрь вакуумного насоса.
Можно говорить о том, что не только происходит удаление молекул из объема, но и приводится в порядок «хаос газовых молекул» – движение молекул упорядочено и статистически ориентировано к насосу.
При откачке вакуумных систем происходят: уменьшение энтропии – уменьшение давления – уменьшение количества газа – уменьшение молекулярной концентрации – увеличение разрежения – улучшение вакуума!
Очевидно, что все приведенные утверждения, если и не синонимы, то имеют близкие физические основы.
Предельное разрежение.
Третий закон или третье начало термодинамики (теорема Нернста)
Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю. Следовательно, при абсолютном нуле температуры можно получить нулевое давление.
Но из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достигнуть ни в одном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться. То есть и предел давления, достигаемый при снижении температуры, лишь асимптотически приближается к «нулевой отметке».
На рис. 1.2.9 изображена «кривая откачки вакуумной системы» в осях «энтропия – время». В момент времени t1 реализуется один из методов уменьшения внутренней энергии газа, приведенных на рис. 1.2.3. Энтропия снижается от уров-
ня Sнач до уровня S1 и т.д. В период времени от t3 до t4 любой способ не может снизить
величину энтропии ниже Sпредельная, соответствующему предельному разрежению
ансамбля молекул, и принято говорить, что устанавливается квазиравновесное состояние для этой технологии реализации (для данной системы: «насос – вакуумная каме-
ра»).
При отключении внешних систем, совершающих работу над ансамблем молекул, заключенным в вакуумной камере, энтропия всегда растет и достигает равновесного значения Sконечная93.
91Неожиданный результат, необъяснимый в рамках МКТ, по-видимому, связанный с ориентации векторов скоростей молекул [требуется дополнительное исследование].
92Шестак В.П., Сергиевский В.В. Концепции современного естествознания: Учебное пособие. Москва,
Томск: ТГПУ, 2005, с. 86.
93Интересно, что время установления конечной энтропии после отключения насосов зависит от размера вакуумной камеры, но не связано с установлением сорбционно-десорбционного равновесия [требуется дополнительное исследование].
63

Рис.1.2.10. Логарифмическая зависимость для давления газа, иллюстрирующая асимптотический характер приближения предельного давления (предельной энтропии) газа к нулю
Рис. 1.2.11. Типичный вид современной криогенной установки для производства жидких газов – хладагентов*
____________________
*URL: http://lt.tnw.utwente.nl/research/cooling/Tech nology/laboratory.doc/ Голландия, The University of Twente is part of the 3TU Federation and works cooperatively with Delft University of Technology and with Eindhoven University of Technology. The University of Twente is also a member of the European Consortium of Innovative Universities
Для очень широких диапазонов изменения величин давлений и молекулярных концентраций (более 17 порядков), используемых в вакуумной технике, очень удобно использовать вместо собственно величин их логарифмы. Отрицательная ветвь логарифмической функции (рис. 1.2.10) соответствует асимптотическому характеру приближения, например, давления к нулевому значению.
В вакуумной технике графики зависимостей от давления для наглядности обычно строятся в полулогарифмическом масштабе с тем, чтобы компенсировать несопоставимость рассматриваемых величин.
Следует помнить, что наличие на оси давлений/молекулярных концентраций
и т.п. нулевого значения не только деформирует зависимость, но и является грубейшей физической ошибкой
Несмотря на невозможность достижения нуля давления (даже при давлении 10–14 Па, технически недостижимом сегодня, в одном см3 будет находиться, по меньшей мере, одна молекула), принцип снижения энтропии молекулярной системы за счет снижения температуры молекул вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4,2 К), нашел широкое применение в вакуумной технике. Криогенные исследования в физике низких температур позволили создать вполне работоспособные вакуумные крионасосы.
Существование зависимости давления газов от температуры при применении крионасосов используются очень просто и элегантно: газ переводится в состояние пара, пар – в состояние конденсата. При температуре 4,2 К практически все (кроме гелия и водорода) сконденсированные газы переходят в твердое состояние с давлением паров менее 10–10 Па.
а б
Рис. 1.2.12. Двухступенчатый криогенный насос японской компании Sumitomo Heavy Industries, Ltd.94 (а); крионасос и гелиевый компрессор израильской фирмы Ricor Cryogenic and Vacuum Systems (б)
94 URL: http://www.cryosystems.com.ru/SHI_START.html
64

Крионасосы нашли применение в вакуумной технике благодаря высокой компактности и эффективности. На рис. 1.2.11 и 1.2.12 приведены фотографии современных криогенной установки для
производства жидких газов и крионасосов, обеспечивающих получение сверхвысокого вакуума
(10–8 – 10–9 Па).
Крионасос всегда состоит из двух компонентов: криоголовки и компрессора. Часто в литературе их объединяют под общим именем: «криорефрижератор».
Наиболее распространены криорефрижераторы, работающие по обратным холодильным циклам95 Стирлинга или Гиффорда – Мак-Магона (Stirling, Gifford Mc-Mahon), состоящих из двух изотермических (Т = const) и двух изохорных (V = const) процессов.
Рис. 1.2.13. Термодинамический цикл охлаждения Стирлинга
В холодильном цикле Стирлинга (рис. 1.2.13) два поршня движутся в цилиндре прерывисто со сдвигом по фазе. Между поршнями размещен регенератор96 Р, который делит рабочую полость на теплую с температурой Т0 и холодную с температурой Тх части. Газ изотермически сжимается (процесс 1 – 2), при этом во внешнюю среду передается тепло Q0, параллельным движением поршней изохорно перемещается через регенератор (процесс 2 – 3). За счет движения правого поршня газ расширяется, его температура снижается до температуры Тх, и oт охлаждаемого тела к нему подводится энергия Qx (процесс 3 – 4). Поршни параллельно сдвигаются влево, холодный газ изохорно перемещается через регенератор, охлаждая его, и процесс циклически повторяется. Охлаждение в подобной системе происходит за счет того, что работа сжатия превышает работу расширения.
Одноступенчатые машины используют для получения холода на уровне до 40 К. Более низких (до 7 K) температур достигают, применяя двухступенчатые машины.
Детандеры (расширители) и регенераторы размещаются непосредственно в криоголовке. Рабочим веществом служит, как правило, газообразный гелий под давлением около 1,5 МПа, поступающий из компрессора.
95Холодильные циклы обратные круговые термодинамические процессы, в результате которых теплота переходит от тела с меньшей температурой к телу с большей температурой за счёт затраты внешней работы.
96Регенератор (от лат. regenero – вновь произвожу) в теплотехнике, теплообменник, в котором передача теплоты осуществляется путём поочерёдного соприкосновения теплоносителей с одними и теми же поверхностями аппарата. Во время соприкосновения с «горячим» теплоносителем стенки регенератора нагреваются, с «холодным» охлаждаются, нагревая его.
65
Вопросы контроля и поддержки
1.Почему мы «ждем» сопротивления ансамбля молекул нашим действиям при откачке вакуумных систем?
2.Каким образом может быть использована в вакуумной технике такая характеристика газа, как теплоемкость?
3.Что сложнее охладить: водород или, например, азот? Поясните ваш вариант ответа.
4. Почему равенство UТД = Q, записанное для случая нагрева газа и повышения внутренней энергии, с точностью до знаков подходит к процессу откачки? Запишите равенство для случая откачки системы.
5.Почему и в каких случаях потенциальной энергией связей молекулы как целого с другими молекулами или молекулы с поверхностью можно пренебречь?
6.Перечислите механизмы снижения внутренней энергии газа.
7.Изобразите зависимость снижения температуры молекул от времени при их последовательном проходе разнообразных экранов, защищающих гелиевую панель, имеющую температуру 4,2 К.
8.Изобразите простейший насос и поясните принцип его работы. Сформулируйте 2 – 3 проблемы, возникающие при работе изображенного вами насоса, которые требуют его усложнения.
9.Графически изобразите распределение давления по длине вакуумной системы, считая, что составляющие ее камера, соединительный патрубок и насос расположены в длину так, как показано на рис. 1.2.7.
10.Почему любой вакуумный насос подобен хорошо известному в термодинамике «демону Максвелла»?
11.В чем состоит положительный эффект при рассмотрении давления p как удельной концентрации энергии в объеме V.
12.Что объединяет понятия «уменьшение энтропии» и «увеличение разрежения»?
13.Объедините выражения (1.2.2) и (1.2.3), получите уравнение и сравните его с уравнением состояния идеального газа, известного в МКТ. Попытайтесь найти объяснение результатам сравнения.
14.Объясните, почему невозможно достичь нуля давления?
15.Как первое, второе и третье начала термодинамики «проявляются» в вакуумной технике?
1.2.2. Явления переноса в газе
Поток молекул в газе
Средняя скорость v молекул в ансамбле, находящемся в замкнутом объеме, определенная методами статистической физики составляет (см. раздел 1.1.4)
v = (8kT/πm)1/2, |
(1.2.4) |
где k – постоянная Больцмана, T – температура молекулы, m – масса молекулы.
Считаем, что каждая молекула движется с этой скоростью по прямой линии до очередного столкновения с другой молекулой или со стенкой объема (вакуумной камеры), в котором (которой) находится газ. Возможные траектории движения изображены на рис. 1.1.3 и представляют собой либо «броуновский хаос», либо отрезки прямых линий, которые претерпевают излом на стенках. Подобные траектории означают непрерывные изменения вектора скорости молекул как по направлению, так и по модулю, что, по логике, должно вести к полной хаотизации ансамбля молекул.
Поскольку молекулы двигаются, возникают вопросы, очень важные для физика-вакуумщика: как перевести систему с хаотизированными молекулами в систему с молекулярными потоками, за счет чего можно создать поток молекул и, тем более, направленный поток молекул в системе? Можно ли использовать те потоки, которые есть в системе, для целевого уменьшения количества молекул в системе? Каким образом это можно реализовать?
Представим себе гипотетическую площадку dAх, y = 0, z , выделенную в произвольной области пространства, занятого газом. Эта площадка условно разделила пространство по оси х на две части: правую и левую. Из всех возможных направлений движения молекул выберем два: справа – налево и слева – направо.
66

На рис. 1.2.14 изображена схема процесса формирования потока молекул через площадку dAх, y = 0, z, на схеме учтено, что молекулы летят и справа и слева.
Рис. 1.2.14. Потоки молекул из объемов dV1 и dV2 через гипотетическую площадку dA, выделенную в занятом газом пространстве
Пусть в элементарных объемах dV1 и dV2 , на которые можно разбить и правую и левую части пространства, молекулярная концентрация постоянна и равна n1( r1 , t) и n2( r2 , t) соответственно. Мо-
лекулы из объемов dVi разлетаются равновероятно во всех направлениях и телесный угол ω, в котором они разлетаются, равен 4π. Если использовать функцию распределения молекул по скоростям f (v), то произведение f (v)dv характеризует долю молекул, обладающих скоростями в интервале от v до v + dv, независимо от направления их движения. Через площадку dA вединицу времени (для определенности рассматриваем движение молекул из элементарного объема dV1 только справа – налево) пройдет f (v) · dv · dω1/4π молекул, заключенных в элементарном телесном угле dω1.
За время dt долетит и пройдет площадку dA число молекул
N*= f (v) · dv · sin θ · dθ · d ψ · v · cos θ · dr · dA /4π, |
(1.2.5) |
где dV = r · sin θ · dψ · (r · dθ) · dr; dr = vdt; dω = cos θ · dA/dr2.
Интегрирование по углам ψ и θ ведется из соображений, что через площадку dA могут пройти все молекулы из пространства, находящегося справа, для чего интегрируем полученное выражение в пределах: для скоростей v от 0 до ∞, что соответствует распределению Максвелла по скоростям; для углов ψ и θ от – π/2 до +π/2. С учетом того, что плотность потока молекул I по определению равна
N*/dA·dt , получим |
|
|
1 |
|
|
|
|
|
I |
|
= |
n v |
|
, мол м−2 |
с−1. |
(1.2.6) |
|
|
|
|
||||||
|
мол 1 |
|
4 1 |
1 |
|
|
|
|
Это простое выражение позволяет сделать следующие интересные утверждения97:
1.Плотность потока молекул не зависит от массы молекул и имеет размерность, общепринятую
вфизике.
2.Ненаправленные потоки молекул в системах существуют всегда.
3.Выражение определяет поток свободных молекул, независимо от направления их движения, так как содержит в числителе невекторную величину – среднюю или «тепловую скорость» молекул.
4.При получении выражения для плотности потока молекул не оговаривались условия разрежения газа (уровень вакуума или плотность среды не обсуждались), то есть оно справедливо для любого вакуума.
5.С помощью выражения для плотности потока молекул можно вычислить удельный объем газа
V∞, проходящий через единичную площадку dA в единицу времени: поскольку I · dA · dt по определению равно количеству молекул N*, пересекающих единичную площадку dA в единицу времени dt, то удельный объем газа V∞, проходящий через ту же площадку в единицу времени, можно определить
как V∞ = 14  vср
vср , м3.
, м3.
97 Едва ли не одно из главных выражений для понимания физических основ вакуумной техники.
67

6.Полученное выражение для молекул, двигающихся справа налево, справедливо и для молекул, двигающихся слева направо. В случае рассмотрения потока молекул, двигающихся слева направо, следует изменить знак потока с плюса на минус.
7.В случае, если n2 = n1 и v 1 = v 2, суммарный поток через произвольно выбранную площадку
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
dA равен нулю: |
|
|
n1 |
v |
1 |
+ |
− |
|
n2 |
v |
2 |
=0. |
|
4 |
|||||||||||
|
4 |
|
|
|
|
|
|
|
|
|
||
Именно в этом случае говорят о том, что в системе устанавливается равновесие98, энтропия системы максимальна и не меняется и, несмотря на интенсивное тепловое движение, из-за неразличимости молекул обычно не говорят ни о потоках молекул, ни о смещении молекул от своего первоначального положения. Такие вакуумные системы называются системами без молекулярных потоков или «отпаянными» вакуумными системами.
Плотность потока молекул: 14 n v
v , мол м−2 с−1.
, мол м−2 с−1.
Удельный объем газа V∞, «падающего» на единицу площади
в единицу времени: 14  v
v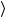 , м3 · м–2 · с–1,
, м3 · м–2 · с–1,
Величину V∞ можно использовать как верхнюю оценку предельных возможностей по откачке любого насоса, так как она определяет количество молекул поступающих на единицу площади его входа. Удельный объем газа не зависит от величины разрежения, не зависит от числа Кнудсена и т.п.
Несмотря на то, что в газе всегда существуют потоки молекул, нельзя рассматривать их как основу переноса ни массы, ни энергии, ни количества движения до тех пор, пока не приняты специальные меры по обеспечению их целевого формирования, например, путем организации в системе «черной дыры», в которой без разбора по роду газа поглощаются молекулы, падающие на ее вход, и которая обеспечивает «невозвратный сток» молекул99 из системы.
Такой «черной дырой» является изображенный на рис. 1.2.8 люк в руках «демона Максвелла», через который проходят молекулы из левой (вакуумной) части в правую и не пропускаются молекулы из правой (атмосферной) части системы в левую.
Поток может быть сформирован, если искусственно нарушить равенство n2 = n1, например с помощью вакуумного насоса. При работе насоса возникнет направленный в сторону меньшей молекулярной концентрации, образующейся на входе насоса, поток молекул, равный разности между числами частиц, пересекающих площадку-вход насоса в том или другом направлениях по оси, перпендикулярной площади входа насоса, в единицу времени, и пропорциональный разности молекулярных концентраций над входом в насос и во входном патрубке насоса (для трехмерного представления правильнее говорить о пропорциональности градиенту100 молекулярной концентрации).
Флуктуации и флуктуационная диффузия
Движение молекул, по классическим представлениям, может прекратиться только при абсолютном нуле температуры, который, впрочем, недостижим. При квантово-механическом рассмотрении оказывается, что и при абсолютном нуле температуры движение молекул не прекращается, сущест-
98Для низкого вакуума, когда длина пробега молекул очень мала, можно говорить о равновесии при условии равенства давлений справа и слева: р1 = р2 = р.
99Принято говорить о коэффициентах захвата молекул насосами, численные значения которых различны для разных газов и разных типов насосов и расположены в диапазоне от 0,05 до 0,6. См., например, в монографии: Саксаганский Г.Л. Электрофизические вакуумные насосы. М.: Энергоатомиздат, 1988, с. 13.
100 Для случая трёхмерного пространства, градиентом называется векторная функция с компонентами ,
,, где – некоторая скалярная функция координат x, y, z, компоненты которой равны частным производ-
ным |
= |
x + |
y |
z. |
grad |
или |
. Из определения градиента следует, что |
|
по всем её аргументам. Градиент обозначается |
|
|
|
|||
grad
68

вуют так называемые нулевые колебания. Благодаря непрерывному движению и взаимодействиям молекул возможно случайное изменение параметров равновесных состояний статистических систем. Процессы случайного нарушения равновесного состояния статистических систем, обусловленных непрерывным движением структурных частиц, получили название флуктуаций.
Флуктуационные процессы широко распространены в природе. Приведем ряд примеров: флуктуационными изменениями плотности воздуха и рассеиванием солнечного света на уплотнениях воздуха обусловлен голубой цвет неба; флуктуациями обусловливается предел точности измерительных приборов; флуктуациями объясняется так называемое броуновское движение взвешенных частиц; благодаря флуктуациям осуществляется диффузия; флуктуации ответственны за возникновение дефектов кристаллической решетки и так называемый дробовый эффект в электронных процессах; флуктуационными процессами обусловлена опалесценция в критической точке фазовой диаграммы «жидкость – пар» и много-много других физических явлений как в микромире, так и в мегамире.
Ранее мы говорили о том, что перемещение отдельных молекул в результате их теплового движения внешне напоминает перемещение броуновских частиц и о том, что в равновесном не разреженном газе молекула, интенсивно двигаясь, практически не смещается от своего первоначального положения, при этом «проходя» огромный путь (см. рис. 1.1.3 и 1.1.14).
Флуктуационный характер смещения молекул при движении типа броуновского доказан в теории флуктуаций101. Смещение молекулы х, объясняемое флуктуационной диффузией, меняется со временем случайным образом, но ее средний квадрат ( х)2, как доказал А. Эйнштейн (1905)102, за большое число столкновений растёт пропорционально времени наблюдения t, а коэффициент диффузии является коэффициентом пропорциональности в соотношении ( х)2 ~ D · t.
Для простейшего случая диффузионного смещения молекул в газе можно принять х = λ, где
λ = 1/√2· σ и t = dt, где dt – время между столкновениями молекул. Для газа средняя длина свободного пробега λ = v · dt. Тогда можно записать: D ≈ λ 2/dt = λ · v, м2 · с–1, откуда следует, что коэффициент диффузии является функцией температуры, разрежения и рода газа. Физически коэффициент диффузии при условии, что средняя скорость для определенного газа и определенной температуры величина постоянная, является параметром свободного перемещения (смещения) молекул в газе и определяет величину диффузионного смещения.
Альберт Эйнштейн (нем. Einstein, 1879 – 1955), выдающий-
ся физик-теоретик, создатель теории относительности, автор основополагающих трудов по квантовой теории и статистической физике, один из основателей современной физики.
Теория флуктуаций, имеющая прямое отношение к процессам переноса в газе, изложена в его знаменитой работе «О движении взвешенных в покоящейся жидкости частиц, требуемом молекулярно-кинетической теорией теплоты» (1905).
Получил Нобелевскую премию (1921) за открытие законов фотоэффекта и работы в области теоретической физики.
Флуктуационная диффузия не нарушает термодинамическое равновесие ансамбля молекул и не приводит к возникновению молекулярных потоков.
В соответствии со вторым началом термодинамики для равновесных систем энтропия максимальна и постоянна и может изменяться только при нарушении равновесия, в частности, при возникновении любых потоков молекул из-за неравенства молекулярных концентраций по любому компоненту смеси, или из-за введения в систему молекул нагретых или быстро двигающихся тел, пере-
101Основы теории флуктуаций были заложены в работах Дж. Гиббса, А. Эйнштейна, М. Смолуховского.
102Френкель В.Я., Явелов Б.Е. URL: http://vivovoco.rsl.ru/VV/PAPERS/BIO/EINSTEIN.001/CHAPTER_
3.HTM
69

дающих энергию молекулам. В этом случае флуктуационная диффузия уступает место обычной диффузии.
В вакуумной технике, задача которой – уменьшение энтропии ансамбля молекул, процессы смещения, перемещения, образования потоков молекул являются базовыми: только перемещая мо-
лекулы и формируя структуры с молекулярными потоками103, можно обеспечить откачку вакуумной системы.
Стационарная диффузия
Диффузия (от лат. diffusio – распространение, растекание, рассеивание), в частности, диффузия в разреженном газе представляет собой перенос молекул или, точнее, процесс переноса молекул из области с высокой концентрацией в область с низкой концентрацией.
Диффузия всегда происходит в направлении падения концентрации вещества и ведёт к равномерному распределению вещества по всему занимаемому им объёму104.
Роль диффузии в нашей жизни невозможно переоценить. С диффузией мы встречаемся постоянно, достаточно упомянуть о распространении запахов (чему, кстати, помогают и конвективные потоки), промокании одежды и т.п.
В вакуумной технике задача вакуумных насосов – создание перепада молекулярной концентрации (создание градиента молекулярной концентрации) на входе насосов. Результатом является формирование диффузионного потока молекул в направлении из системы к насосу, считая, что ось х на рис. 1.2.14 расположена в сечении входного патрубка насоса, а площадь dA, эквивалентна площади его входного сечения.
К вопросу о «невозвратном стоке»
а |
б |
Если представить себе провал в распределении молекулярной концентрации (а), то в соответствии с законом диффузии образуется поле векторных потоков молекул (б).
Видно, что потоки направлены вниз в область минимальной концентрации,
иони тем больше, чем круче «наклон провала»
В1855 г. 26-летний немецкий физиолог Адольф Фик обратил внимание на аналогию потоков массы при диффузии водных солей через мембрану и потоков теплоты при теплопроводности. Так
как теория теплопроводности уже была опубликована Ж. Б. Ж. Фурье в 1822 г., то Фик использовал математический аппарат Фурье для записи сформулированного им закона105 молекулярного переноса массы:
j = – D dρ/dх, |
(1.2.7) |
103Саксаганский Г.Л. Молекулярные потоки в сложных вакуумных структурах. М.: Атомиздат, 1980. –
216 с.
104Энтропия (в отличие от массы, энергии и импульса) не сохраняется, а возрастает со скоростью ∂S/∂t в элементе объёма вследствие необратимых процессов, в частности диффузии. Принято говорить о «приросте энтропии». Знак прироста зависит от конкретных условий процесса.
105Опубликовано в труде А. Фика «Медицинская физика» в Цюрихе в 1856 г. Законы диффузии Фика – предмет детерминистской аналитической теории диффузии, лишь очень приближенно описывающей реальные физические явления, которые вероятностны по своей сущности.
70
