
Шестак Вакуумная техника. Концепция разреженного газа 2012
.pdf
n(rG, t0 ) = ∫ f (rG, vG, t)dvG. |
(1.1.17) |
Молекулярная концентрация n(rG, t0 ) представляет собой «локальную» концентрацию, т.е. кон-
центрацию молекул в локальном объеме пространства dV, занимаемого молекулами в некоторый момент времени t0 и которая, как было сказано в разделе «Разрежение газа», может быть интересна в ряде практических случаев.
Функция распределения в подавляющем большинстве случаев содержит в себе всю возможную и потому исчерпывающую информацию о свойствах систем. Знание вида функции распределения ансамбля свободных молекул является мечтой любого физика. Но, к сожалению, лишь одна функция распределения в молекулярно-кинетической теории известна:
Распределение Максвелла – Больцмана. Для молекул идеального газа, находящихся в поле
внешних сил, распределение Максвелла – Больцмана имеет вид |
|
f (rG, p) = В · ехр[{–р2/2 m + U ( )}/k Т], |
(1.1.18) |
где р2/2m – кинетическая энергия молекулы, имеющей массу m; импульс р = mv; U( ) – ее потенциальная энергия во внешнем поле (в частности потенциальное поле тяготения Земли); k – постоянная Больцмана; Т – абсолютная температура газа; постоянная В определяется из условия, что суммарное число частиц, распределённых по всем возможным состояниям, равно полному числу частиц в системе N (условие нормировки). Так как величина kT характеризует среднюю энергию теплового движения молекулы, то распределение частиц по состояниям определяется отношением полной энергии частицы (кинетическая плюс потенциальная) к энергии её теплового движения.
Распределения Максвелла – Больцмана содержит два сомножителя: ехр [–р2/2mкТ] и exp[U ( )/kT]. Первый из них определяет распределение молекул по импульсам (или скоростям) и является распределением Максвелла:
|
m 3/2 |
mv2 |
|
|
|
||
f (v) = |
|
|
|
exp |
|
, |
(1.1.19) |
|
|
||||||
2πkT |
2kT |
|
|
|
|||
а второй барометрической формулой, если |
принять, что поле внешних сил |
– гравитационное, |
|||||
U (rG) = mgh. Поэтому иногда вторую зависимость называют «распределением Больцмана».
Если рассматривать перенос молекул вдоль оси х и скорость переноса66 равна vx , можно записать
кинетическое уравнение Больцмана67: |
|
|
|
|
|
|
|
|
∂f |
+vx |
∂f |
+ |
F |
|
∂f |
= Iст , |
(1.1.20) |
∂t |
∂x |
|
|
|||||
|
|
m ∂vx |
|
|||||
где частная производная∂∂ft характеризует изменения функции распределения со временем (в частно-
сти, процесс разрежения газа), например, за счет откачки системы;
второй член в кинетическом уравнении Больцмана vx ∂∂vfx , пропорциональный частной произ-
водной функции распределения по координате, учитывает изменение функции распределения в результате перемещения частиц в пространстве, например, за счет явлений переноса, натекания газа извне и возникновения направленных молекулярных потоков, которые приводят к формированию
«полей молекулярных концентраций»;
третий член в кинетическом уравнении Больцмана |
F ∂f |
определяет изменение функции рас- |
||
|
|
|
||
|
m ∂vx |
|||
пределения, обусловленное действием внешних сил F в зоне А, например, за счет взаимодействия молекул с другими молекулами или с движущейся поверхностью;
стоящий в правой части уравнения член Iст – так называемый интеграл столкновений – описывает систему причин, по которым ансамбль молекул выходит из состояния равновесия и изменяется функция распределения молекул в фазовом пространстве скоростей и координат.
66Скорость переноса обычно рассматривается для сплошных сред. Для вакуумной техники эта скорость обычно является проекцией тепловой скорости молекул на соответствующее направление, например по оси х.
67Распределение Максвелла установлено в 1859 г., а кинетическое уравнение Больцмана было выведено на 13 лет позже.
51

При Iст = 0 имеем равновесный хаотизированный газ. Типичным примером формирования интеграла столкновений является изменение вероятности прохода молекул слева направо и справа налево с помощью вакуумного насоса.
Средняя скорость свободных молекул
G ВGравновесном газе средняя (тепловая) скорость молекул, описываемых функцией распределения f (r , v, t) 68, вычисляется из выражения:
G G G |
G G |
= (8kT |
1/2 |
(1.1.21) |
vср = ∫vf (v)dv |
∫ f (v)dv |
πm) . |
По этой формуле получается, например для молекул азота при температуре 293 К  vср
vср = 470 м/с,
= 470 м/с,
что превышает скорость звука, равную 340 м/с в атмосферном воздухе при нормальных условиях69. Для водорода при тех же условиях средняя скорость равна 1600 м/с.
График распределения Максвелла зависимости f (v) от v, самого интересного в молекулярнокинетической теории распределения, приведен на рис. 1.1.13.
То, что кривая распределения начинается в начале координат, означает: неподвижных молекул в газе нет. Относительное число очень быстрых и очень медленных молекул мало, но они есть, и в ряде случаев их наличие нужно учитывать.
При изменении температуры газа будут изменяться скорости движения всех молекул, а следовательно, и средняя скорость. Поэтому максимум кривой будет смещаться вправо при повышении температуры и влево при понижении температуры.
направления скоростей vi может быть записано так:
|
m 1/2 |
|
|
mv2 |
(1.1.22) |
||
fv(vi) = |
|
|
exp |
− |
|
. |
|
|
|
||||||
|
2πkT |
|
|
2kT |
|
|
|
Это распределение приведено на рис. 1.1.14 и имеет форму нормального распределения – распределения Гаусса70.
На фотографии видны пятна на крае платформы метро, светлые следы – зоны отполированные ногами – «нормальные распределения», отражающие статистические следы входа людей в двери вагонов (максимум располагается по центрам дверей), темные следы – зоны, не натираемые ногами людей при посадке
68Можно сравнить с величинами среднеквадратичных скоростей молекул, полученных нами ранее из основного уравнения молекулярно-кинетической теории.
69Именно поэтому при решении вопроса о прямом взаимодействии с молекулами газа в вакуумных насосах рабочих тел насосов (струй пара в диффузионных насосах, двигающихся лопастей в турбомолекулярных насосах) возникает требование об обеспечении сверхзвуковых скоростей их движения. Иногда говорят о числе
Маха – аэродинамическом параметре − как об отношении скорости тела, движущегося в вакууме, к скорости звука в вакууме.
70 Нормальное распределение, также называемое распределением Гаусса, распределение вероятностей, которое играет важнейшую роль во многих областях знаний, особенно в физике. Физическая величина подчиняется нормальному распределению, когда она подвержена влиянию огромного числа случайных помех. Ясно, что такая ситуация крайне распространена, поэтому можно сказать, что из всех распределений в природе чаще всего встречается именно нормальное распределение – отсюда и произошло одно из его названий.
52

Физическая величина подчиняется нормальному распределению тогда, когда она подвержена влиянию огромного числа случайных событий. Ясно, что такая ситуация присуща газу.
Как и следовало ожидать, для газа, находящегося в равновесии, средняя скорость молекул в любом направлении равна нулю или, что более важно, количество молекул, летящих «направо», равно количеству молекул, летящих «налево».
Из рис. 1.1.14 следует, что молекулы двигаются то в одном направлении, то в другом, но в основном «остаются» на одном месте, как и было отмечено при обсуждения случая, изображенного на рис. 1.1.3,а.
Рис. 1.1.14. Распределение Максвелла с учетом направлений векторов скоростей v
Вопросы контроля и поддержки
1.В каком агрегатном состоянии кинетическая энергия ансамбля молекул превышает потенциальную?
2.Почему в газах, не испытывающих внешнего влияния, всегда возникает хаотическое состояние молекул – «беспорядок»?
3.Найдите границы применимости модели идеального газа.
4.Опишите процессы, наблюдаемые на поверхностях, обращенных в вакуум.
5.Опишите процесс сублимационной сушки пищевых продуктов.
6.Изобразите зависимость полной энергии взаимодействия молекул от расстояния между ними.
7.Почему молекула, налетающая на стенку, может быть захвачена потенциальной ямой, определяемой стенкой, а может и нет? На что молекула «тратит» время пребывания в яме порядка 10-12 с?
8.Почему нельзя говорить об упругом (как в бильярде) ударе молекулы по поверхности? Что это меняет в наших представлениях о газах?
9.На основании чего делается заключение о том, что не существует абсолютно герметичных вакуумных систем?
10.В модуле рассматриваются три уровня описания системы молекул. Рис. 1.1.6 явно предваряет содержание учебного пособия. Дайте свою версию идеи размещения этого рисунка именно в этом месте пособия.
11.Приведите перечень законов, объединяемых молекулярно-кинетической теорией газов.
12.Почему столь большое внимание в физике уделяется постоянной Больцмана?
13.Объясните, почему количество газа, представляемое произведением pV, имеет размерность в джоулях?
14.В чем научное величие Кнудсена и что означает потеря линейности зависимости длины свободного пробега молекул от молекулярной концентрации (см. рис. 1.1.10)?
15.Поясните, почему логичней говорить об увеличении разрежения в ансамбле молекул, чем о снижении давления в системе?
16.Какие случайные процессы происходят в вакуумных камерах? Каков физический смысл функций распределения в физике?
17.Может ли быть равна нулю скорость молекул? Почему приведенное на рис. 1.1.13 распределение Максвелла начинается из нуля оси абсцисс – оси скоростей?
53

1.2.Физические явления в газах
Спомощью этого модуля вы:
 освоите предлагаемый автором вариант термодинамического описания разреженного газа и процессов в нем, изучите общий принцип работы вакуумного насоса с позиций термодинамики, освоите столь модный сегодня термин «энтропия»;
освоите предлагаемый автором вариант термодинамического описания разреженного газа и процессов в нем, изучите общий принцип работы вакуумного насоса с позиций термодинамики, освоите столь модный сегодня термин «энтропия»;
 ознакомитесь с такими явлениями переноса в разреженном газе, имеющими отношение к вакуумной технике, как: перемещение молекул за счет диффузии и формирование молекулярных потоков, передача тепла за счет теплопроводности, передача скорости за счет вязкости;
ознакомитесь с такими явлениями переноса в разреженном газе, имеющими отношение к вакуумной технике, как: перемещение молекул за счет диффузии и формирование молекулярных потоков, передача тепла за счет теплопроводности, передача скорости за счет вязкости;  изучите разделы физической электроники, относящиеся как к процессам разрежения
изучите разделы физической электроники, относящиеся как к процессам разрежения
газа, так и к диагностике разреженного газа, например такими, как ионизация молекул, разряд и электрический ток в газе.
1.2.1. Термодинамика газа
Теплоемкость газа. Увеличение и уменьшение внутренней энергии газа
Для общих оценок процессов, составляющих суть вакуумной техники, и понимания их эксклюзивности по сравнению с другими процессами в газах очень подходит целостное термодинамическое описание71 ансамбля молекул газа, заключенного в изолированном объеме V.
Для макроописания газа используются такие термодинамические величины и функции72, как: V –
объем, в котором находятся N свободных молекул, p – давление, T – температура молекул, UТД – внутренняя энергия ансамбля молекул73, SТД – энтропия ансамбля молекул, Q – тепло74, сообщенное ансамблю молекул извне, работа A, совершённая ансамблем молекул против внешних сил, теплоемкость газа и др.
Одно из важных отличий термодинамического метода описания газа от любых других заключается в том, что термодинамика:
ориентирована на описание изолированного газа как целостной системы, ориентированной на сопротивление нашим действиям по ее модернизации, в частности путем разрежения (откачки);
дает представление об энергетических соотношениях и потерях – по сути, представление о «цене вопроса получения вакуума», в то время как другие методы описания излишне детализированы и порой не позволяют видеть то общее, что и составляет философскую основу вакуумной техники75.
Если в газ, содержащийся в фиксированном объеме V, ввести извне количество теплоты76 (лучше говорить о введении энергии) Q, объем газа не изменится, вся энергия, полученная газом, пойдет на увеличение его внутренней энергии, которая выразится в повышении температуры молекул газа и, в конечном счете, увеличении тепловой скорости молекул и их кинетической энергии, Поэтому, в со-
71Неоправданно не используется ни в учебной, ни в научной литературе, относящейся к вакуумной технике [точка зрения автора].
72Термодинамика (от греч. θέρμη – тепло + δυναμις – сила) – раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. См. подробнее в кн.: Савельев И.В. Курс общей физики. Кн. 3. Молекулярная физика и термодинамика. М.: Астрель, 2004.
73Ансамбль – согласованность, единство частей, образующих что-либо целое, а также самое такое целое, например, набор всевозможных состояний данной физической системы, отвечающих определённым критериям.
Врассматриваемом случае «ансамбль молекул» является объектом действий в вакуумной технике.
74Количество теплоты мера энергии, переходящей от одного тела к другому в данном процессе.
75Философия вакуумной техники [еще не написана], во-первых, должна исследовать феномен вакуумной техники в целом, во-вторых, не только ее имманентное развитие, но и место в общественном развитии в целом, а также, в-третьих, принимать во внимание широкую историческую перспективу. Подробнее см. в кн.: Степин В.С., Горохов В.Г., Розов М.А. Философия науки и техники. URL: http://www.philosophy.ru/library/fnt/00.html.
76Следует отметить, что «количество теплоты» как и «теплоемкость» крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII в. Мы будем говорить – энергия. См. также URL: http://physics.ru/courses/op25part1/content/chapter3/section/paragraph 10/theory.html.
54

ответствии с первым началом термодинамики, имеем равенство подведенной к телу теплоты Q
и изменения его внутренней энергии UТД: |
|
UТД = Q. |
(1.2.1) |
В случае нагревания газа в термодинамике обычно рассматривается термодинамическая функция
«теплоемкость газа» Cгаза удельная. С ее помощью можно записать выражение для «тепловой ре-
акции газа» на получение газом избыточной энергии Q:
T = Q/Cгаза удельная · m,
где T – увеличение температуры газа, К; m – масса газа, кг.
Таким образом, теплоемкость рассматривается как коэффициент преобразования внешней энергии в температуру газа, не раскрывая подробности механизма этого преобразования, что характерно для научной методологии XIX в.
Для азота удельная теплоемкость равна 1,042 кДж/кг · К, для водорода 14,300 кДж/кг · К. Различие значений показывает, что один газ (азот) «легко» нагреть, а другой (водород) «сложно».
Теплоемкость газов хорошо изучена теоретически. Для газов даже введено два типа теплоемкости: при постоянном давлении Cгаза p и при постоянном объеме Cгаза V, последняя представляет интерес для вакуумной техники, поскольку с ней связана такая важная для вакуумной техники функция газа, как теплопроводность – температурный обмен.
Допустимо рассматривать теплоемкость и одной молекулы, так как физически повышается именно ее температура и, как следствие, ее скорость.
В разделе 1.1 мы определили, что вакуумная техника и технология – средства и способы, обеспечивающие разрежение газа. Разрежение газа приводит к уменьшению суммарной массы ансамбля газа в фиксированном объеме за счет уменьшения количества свободных молекул в нем и, следовательно, приводит к уменьшению внутренней энергии ансамбля молекул.
Очевидно, что равенство UТД = Q, записанное для случая нагрева газа и повышения внутренней энергии, с точностью до знаков подходит к процессу откачки, когда внешняя энергия используется для того, чтобы уменьшить внутреннюю энергию.
Рассмотрим подробнее, что такое внутренняя энергия газа UТД, которую снижают используемые в вакуумной технике средства откачки77, а также и принципы ее уменьшения.
Внутренняя энергия газа
Известно, что внутреннюю энергию системы молекул нельзя измерить напрямую. Можно определить только ее изменение: UТД = Q – A, где Q – переданная извне энергия, А – работа, совершенная системой молекул при этой передаче. Внешне внутренняя энергия проявляется такими характеристиками газа, как его температура и давление.
Внутренняя энергия газа определяется тремя компонентами:
первый компонент внутренней энергии газа определяется основным уравнением МКТ как произведение кинетической энергии молекул, двигающихся поступательно, но хаотически с близкими к скорости звука тепловыми скоростями и количества этих молекул N;
второй компонент рассматривается в зависимости от степеней свободы молекул и связан с колебательными и вращательными движениями атомов в многоатомной молекуле;
третий компонент внутренней энергии определяется произведением потенциальной энергии взаимодействия молекул с другими молекулами и молекул с внутренними поверхностям вакуумной камеры и количества этих молекул N, а также вероятности их взаимодействия P(N)78.
То есть в термодинамике рассматривается модель неидеального газа с парными взаимодействиями и аддитивностью энергии79.
На рис. 1.2.1 изображена модель двухатомной молекулы. Очевидно, что энергия молекулы складывается из:
кинетической энергии поступательного движения ее как целого (энергия движения центра масс);
77Хамев В.М. Термодинамические процессы и параметрические характеристики вакуумных насосов. Новосибирск: Наука, 1986.
78Требуется дополнительное исследование.
79Вопрос, который не рассмотрен в рамках МКТ.
55
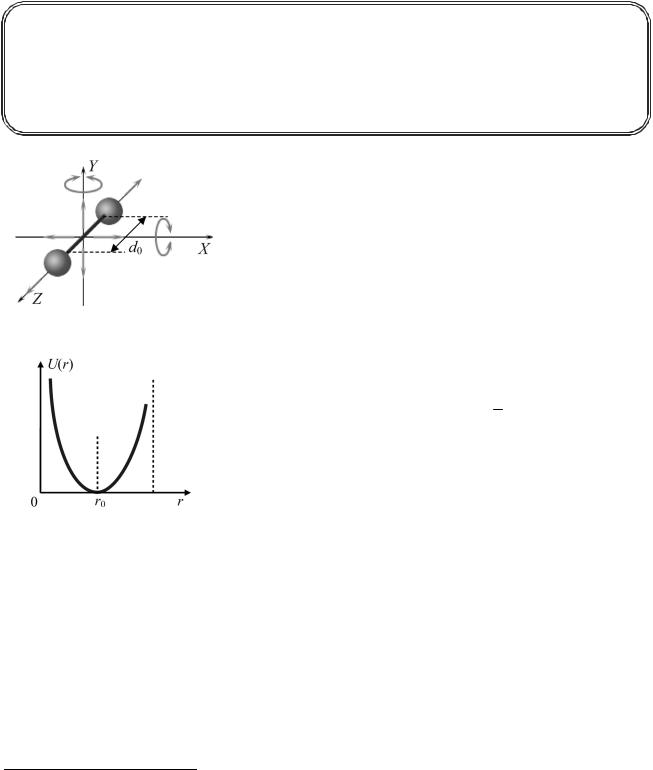
кинетической энергии вращения «связки» относительно осей X и Y и колебания отдельных атомов80 вдоль оси Z;
потенциальной энергии межатомных связей внутри молекулы; потенциальной энергии связей молекулы как целого с другими молекулами или молекулы с по-
верхностью.
В апреле 2009 г. журнал «Nature» сообщил, что учёные из Германии и США в университете Штутгарта создали самую крупную двухатомную молекулу из атомов рубидия, живущую около 1,5 · 10–7 с. Для этого они воспользовались так называемым ридберговским состоянием атома. Расстояние между ядрами рубидия в молекуле – около 10–7 м, а связь между ними поддерживает потенциальная яма, возникающая за счёт нахождения электронов на очень высокой (ридберговской) орбитали.
Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. При обычных температурах вращение около оси Z не происходит.
Возможность каждого независимого движения называется степенью свободы. Таким образом, одноатомная молекула имеет три поступательные степени свободы, «жесткая» двухатомная молекула – пять степеней (три поступательные и две вращательные), а многоатомная молекула – шесть (три поступательные и три вращательные).
Согласно теореме о равномерном распределении энергии по степеням свободы, средняя кинетическая энергия равномерно распределена между всеми степенями свободы, и для каждой
степени свободы молекулы она равна 12 kT – самое известное
выражение в физике.
Потенциальная энергия межатомных связей в таких молекулах обусловлена ковалентной связью, действующей только на расстояниях r ≤ ri, соответствующих перекрытию электронных оболочек атомов. Если атомы расходятся по оси z на расстояние r > ri, то происходит диссоциация (распад) молекулы. Потенциальная энергия межатомных связей внутри устойчивых молекул обычно составляет около 500 кДж/моль, например, для водорода Н2 – 432 кДж/моль, для азота N2 – 942 кДж/моль.
Сила ковалентного взаимодействия зависит только от расстояния r между ядрами атомов и определяется потенциалом взаимодействия U(r). На рис. 1.2.2 представлена эта зависимость.
Точный вид потенциала взаимодействия для атомов81 конкретного газа определяется структурой их электронных оболочек и может быть определён только при решении уравнения Шрёдингера82, однако качественный характер зависимости одинаков для всех веществ.
Функция U(r) определена для всех r из интервала 0 < r ≤ ri с точностью до постоянного слагаемого. В точке минимума r = r0 он обращается в нуль, что определяет устойчивость молекулы. При r < r0 атомы отталкиваются друг от друга, а при r > r0 – притягиваются друг к другу. Для молекулы азота N2 r0 равно 3,2 Å.
80Эта степень свободы обычно не рассматривается, при определении внутренней энергии считают, что атомы связаны жестким «стержнем».
81URL: http://realgas.info/effpot.html.
82См. очень интересное эссе о Шрёдингере и теории молекулярных орбиталей: URL: http://elementy.ru /trefil/64.
56

Потенциальная энергия связей молекулы как целого с другими молекулами или молекулы с поверхностью, определяемая природой дисперсионных сил, которые иллюстрировались на рис. 1.1.4,б потенциалом Леннарда–Джонса83, обычно менее 15 кДж/моль и составляет, например, 2 кДж/моль для Xe2 (для сопоставления: произведение RT для газа при комнатной температуре равно
2477 кДж/моль).
Видим, что потенциальная энергия взаимодействия молекул незначительна (менее 1 %) по сравнению с кинетической энергией газа. Для разреженных газов влияние других (3-й, 4-й и т.д.) молекул еще меньше.
Если система молекул находится в тепловом равновесии T, то кинетическая энергия молекулы равна m v 2, где v – средняя скорость поступательного движения молекулы.
Из сказанного, а также из уравнения (1.2.1) следует, что для газа UТД =i 2kT N , где i – число
2kT N , где i – число
степеней свободы, т. е. при неизменной температуре молекул внешняя работа Q затрачивается только на «организацию переноса» N молекул из объема V во внешнюю сред (или, наоборот, если в системе образовалась течь, через которую молекулы проникают внутрь).
По аналогии с определением эффективности тепловой машины84 эффективность насоса можно определить как отношение количества теплоты, извлеченной из рабочей камеры, к затраченной на этот процесс внешней работе – UТД/ Q. Подобный анализ методов разрежения газа, приведенный по критерию «термодинамический коэффициент полезного действия средств откачки в вакуум-
ной технике», еще не сделан и ждет своего автора.
На рис. 1.2.3 показано, каким образом термодинамический процесс «уменьшение внутренней энергии газа» реализуется с помощью методов и средств, имеющих свои названия в вакуумной технике.
Рис. 1.2.3. Термодинамика и вакуумная техника
83Потенциал Леннарда–Джонса – модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния между ними. Эта модель реалистично передаёт свойства реального взаимодействия молекул и поэтому широко используется в расчётах и при компьютерном моделировании. Суть модели состоит в том, что при больших r молекулы притягиваются. Притяжение обусловлено силами Ван-дер-Ваальса (диполь-дипольное индуцированное взаимодействие). На малых же расстояниях при перекрытии электронных оболочек молекулы отталкиваются.
84Если полезным эффектом является передача машиной некоторого количества тепла Q нагреваемым телам (например, воздуху в помещении), то такая машина называется тепловой или тепловым насосом.
57

Реализация базируется на физических принципах и методах, поддержанных определенными технологиями.
Какой бы принцип снижения внутренней энергии ни использовался, принцип создания вакуума не меняется. Вакуум создается путем удаления газа молекула за молекулой из ансамбля свободных молекул, находящегося в герметично закрытом рабочем объеме. В то время как механические методы откачки предполагают «захват и продавливание» молекул через насос, есть методы, использующие идеологию термодинамики и уменьшающие величину внутренней энергии газа путем снижения температуры вплоть до вымораживания газов до твердого состояния. Вымораживание переводит молекулы из свободного состояния в связанное – возникает так называемая криосорбция газов.
Как же это кажется просто – охладил поверхность вакуумной камеры, и все молекулы прилипли к ней, как прилипают пары воды на окно в виде инея, а в камере образовался вакуум!
К сожалению, на практике все происходит значительно сложнее. Для примера перечислим проблемы, которые возникают при реализации принципа уменьшения внутренней энергии газа методом уменьшения его температуры путем использования различных хладагентов:
1)производство хладагента;
2)доставка, хранение и время сохранения хладагента при его температуре;
3)передача температуры хладагента молекулам газа;
4)образование криоосадка на охлаждаемых элементах (криоосадок это тот самый «иней», но состоящий не из молекул воды, а из молекул газов, сорбированных на охлажденных элементах) и, как результат, ухудшение теплопередачи от хладагента молекулам с падением эффективности метода.
вода при комнатной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
280 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
температуре |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
220 |
|
|
|
|
|
|||
фреоны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
сухой лед СО2 |
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
элемент Пельтье |
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
жидкий азот |
|
|
|
|
|
77 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
жидкий неон |
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
жидкий водород |
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
жидкий гелий |
|
4,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Температура, К |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
50 |
100 |
150 |
200 |
250 |
|
300 |
|||||||||||
|
|
|
|
|
Рис. 1.2.4. Хладагенты в вакуумной технике |
|
|
|
|
|
|
|
|||||||
Выбор того или иного хладагента (рис. 1.2.4) зависит от задачи, связанной с уменьшением внутренней энергии газа – это может быть и откачка молекул путем перевода их из свободного состояния в связанное (используют жидкий гелий), и «активация сорбента»85 при использовании цеолитовых
85 Сорбенты (от лат. sorbens – поглощающий) – твердые тела или жидкости, применяемые для поглощения газов, паров или растворенных веществ. Широко используют природные и искусственные цеолиты, активированный уголь, белый уголь, силикагель, оксид алюминия, диоксид кремния, различные ионообменные смолы, дибутилфталат и др. Твердые сорбенты обладают более высокой кинетикой сорбции за счет более большей удельной поверхности. Твердые сорбенты обладают хорошими показателями по регенеративной способности.
58

насосов для получения форвакуума (используют жидкий азот) и конденсация паров масла в паромасляном насосе (используют воду). В вакуумной технике часто используют ступенчатое понижение температуры молекул со следующей последовательностью: «водяная рубашка», заполняемая проточной водой при комнатной температуре (293 К), затем экраны, охлаждаемые жидким азотом (77 К), затем экраны, охлаждаемые жидким водородом (20 К), затем панели, охлаждаемые жидким гелием
(4,2 К).
Простейший насос. Первый закон или первое начало термодинамики. Вакуумный насос как «демон Максвелла»
Рассмотрим работу простейшего насоса (см. рис. 1.2.5), в котором в корпусе перемещается вниз и вверх поршень. На корпусе насоса имеются два клапана – впускной и выпускной, прижимаемые к уплотнениям пружинками, что обеспечивает герметичность полости V. При движении поршня вниз объем полости V увеличивается, впускной клапан открывается, происходит забор воздуха, например при давлении pа. В термодинамике состояние газа принято изображать на диаграммах, где по оси абсцисс отложено давление р, а по оси ординат – объем V.
На рис. 1.2.5 изображены термодинамические диаграммы, соответствующие циклам работы простейшего воздушного насоса. Процесс забор воздуха отражен на диаграмме а (прямая AB). При последующем движении поршня вверх, впускной клапан закрывается, а в полости V почти по изотерме увеличивается давление p. Рост давления происходит до некоторого значения pс, при котором открывается выпускной клапан. Этот процесс отражен на диаграмме б (гипербола вида p ~ 1/V, в идеальном случае – изотерма – BC). Поршень продолжает движение вверх, но давление в полости V более не растет. Происходит выброс воздуха, например в камеру велосипедной шины. Этот процесс отражен на диаграмме в (прямая CD).
Далее поршень доходит до самой верхней позиции: объем равен нулю. В этот момент можно открыть впускной клапан и давление в насосе станет равным pа (прямая DA, диаграмма d), далее произойдет забор некоторого количества газа pаVВ (прямая АВ, диаграмма а), то есть цикл повторится. Работа, выполненная насосом во время цикла, равна площади, заключенной внутри фигуры ABCD на диаграмме г.
Рис. 1.2.5. Устройство простейшего воздушного насоса и термодинамические диаграммы его работы
После прогрева, например, они получают возможность повторного использования, что особенно актуально для применения в вакуумной технике.
59

Будем считать, что процесс протекает достаточно медленно и в любой момент система молекул близка к своему равновесному состоянию (такие процессы называются квазистатическими). Обязательным условием равновесия термодинамической системы является равенство температур во всех точках.
Именно квазистатические процессы изображены на диаграммах состояния a, б, в, г на рис. 1.2.5.
Установив на входном клапане вакуумную камеру, можно получить процесс разрежения газа в этой камере, так как насос при движении поршня вниз будет отбирать некоторое количество газа уже из камеры, а не из атмосферного воздуха, последовательно понижая в камере давление (точка А на диаграммах будет смещаться вниз по ординате). Этот процесс и составляет технологическую основу откачных средств вакуумной техники (насосов).
На рис. 1.2.6 изображена вакуумная система, состоящая из вакуумной камеры V и насоса. Стрелки на схеме поясняют суть процессов, происходящих в любой вакуумной системе: пунктирная стрелка показывает, что, несмотря на наличие обязательного для вакуумных систем условия nвак << na, существует направленное перемещение насосом молекул из объема V во внешнюю среду, например в атмосферный воздух, что противоречит логике, построенной на стереотипных соображениях типа перепад давлений, диффузия и т.д.; развернутая красная стрелка означает, что путь молекулам из области с повышенной молекулярной концентрацией (из атмосферы) в откачиваемый объем запрещен.
Удаление молекул из вакуумной камеры связано с образованием потока молекул, направленного из вакуумной камеры. При удалении молекул из вакуумной камеры происходит уменьшение внутренней энергии ансамбля молекул, находящегося в замкнутой камере, так как внутренняя энергия, в первую очередь, определяется количеством молекул.
Вакуумный насос совершает работу Q над ансамблем молекул газа, заключенным в объеме V при температуре Т, образуя поток молекул, и при этом происходит изменение внутренней энергии газа UТД ≈ Q, что соответствует первому закону или первому началу термодинамики.
Рис. 1.2.6. Вакуумная система, реализующая процесс разрежения газа
Задача, которую «решает» насос, изображенный на рис. 1.2.6, схожа с классической демонстрационной задачей термодинамики, решаемой «демоном Максвелла»86.
«Демон Максвелла» – гипотетическое разумное существо микроскопического размера, придуманное Максвеллом в 1867 году для иллюстрации кажущегося парадокса второго начала термодинамики и разрешающее пролетать из левой части системы А (рис. 1.2.7) через люк в перегородке в правую часть В только быстрым (горячим) молекулам газа, а медленным (холодным) молекулам – только из правой части камеры в левую. Через некоторый промежуток времени, горячие молекулы
86 Демон Максвелла: URL: http://ru.wikipedia.org/wiki/
60
