
химия биополимеров часть1
.pdfГосударственное бюджетное образовательное учреждение высшего профессионального образования
«Омский государственный медицинский университет» Министерства здравоохранения Российской Федерации
ХИМИЯ БИОПОЛИМЕРОВ
Часть 1. Основы строения и реакционной
способности органических соединений
Учебное пособие для студентов I курса специальности
32.05.01 Медико-профилактическое дело
ОМСК – 2016
УДК 54(076)
ББК 24я73
Р 84
Степанова И.П., Ганзина И.В., Мендубаева З.А., Мугак В.В, Атавина О.В., Постнова Т.В.
Биоорганическая химия. Часть 1. Основы строения и реакционной способности органических соединений: Учебное пособие для студентов I курса специальности:
32.05.01 Медико-профилактическое дело. – Омск: Изд-во ОмГМУ, 2016. – 138 с.
Авторы: И.П. Степанова, И.В. Ганзина, З.А. Мендубаева, В.В. Мугак, О.В. Атавина, Т.В. Постнова
Рецензенты:
Доктор медицинских наук, профессор В.Д. Конвай – профессор кафедры
математических и естественнонаучных дисциплин ФГБОУ ВПО |
ОмГАУ |
им. П.А. Столыпина. |
|
Кандидат химических наук, доцент М.А. Воронцова – доцент |
кафедры |
органической химии ФГБОУ ВПО ОмГУ им. Ф.М. Достоевского. |
|
ISBN
Учебное пособие для подготовки к занятиям дисциплины «Химия биополимеров» Часть 1. Основы строения и реакционной способности органических соединений включает содержание разделов дисциплины и перечень контролируемых учебных элементов; инструкцию по охране труда и технике безопасности для студентов при работе в лабораториях кафедры химии. Пособие содержит методические материалы, включающие цель, план и содержание занятия; типовые обучающие задачи, тестовые задания, вопросы для подготовки к занятиям, контрольные задания к каждой теме. Для подготовки к экзамену по дисциплине «Химия биополимеров» представлен кодификатор элементов содержания экзаменационной работы, ее характеристика, пример экзаменационной работы, инструкция по ее выполнению и критерии оценивания.
Учебное пособие предназначено для студентов 1-ого курса ОмГМУ специальности
32.05.01 Медико-профилактическое дело.
И.П. Степанова, И.В. Ганзина, З.А. Мендубаева, В.В. Мугак, О.В. Атавина, Т.В. Постнова ГБОУ ВПО «ОмГМУ» министерства здравоохранения РФ, 2016
СОДЕРЖАНИЕ
Предисловие…...........................................................................................
1Тематические разделы дисциплины «Химия биополимеров»...
1.1Основы строения, классификация и номенклатура органических соединений………….………………………………..
1.2Сопряжение, электронные эффекты заместителей....................
1.3Изомерия органических соединений...........................................
2Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии...................
3Кодификатор экзаменационной работы дисциплины «Химия биополимеров» и инструкция по ее выполнению..........
Заключение....…………………………....………………….……………
Глоссарий…………………………………………..…………………….
Ответы на тестовые задания...………....………………………………..
Список литературы…......……….....…………………………………….
Приложения……………………………………………………….……...
Предисловие
Учебное пособие дисциплины «Биоорганическая химия. Часть 1. Основы строения и реакционной способности органических соединений» рекомендовано студентам 1-ого курса специальности 32.05.01 Медикопрофилактическое дело Омского государственного медицинского университета в качестве пособия для самостоятельной подготовки к лабораторным занятиям, контрольным работам и зачету по дисциплине «Химия биополимеров». Содержание учебного пособия соответствует рабочей программе, составленной на основе Федерального государственного образовательного стандарта высшего профессионального образования.
Пособие, также как и рабочая программа, составлено по модульному принципу и является необходимой составной частью учебно-методического комплекса по химии.
Учебное пособие включает следующие разделы:
-тему и содержание занятий;
-типовые задания с анализом их решения;
-контрольные вопросы и задания;
-инструкцию по технике безопасности при работе в химической лаборатории;
-характеристику экзаменационной работы и инструкцию по ее выполнению.
Структура занятий включает по каждой теме теоретическое введение, типовые задания с анализом их решения, контрольные вопросы, ориентирующие студента при самостоятельной работе с литературой, ситуационные задачи, носящие практикоориентированный характер, список литературы.
Содержание всех компонентов структуры пособия позволит студентампервокурсникам закрепить пройденный программный материал и будет способствовать его более глубокому и прочному усвоению, что очень важно для будущего врача, поскольку химия входит в число наук, составляющих фундамент современной медицины.
Медико-биологическая направленность предлагаемых заданий значительно расширит представления студентов-первокурсников о тесной связи химии и медицины, а также роли химии и ее методов в прогнозировании, диагностике и выявлении молекулярных механизмов возникновения различных заболеваний. Это открывает большие возможности для использования более эффективных средств их профилактики и лечения.
Обучение по дисциплине «Химия биополимеров» складывается из аудиторных занятий (4 часа), включающих лекционный курс (12 часов) и
лабораторные занятия, и самостоятельной работы (28 часов). В соответствии с требованиями ФГОС ВПО в учебном процессе широко используются активные и интерактивные формы проведения занятий.
Лекционный материал подается в форме электронных презентаций, проблемных лекций, лекции-визуализации. Основное учебное время выделяется на лабораторные практикумы по закреплению знаний и получение практических навыков. Занятия проводятся в виде семинаров, лабораторных работ с использованием наглядных пособий, решением ситуационных задач, тестовых заданий.
Для организации самостоятельной работы студентов используются технологии направляющего текста, проблемного обучения, дидактических задач, обеспечивающие дифференцированный подход к обучаемым и возможность организовывать индивидуальную и групповую работу. Работа с учебной литературой рассматривается как вид учебной работы по дисциплине и выполняется в пределах часов, отводимых на её изучение. Каждый обучающийся обеспечен доступом к библиотечным фондам Университета и кафедры.
При подготовке к занятию студенты самостоятельно изучают учебную литературу, оформляют домашние задания и рефераты и представляют доклады на конференцию. Самостоятельная работа способствует формированию активной жизненной позиции поведения, аккуратности, дисциплинированности.
Исходный уровень знаний студентов определяется тестированием, проверкой выполнения домашнего задания, текущий контроль усвоения предмета определяется устным опросом в ходе занятий, ответами на тестовые задания и контрольные вопросы.
Изучение дисциплины завершается сдачей экзамена. Для подготовки к экзамену представлен кодификатор экзаменационной работы по дисциплине «Химия биополимеров», характеристика и пример экзаменационного билета, инструкция по его выполнению.

1. ТЕМАТИЧЕСКИЕ РАЗДЕЛЫ ДИСЦИПЛИНЫ «ХИМИЯ БИОПОЛИМЕРОВ»
1.1 ОСНОВЫ СТРОЕНИЯ, КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органическая химия – это химия углеводородов и их производных. Биоорганическая химия как раздел органической химии изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций. Биоорганическая химия как учебная дисциплина основное внимание уделяет вопросам строения и реакционной способности биологически значимых соединений.
Особенности органических веществ:
•Многообразие в природе: около 27 млн. (неорганических веществ – около
100 тысяч).
•Образуются небольшим количеством атомов-неметаллов, которые получили названия органогены: С, Н, О, N (реже S, Р, галогены).
Атомы в составе молекулы соединены между собой в определенном порядке, в соответствии с их валентностью. Атом углерода
четырехвалентен.
Порядок соединения атомов называется химическим строением молекулы и отображается с помощью структурных формул.
|
|
H |
|
H |
|
|
H C |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
C |
H |
|
|
C |
|
|
C |
|
|
H |
|||||
H |
|
C |
|
C |
|
H |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
H |
|
H |
|
|
H C |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
|
C |
|
C |
|
OH |
|
|
|
|
H |
|
C |
|
|
C |
|
Cl |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
H |
|
|
Cl |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||

Химическая связь
|
|
|
|
|
|
|
|
|
|
Ковалентная |
Ионная |
|||
Δχ < 1,7 |
Δχ > 1,7 |
|||
|
|
|
|
|
|
|
|
|
|
Ковалентная |
Ковалентная |
|||
полярная |
неполярная |
|||
0 < Δχ < 1,7 |
Δχ = 0 |
|||
Основные связи – ковалентные:
По полярности различают:
•С–С – неполярные ковалентные связи;
•С–Н – малополярные ковалентные связи;
•С–О; С–N – полярные ковалентные связи.
По симметрии орбиталей различают:
•σ-Cвязь – ковалентная связь, образованная при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов:
. . |
. |
. |
. |
. |
|
s |
s |
s |
sp3 |
sp3 |
sp3 |
•π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных p-орбиталей. При этом локализованные p-атомные орбитали делокализуются, образуя π-орбитали:
. . |
. . |
двe p-атомныe орбитали |
-связывающая молeкулярная орбиталь |

По порядку связи различают:
• Одинарные (1 σ-связь), например, в молекуле этана (длина связи 0,154
нм):
H H
H C C H
HH
•Двойные (1 σ-связь и 1 π-связь), например, в молекуле этилена (0,134 нм):
H C C H
HH
•Тройные (1 σ-связь и 2 π-связи), как например, в молекуле ацетилена
(0,120 нм):
HC C H
C H
Ионная связь встречается в органических соединениях редко:
CH3 COO- Na+
Водородные связи поддерживают вторичную структуру белков. В α-структуре белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя спираль:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
O |
|
|
|
H |
|
|
|
|
|
|
O |
|
|
|
H |
|
|
|
|
|
|
|
O |
|
|
H |
|
|
|
|
O |
|
|
|
H |
|
|
|
O |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
C |
|
|
|
N |
|
|
|
CH |
|
|
C |
|
|
N |
|
|
CH |
|
C |
|
|
|
N |
|
|
CH |
|
C |
|
|
||||||||||||||||
|
|
|
|
C |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
CH |
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH2 |
|
|||||||||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
CH3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В основном органические вещества имеют молекулярное строение.

Для них характерна низкая температура плавления, соединения непрочные.
Атом углерода образует связи в состоянии:
•sp3-гибридизации (характерна для алканов): H3С–СH3;
•sp2-гибридизации (характерна для алкенов): H2С=СH2;
•sp-гибридизации (характерна для алкинов): HС≡СH.
Гибридизация – процесс выравнивания энергии и образование равноценных по форме и энергии орбиталей.
Электронное строение атома углерода в основном состоянии: 1s22s22p2. При возбуждении происходит распаривание электронов 2s-орбитали, в результате образуется четыре неспаренных электрона:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s2 |
|
2s2 |
|
2p2 |
|
2s1 |
|
2p3 |
||||||
|
|
|
|
|
|
|
|
1s2 |
|
|
||||
H |
|
C |
: |
|
|
H |
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
H |
|
• |
|
H |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
H |
||||
• sp3-Гибридизация. В этом случае выравниваются энергии одной 2s- и трёх 2p-орбиталей, при этом образуются 4 одинаковые sp3-орбитали:
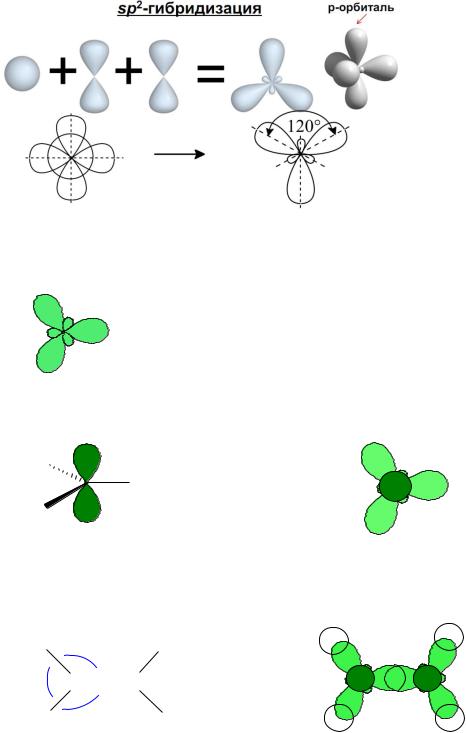
• sp2-Гибридизация. Энергии одной 2s- и двух 2p-орбиталей выравниваются, при этом образуются 3 одинаковые sp2-орбитали и остаётся одна негибридная p-орбиталь:
Гибридные орбитали отталкиваются друг от друга, образуя треугольную (тригональную) структуру, поэтому атом углерода в состоянии sp2-гибридизации называется тригональным:
Негибридная p-орбиталь располагается перпендикулярно плоскости, проходящей через три гибридные орбитали:
Три sp2-гибридные орбитали участвуют в образовании трёх σ-связей: например в этилене:
H ~120o H
~120o C C
C
H ~120o H
