
химия биополимеров часть1
.pdf03. НАЗОВИТЕ СОЕДИНЕНИЕ ПО ЗАМЕСТИТЕЛЬНОЙ НОМЕНКЛАТУРЕ IUPAC:
СН3–СН=СН–СН(СН3)–СН(NH2)–СН3
1)3-метилгептен-4-амино-2
2)3-метилгексен-4-амино-2
3)3-метилгексен-4-амин-2
4)4-метилгептен-2-амин-5
04.СРЕДИ СЛЕДУЮЩИХ СОЕДИНЕНИЙ УКАЖИТЕ ГОМОЛОГ СОЕДИНЕНИЮ:
СНз – СН2 – СН2 – СООН
1)СНз – СН2 – СОО – СH3
2)СНз – СОО – СН2– СH3
3)СНз – СН2 – СН2 – СОО – СH3
4)СНз – СН2 – СН2 – СН2 – СООН
05.СРЕДИ СЛЕДУЮЩИХ ВЕЩЕСТВ УКАЖИТЕ ГОМОЛОГИ
1)уксусная кислота и метиловый эфир муравьиной кислоты
2)формальдегид и ацетальдегид
3)метанол и диметиловый эфир
4)бутен-1 и бутадиен-1,3
Установите соответствие |
|
|
|
|
||||
06. УСТАНОВИТЕ |
СООТВЕТСТВИЕ |
МЕЖДУ |
СТРУКТУРНОЙ |
|||||
ЕДИНИЦЕЙ |
ОРГАНИЧЕСКОГО |
СОЕДИНЕНИЯ |
И |
ЕЕ |
||||
ХАРАКТЕРИСТИКОЙ |
|
|
|
|
|
|
||
СТРУКТУРНАЯ |
ХАРАКТЕРИСТИКА |
|
|
|
||||
|
ЕДИНИЦА |
|
|
|
|
|
|
|
А) |
|
|
|
1) остаток молекулы, из которой удалены |
|
|||
характеристическая |
один или несколько атомов водорода, при |
|
||||||
группа |
|
|
этом остаются свободными одна или |
|
||||
|
|
|
|
несколько валентностей |
|
|
|
|
Б) |
родоначальная |
2) химическая структура, |
составляющая |
|
||||
структура |
|
|
основу соединения |
|
|
|
||
В) |
органический |
3) атом или группа атомов, определяющие |
|
|||||
радикал |
|
|
принадлежность |
соединения |
к |
|
||
|
|
|
|
определённому классу и ответственные за |
|
|||
|
|
|
|
его химические свойства |
|
|
|
|
Г) заместитель |
|
4) любой атом |
или группа |
атомов, |
|
|||
|
|
|
|
замещающие в |
исходном |
органическом |
|
|
соединении атом водорода
|
А |
Б |
|
В |
|
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
07. УСТАНОВИТЕ |
СООТВЕТСТВИЕ |
МЕЖДУ |
НАЗВАНИЕМ |
||||
СОЕДИНЕНИЯ И ОБЩЕЙ ФОРМУЛОЙ ГОМОЛОГИЧЕСКОГО РЯДА, К КОТОРОМУ ОНО ПРИНАДЛЕЖИТ
|
НАЗВАНИЕ СОЕДИНЕНИЯ |
ОБЩАЯ ФОРМУЛА |
|||||||
|
А) мета-ксилол |
1) |
СnН2n–6 |
|
|
|
|
||
|
Б) циклопентан |
2) |
СnН2n–4 |
|
|
|
|
||
|
В) пентадиен-1,3 |
3) |
СnН2n–2 |
|
|
|
|
||
|
Г) гептин-2 |
4) |
СnН2n |
|
|
|
|
||
|
|
|
5) |
СnН2n+2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
Б |
|
В |
|
|
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
08. УСТАНОВИТЕ |
СООТВЕТСТВИЕ |
МЕЖДУ |
НАЗВАНИЕМ |
||||||
ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ И КЛАССОМ, К КОТОРОМУ ОНО ПРИНАДЛЕЖИТ
НАЗВАНИЕ |
|
|
|
КЛАСС СОЕДИНЕНИЙ |
|||
СОЕДИНЕНИЯ |
|
|
|
||||
|
|
|
|
|
|
||
А) толуол |
|
1) |
простой эфир |
|
|||
Б) 2-метилбутанол-1 |
|
2) |
одноатомный спирт |
|
|||
В) изопропилэтаноат |
|
3) |
ароматический спирт |
|
|||
Г) ацетон |
|
4) |
кетон |
|
|||
|
|
|
5) |
ароматический углеводород |
|||
|
|
|
6) |
сложный эфир |
|
||
|
|
|
|
|
|
|
|
А |
|
Б |
|
|
В |
|
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
09. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ ФОРМУЛОЙ РАДИКАЛА И ЕГО НАЗВАНИЕМ
ФОРМУЛА РАДИКАЛА |
|
|
НАЗВАНИЕ РАДИКАЛА |
|||
А) H2C=CH– |
|
1) |
аллил (пропенил-2) |
|
||
Б) –CH(CH3)2 |
|
2) |
фенил |
|
||
В) –C6H5 |
|
3) |
изопропил |
|
||
Г) –СН2 – C6H5 |
|
4) |
винил (этенил) |
|
||
|
|
5) |
метил |
|
||
|
|
6) |
бензил |
|
||
|
|
|
|
|
|
|
А |
Б |
|
|
В |
|
Г |
|
|
|
|
|
|
|

10. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ ФОРМУЛОЙ СОЕДИНЕНИЯ И ЕГО НАЗВАНИЕМ ПО ЗАМЕСТИТЕЛЬНОЙ НОМЕНКЛАТУРЕ IUPAC
ФОРМУЛА СОЕДИНЕНИЯ |
НАЗВАНИЕ СОЕДИНЕНИЯ |
|||||
А) НО–СН2–СН2–ОН |
|
1) |
этантиол |
|
||
Б) Н3С–СН2–SН |
|
2) |
2-гидроксибутен-3-аль |
|
||
B) Н2С=СН–СН(ОН)–СНО |
3) |
этандиол |
|
|||
Г) H3C–CН(NH2)–CН=CH–CH3 |
4) |
пентен-3-амин-2 |
|
|||
|
|
|
5) |
2-гидроксибутен-3-аль-1 |
|
|
|
|
|
6) |
2,3,3-диметилпентен-1 |
|
|
|
|
|
|
|
|
|
А |
|
Б |
|
В |
|
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Назовите по правилам заместительной номенклатуры IUPAC соединения:
a) HOOC-CH2-CH-CH2-COOH |
б) CH3-CH=CH-CH-CH-COOH |
||
|
| |
| |
| |
|
OH |
CH3 |
SH |
в) (CH3)2CH-CH-CH-COOH |
г) H2C=C-CH-CH2-CHO |
||
| |
| |
| | |
|
Br |
OH |
CH3 NH2 |
|
2. Напишите структурные формулы соединений:
а) 2,3,4,5 – тетрагидроксипентаналь б) 2 – оксопентандиовая кислота в) 3,4,4 – триметилпентанамин – 2 г) 7-метил-4-этилоктен-5-тиол-3
Литература
Основная литература
1. Тюкавкина Н. А. Биоорганическая химия [Электронный ресурс] : учебник. Глава 1. Классификация и номенклатура органических соединений / Тюкавкина Н.А., Бауков Ю. И., Зурабян С. Э. // Москва : Гэотар-Медиа, 2014.
– 416 с. Режим доступа : http://www.studmedlib.ru/ru/book/ISBN9785970427835.html
Дополнительная литература
1. Биоорганическая химия [Электронный ресурс] : руководство к практическим занятиям / под ред. Н. А. Тюкавкина // Москва : Гэотар-Медиа, 2014. – 168 с. Режим доступа : http://www.studmedlib.ru/ru/book/ISBN9785970428214.html
2.Руководство к лабораторным занятиям по биоорганической химии : учеб. пособие для студентов вузов / под ред. Н. А. Тюкавкина // Москва : ДРОФА,
2006. – 319 с.
3.Тюкавкина Н. А. Биоорганическая химия: учеб. для студентов [мед.] вузов / Н. А. Тюкавкина, Ю. И. Бауков // Москва : Дрофа, 2005. – 542 с.
Электронные образовательные ресурсы
Базы данных, информационно-справочные и поисковые системы:
1.Электронная библиотека ОмГМУ: http://weblib.omsk-osma.ru;
2.Электронно-библиотечная система «КнигаФонд»: http://www.knigafund.ru;
3.ЭБС «Консультант студента. Электронная библиотека медицинского вуза» http://www.studmedlib.ru;
4.Научная электронная библиотека: http://elibrary.ru/defaultx.asp;
5.База данных Scopus: http://www.scopus.com.

1.2 СОПРЯЖЕНИЕ. АРОМАТИЧНОСТЬ. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Сопряжёнными называются системы с чередующимися простыми и кратными связями или системы, в которых у атома соседнего с двойной связью есть p-орбиталь с неподелённой парой электронов.
Сопряжённые системы бывают с открытой и замкнутой цепью сопряжения.
Сопряжённые системы с открытой цепью
π, π-Сопряжение. Этот вид сопряжения можно рассмотреть на примере бутадиена–1,3. В молекуле этого вещества все атомы углерода находятся в состоянии sp2-гибридизации и расположены в одной плоскости. Соединяясь между собой σ-связями, они образуют плоский σ-скелет молекулы.
Негибридизованные рz-орбитали каждого атома углерода расположены перпендикулярно плоскости σ-скелета и параллельны друг другу. Это создаёт условия для их взаимного перекрывания, обобществления р-электронов и образования единой сопряжённой делокализованной (равномерно распределенной) π-электронной системы. Так возникает π, π-сопряжение вследствие перекрывания рz-орбиталей π-связей.
H H
H H 





 H
H
H 












 H
H
H
H H
H H
H H
H
H
H H

p, π-Сопряжение. Рядом с двойной связью может находится гетероатом Х (О, N, S и др.), имеющий свободную р-орбиталь с неподелённой парой электронов. pz-Орбиталь гетероатома взаимодействует с π-связью, образуя р,π-сопряжённую систему.
|
|
|
|
|
H2C = CH – X: |
|
|
|
|
|
|
|||||
|
|
|
. . . |
|
|
|
. |
|
|
|
|
+ |
|
|||
H C |
|
CH |
|
Cl . |
H C |
|
CH |
|
CH |
2 |
H C |
|
CH |
|
CH |
2 |
|
|
|
|
|
||||||||||||
2 |
|
|
. . |
2 |
|
|
|
|
2 |
|
|
|
|
|||



 +
+
Таким образом, сопряжение в открытых системах возникает при следующих условиях:
1.Все атомы, участвующие в образовании системы находятся в состоянии sp2-гибридизации. Соединяясь между собой σ-связями, образуют плоский σ- скелет молекулы.
2.pz-Орбитали всех атомов перпендикулярны плоскости σ-скелета и параллельны друг другу.
Сопряжённые системы с замкнутой цепью сопряжения
В циклических молекулах при определённых условиях может возникнуть замкнутая сопряжённая система. Она называется ароматической. Примером такой системы является молекула бензола, в которой все 6 атомов углерода находятся в состоянии sp2-гибридизации. Атомы, соединяясь между собой σ-связями, образуют замкнутый цикл. Система связей С-С и С-Н составляет плоский σ-скелет молекулы. Шесть рz-орбиталей атомов углерода располагаются перпендикулярно этой плоскости и параллельны друг другу. Взаимно перекрываясь, они образуют замкнутую сопряжённую систему, в которой единое π-электронное облако охватывает 6 атомов углерода. Такая система является ароматической.
Критерии ароматичности (Хюккель, 1931 г.):
1.Молекула имеет циклическое строение.
2.Все атомы цикла находятся в состоянии sp2-гибридизации, образуя плоский σ-скелет молекулы. рz-Орбитали параллельны друг другу, и перпендикулярны плоскости σ-скелета.
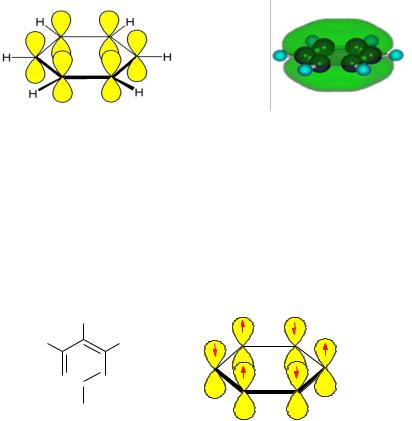
3. Существует единая сопряжённая π-электронная система, охватывающая все атомы цикла и содержащая (4n+2) π-электрона (правило Хюккеля), где n – натуральный ряд чисел; n=0,1,2,3…
Бензол отвечает правилу Хюккеля. Ароматическая система бензола содержит (4·1+2) = 6 π-электронов. При решении уравнения n=1, следовательно, бензол ароматическая система.
H
H H
H
 H
H
H
Конденсированные бензоидные соединения (нафталин и др.) также отвечают критериям ароматичности.
Природные гетероциклические соединения также отвечают критериям ароматичности, например, имидазол, пиррол, пиридин, пиримидин, фуран, тиофен и др.
Критерии ароматичности можно рассмотреть на примере пиридина:
1.Молекула пиридина имеет циклическое строение.
2.Все атомы цикла, включая атом азота, находятся в состоянии sp2- гибридизации. Они, соединяясь между собой σ-связями, образуют плоский σ- скелет молекулы. pz-Орбитали каждого атома цикла располагаются перпендикулярно плоскости σ-скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
3.Существует единая π-электронная система, охватывающая все атомы цикла и включающая по правилу Хюккеля (4n+2) = 6π-электронов. При решении уравнения n=1 – натуральное число. В ароматический секстет поставляют по одному электрону пять атомов углерода и пиридиновый атом азота.

В молекуле пиридина электронная плотность единого π-электронного облака смещена в сторону более электроотрицательного атома азота. Такая система называется π-недостаточной.
Пиридиновый атом азота поставляет в сопряженную цепь один электрон и сохраняет пару электронов вне сопряженной цепи. За счет этой электронной пары пиридин проявляет свойства органического основанияпротолита, т.к. способен присоединять протон по донорно-акцепторному механизму с образованием пиридиний-катиона.
Молекула пиррола также отвечает всем критериям ароматичности. По правилу Хюккеля: 4n + 2 = 6πе̅. При решении уравнения n = 1 – натуральное число.
H H
|
|
|
. |
H |
.. |
H |
N H |
|
N |
|
|
|
H |
|
|
В пиррольном атоме азота, находящемся в состоянии sp2- гибридизации, три гибридные орбитали участвуют в образовании σ-связей с двумя атомами углерода и атомом водорода. Негибридная рz-орбиталь поставляет пару электронов в ароматический секстет. В молекуле пиррола 6- электронное π-облако делокализовано на пяти атомах цикла. Такая система называется π-избыточной или суперароматической. К таким системам также относятся имидазол, фуран, тиофен и др.
Образование сопряжённой системы приводит к выравниванию длин связей, делокализации – равномерному распределению электронной плотности в молекуле и снижению энергетического уровня системы. Всё это способствует стабилизации молекулы. О термодинамической устойчивости сопряжённой системы можно судить по величине энергии сопряжения. Это разность полной π-электронной энергии несопряжённой системы и π- электронной энергии сопряжённой системы. Таким образом, энергия

сопряжения – это та энергия, которая выделяется при образовании сопряжённой системы. Чем выше энергия сопряжения, тем стабильней система. В системах с открытой цепью, чем длиннее цепь сопряжения, тем выше энергия сопряжения и стабильней молекула, например витамины, каратиноиды и др. Замкнутые сопряжённые системы более стабильны, чем открытые. Для бензола энергия сопряжения равна 150,6 кДж/моль, а для бутадиена-1,3 энергия сопряжения равна 15 кДж/моль.
Индуктивный эффект
В органических соединениях имеются σ- и π-связи, которые могут быть как полярными, так и неполярными. Неполярные ковалентные связи возникают между атомами с одинаковой величиной электроотрицательности, например в молекуле н-пропана. В органических соединениях атомы углерода могут быть связаны с атомами О, N, S, галогенов, т.е. гетероатомами, имеющими более высокую электроотрицательность, чем атомы углерода. Это способствует поляризации ковалентных связей, например, в молекуле 1-хлорпропан. Гетероатом или заместитель вызывает поляризацию не только своей σ-связи, но и передаёт влияние на соседние σ- связи, проявляя индуктивный эффект.
Индуктивный эффект – это передача электронного влияния заместителя по цепи σ-связей. Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более электроотрицательного элемента. Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших атомах углерода, а через 3- 4 связи он затухает.
Заместители, смещающие электронную плотность по цепи σ-связей в свою сторону, проявляют отрицательный индуктивный (-I) эффект.
Отрицательный индуктивный эффект проявляют заместители, которые содержат атомы с большей электроотрицательностью, чем у углерода: -F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др. Это электроноакцепторные заместители (ЭА). Они снижают электронную плотность в углеродной цепи.
H3C CH2 CH2 CH2 CH2 F
Заместители, смещающие электронную плотность от себя в сторону углеродной цепи, проявляют положительный индуктивный (+I) эффект. Это электронодонорные (ЭД) заместители, например, радикалы метил и этил, натрий, калий и др.

Наряду с индуктивным эффектом заместителей, в молекулах органических соединений проявляется мезомерный эффект, действующий только в сопряжённых системах.
Мезомерный эффект в открытых и замкнутых системах
Мезомерный эффект – это передача электронного влияния заместителя по сопряжённой системе. Действие мезомерного эффекта заместителей проявляется как в открытых, так и замкнутых системах.
Мезомерный эффект в открытых сопряжённых системах
Мезомерный эффект можно рассмотреть на примере соединения пентадиен-2,4-аль. В данном случае карбонильную группу можно рассматривать как заместитель, появившийся в молекуле бутадиена-1,3 вместо атома водорода. Альдегидная группа и другие заместители, содержащие кратные связи (карбоксильная группа, сульфогруппа, нитрогруппа и др.), содержащие кратные связи, вступая в π,π-сопряжение с сопряжённой системой и оттягивая электронную плотность в свою сторону, снижают её в сопряжённой системе. Они проявляют отрицательный мезомерный эффект.
Отрицательный мезомерный (-М) эффект – оказывают электроноакцепторные (ЭА) заместители. Графически действие мезомерного эффекта изображают изогнутой стрелкой, начало которой показывает какие (π- или р-электроны) смещаются, а конец – связь или атом, к которым смещается электронная плотность.
Наряду с отрицательным мезомерным эффектом, заместитель -CHO также проявляет отрицательный индуктивный (-I) эффект. Необходимо учитывать результирующее действие электронных эффектов заместителей. В данном случае их действие согласованно и приводит к снижению электронной плотности в сопряжённой системе. Характеристика заместителя -CHO с учётом проявляемых эффектов: (-М, -I) – электроноакцепторный заместитель.
Мезомерный эффект в замкнутых сопряжённых системах
Положительный мезомерный эффект можно рассмотреть на примере фенола. В молекуле фенола гидоксигруппа (-OH) – заместитель, появившийся в молекуле бензола вместо атома водорода. Гидроксигруппа и другие заместители, содержащие гетероатом с неподелённой парой электронов (-NH2, -Cl, -Br, -I, -OR, -SH и др.), поставляют пару электронов в сопряжённую систему, вступая с ней в р,π-сопряжение, и повышают в ней
