
- •Конспект лекций*
- •Ведущий лектор:
- •1.1. Строение атома и периодическая система д.И. Менделеева.
- •2. Основные сведения по теории строения атома.
- •Экспериментально квантование энергии атомов обнаруживаегся в их
- •3. Квантово-механическая модель атома водорода.
- •4. Характеристика состояния электрона в атоме системой квантовых чисел. Атомные орбитали.
- •5. Принципы формирования электронной структуры атомов.
- •Соответственно принципу минимальной энергии и правилам Клечковского заполнение энергетических подуровней происходит в следующем порядке :
- •6. Периодическая система д.И. Менделеева как естественная классификация элементов по электронному строению.
- •6.1. Периодическая система д.И. Менделеева и электронная структура.
- •6.2. Структура периодической системы химических элементов.
- •Лекция 2. Химическая связь
- •1. Основные типы и характеристики химической связи
- •Энергия химической связи (кДж/моль) - это количество энергии, выделяющееся при образовании химической связи или затрачиваемое на ее разрыв.
- •2. Ионная связь
- •Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
- •Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
- •Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:
- •4. Металлическая связь
- •5. Основные виды межмолекулярного взаимодействия.
- •6. Донорно-акцепторное взаимодействие
- •7. Водородная связь.
- •Раздел 2. Основные закономерности протекания химических процессов.
- •1.Основные понятия термодинамики.
- •2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
- •3. Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
- •При нормальных температурах и незначительном изменении s:
- •4. Термодинамические представления о равновесном состоянии.
- •Химическая кинетика
- •Химическое и адсорбционное равновесие
- •Лекция 5. Растворы.
- •3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
- •4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
- •5. Произведение растворимости. Механизм накипеобразования.
- •Осадок кристаллизация раствор
- •6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
- •Лекция 6. Электрохимические процессы
- •1. Понятие об электродном потенциале
- •Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- •2. Гальванические элементы
- •3. Стандартный водородный электрод и водородная шкала потенциалов
- •Пример 2 Уравнение
- •Электролиз. Законы фарадея
- •1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
- •2. Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- •Коллоидные растворы.
- •Общие свойства металлов
- •Разбавленная азотная кислота восстанавливается малоактивными
- •Алканы.
- •Непредельные углеводороды.
- •Нафтены ( циклопарафины ).
- •Ароматические углеводороды.
- •Список рекомендуемой литературы
Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
Максимальное
перекрывание облаков, образующих
![]() -связи,
совпадает с линией, соединяющей центры
атомов. Пространственное расположение
-связи,
совпадает с линией, соединяющей центры
атомов. Пространственное расположение
![]() -связей
определяет пространственную конфигурацию
молекул. Например, молекулы
-связей
определяет пространственную конфигурацию
молекул. Например, молекулы
![]() и
и![]() имеют
линейное строение (рис.5).
имеют
линейное строение (рис.5).
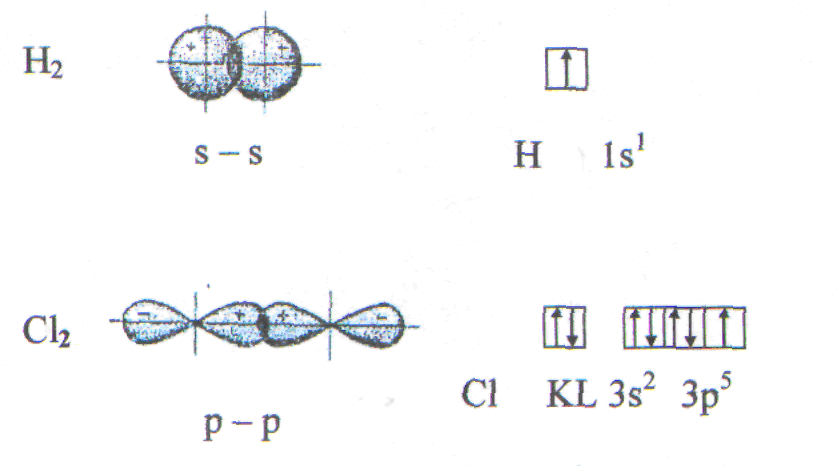
Рис.5. Образование молекул водорода и хлора.
Пи
- связь (![]() -)
- это связь, образованная перекрыванием
атомных орбиталей по обе стороны линии,
соединяющей ядра атомов (рис.4). Например,
в молекуле
-)
- это связь, образованная перекрыванием
атомных орбиталей по обе стороны линии,
соединяющей ядра атомов (рис.4). Например,
в молекуле![]() - одна
- одна![]() - связь и две
- связь и две![]() - связи.
- связи.
При
наложении
![]() - связи на
- связи на![]() - связь образуется двойная связь
(например,
в молекулах
- связь образуется двойная связь
(например,
в молекулах
![]() ,
,![]() ,
,![]() ).Хотя
энергия
).Хотя
энергия
![]() - связи меньше, чем энергия
- связи меньше, чем энергия![]() - связи, однако суммарная энергия двойной
связи выше энергии одинарной связи, а
длина двойной связи меньше длины
одинарной связи. При наложении двух
- связи, однако суммарная энергия двойной
связи выше энергии одинарной связи, а
длина двойной связи меньше длины
одинарной связи. При наложении двух![]() - связей на
- связей на![]() - связь возникает тройная связь, энергия
которой выше, а длина связи ниже, чем
энергии и длины простой и двойной связей.
(см. таблицу 1).
- связь возникает тройная связь, энергия
которой выше, а длина связи ниже, чем
энергии и длины простой и двойной связей.
(см. таблицу 1).
Таблица 1
Энергии
![]() и
длины
и
длины![]() некоторых
химических связей.
некоторых
химических связей.
|
Связь |
|
|
|
Связь |
|
|
|
H-F |
536 |
0,092 |
|
C - C |
348 |
0,154 |
|
|
432 |
0,128 |
|
C = C
|
614 |
0,134 |
|
H-Br |
360 |
0,142 |
|
O = O |
495 |
0,121 |
|
H-I |
299 |
0,162 |
|
-
C
|
839 |
0,120 |
|
H-H |
436 |
0,074 |
|
C
|
1040 |
0,113 |
|
H-S |
380 |
0,134 |
|
N
|
940 |
0,110 |
Cвязь,
образованная перекрыванием d-орбиталей
всеми четырьмя лепестками, называется
дельта-связью
![]() (рис.4).
(рис.4).
Пространственные
формулы молекул весьма разнообразны.
Так, молекула
![]() имеет
линейную структуру, молекула
имеет
линейную структуру, молекула![]() - тетраэдрическую, молекула
- тетраэдрическую, молекула![]() - пирамидальную, молекула
- пирамидальную, молекула![]() - угловую, молекула
- угловую, молекула![]() - треугольную.
- треугольную.
Если у атома, вступающего в химическую связь, имеются разные атомные орбитали (s-, p-, d- орбитали), то в процессе образования химической связи происходит гибридизация (смешение) атомных орбиталей, т.е. из разных орбиталей образуются одинаковые (эквивалентные) атомные орбитали. Гибридные орбитали образуются у одного атома, имеющего разные орбитали. Причем, гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Форма гибридной орбитали отличается от формы исходных атомных орбиталей (рис.6). В результате химические связи, образованные гибридными орбиталями прочнее, а полученная молекула более устойчива.

Рис.6. Атомная sp-гибридная орбиталь.
Если в химическую связь вступает атом, у которого на внешней оболочке имеются s- и p- электроны, то у данного атома в процессе образования связи происходит sp-гибридизация атомных орбиталей (рис.7).

Рис.7. Схема sp - гибридизации.
Например,
у атома берриллия sp-гибридизация
орбиталей проявляется в молекуле
![]() ,
которая вследствие этого имеет линейную
форму:
,
которая вследствие этого имеет линейную
форму:
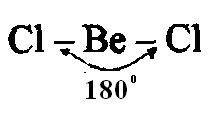
Если
у атома на внешней оболочке имеются
один s-
и два р- электрона, то происходит sp![]() -
гибридизация атомных орбиталей этого
атома (рис.8).
-
гибридизация атомных орбиталей этого
атома (рис.8).

Рис.8.
Схема sp![]() - гибридизации.
- гибридизации.
Например,
вследствие sp![]() -
гибридизации орбиталей атома бора
молекула
-
гибридизации орбиталей атома бора
молекула
![]() имеет треугольную форму:
имеет треугольную форму:

У
атома, имеющего на внешней оболочке
один s-
и три p-
электрона, при химическом взаимодействии
происходит sp![]() - гибридизация (рис. 9).
- гибридизация (рис. 9).
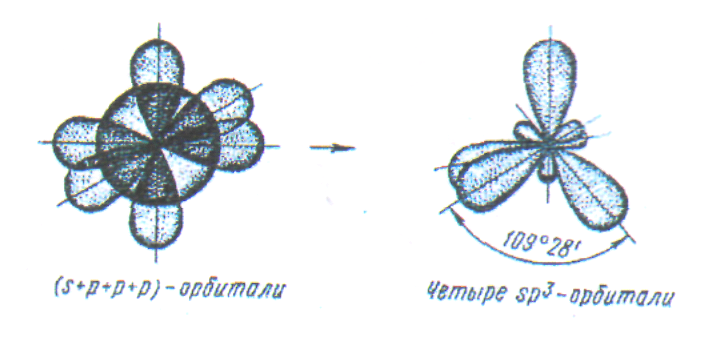
Рис.
9. Схема sp![]() - гибридизации.
- гибридизации.




 H-Cl
H-Cl