
- •Конспект лекций*
- •Ведущий лектор:
- •1.1. Строение атома и периодическая система д.И. Менделеева.
- •2. Основные сведения по теории строения атома.
- •Экспериментально квантование энергии атомов обнаруживаегся в их
- •3. Квантово-механическая модель атома водорода.
- •4. Характеристика состояния электрона в атоме системой квантовых чисел. Атомные орбитали.
- •5. Принципы формирования электронной структуры атомов.
- •Соответственно принципу минимальной энергии и правилам Клечковского заполнение энергетических подуровней происходит в следующем порядке :
- •6. Периодическая система д.И. Менделеева как естественная классификация элементов по электронному строению.
- •6.1. Периодическая система д.И. Менделеева и электронная структура.
- •6.2. Структура периодической системы химических элементов.
- •Лекция 2. Химическая связь
- •1. Основные типы и характеристики химической связи
- •Энергия химической связи (кДж/моль) - это количество энергии, выделяющееся при образовании химической связи или затрачиваемое на ее разрыв.
- •2. Ионная связь
- •Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
- •Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
- •Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:
- •4. Металлическая связь
- •5. Основные виды межмолекулярного взаимодействия.
- •6. Донорно-акцепторное взаимодействие
- •7. Водородная связь.
- •Раздел 2. Основные закономерности протекания химических процессов.
- •1.Основные понятия термодинамики.
- •2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
- •3. Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
- •При нормальных температурах и незначительном изменении s:
- •4. Термодинамические представления о равновесном состоянии.
- •Химическая кинетика
- •Химическое и адсорбционное равновесие
- •Лекция 5. Растворы.
- •3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
- •4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
- •5. Произведение растворимости. Механизм накипеобразования.
- •Осадок кристаллизация раствор
- •6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
- •Лекция 6. Электрохимические процессы
- •1. Понятие об электродном потенциале
- •Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- •2. Гальванические элементы
- •3. Стандартный водородный электрод и водородная шкала потенциалов
- •Пример 2 Уравнение
- •Электролиз. Законы фарадея
- •1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
- •2. Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- •Коллоидные растворы.
- •Общие свойства металлов
- •Разбавленная азотная кислота восстанавливается малоактивными
- •Алканы.
- •Непредельные углеводороды.
- •Нафтены ( циклопарафины ).
- •Ароматические углеводороды.
- •Список рекомендуемой литературы
Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:

Возможны также более сложные виды гибридизации с участием d- и f - орбиталей атомов, некоторые из них показаны в таблице 2.
Таблица 2
Пространственная конфигурация некоторых соединений.
|
Тип гибридизации |
Конфигурация |
Угол между |
Примеры |
|
центрального атома |
молекулы |
связями, град |
соединений |
|
sp |
Линейная |
180 |
ZnС12,ВеF2 |
|
sp2, dp2, sd2 |
Плоская тригональная |
120 |
ВС13, АlF3 |
|
sp3, sd3 |
Тетраэдр |
109°28' |
СH4, SiН4 |
|
dsp2 |
Плоский квадрат |
90 |
РdВr4, |
|
dsp3 |
Тригональная |
90 и 120 |
РF5 |
|
|
Бипирамида |
|
|
|
d2 sp3 |
Октаэдр |
90 |
SF6,
SbCl |
|
d4 sp3 |
Додекаэдр |
90 |
Мо(СN) |
Выше
были рассмотрены правильные геометрические
формы молекул с валентными углами 180°,
120° и 109,5°, 90°. Однако, согласно
экспериментальным данным, значительно
чаще встречаются молекулы и комплексы
с несколько иными значениями валентных
углов. Валентные углы в молекулах NНз
и Н2О
составляют, например,
![]() HNH
= 107,3° и
HNH
= 107,3° и
![]() НОН
= 104,5° (рис. 10). Рассмотрим влияние
несвязывающей электронной пары
центрального атома на строение этих
молекул.
НОН
= 104,5° (рис. 10). Рассмотрим влияние
несвязывающей электронной пары
центрального атома на строение этих
молекул.

одна несвяз. пара две несвяз. пары
Рис. 10. Перекрывание валентных орбиталей в молекулах CH4, NH3, Н2О.
Согласно теории гибридизации центральные атомы этих молекул образуют химические связи за счет электронов sp3 - гибридных орбиталей. У атома углерода на четыре sp3 - гибридные орбитали приходится четыре электрона:
![]() С
С
Это определяет образование четырех связей С - Н и расположение атомов водорода молекулы метана СН4 в вершинах тетраэдра (рис. 10).
У атома азота на четыре sp3 - гибридные орбитали приходится пять электронов:
 N
N
Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3 -гибридных орбиталей, направленных к вершине тетраэдра (рис. 10). Молекула NHз имеет форму тригональной пирамиды.
У атома кислорода на четыре sp3 - гибридные орбитали приходится шесть электронов:
 O
O
Теперь уже несвязывающие электронные пары занимают две гибридные sp3 - орбитали. Молекула Н2О имеет угловую форму (рис. 10).
Если ковалентная связь образована одинаковыми атомами (например, Н2, N2, О2), то обобщенные электроны равномерно распределены между ними, т.е. центры тяжести положительных и отрицательных зарядов совпадают. Такая связь называется ковалентной неполярной. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше электроотрицательность у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательностей атомов характеризует полярность связи.
Ковалентная
полярная связь образуется
в молекулах, атомы которых имеют различную
электроотрицательность (например, НС1,
SО3,
NН3,
Н2S).
Вследствие смещения электронной пары
к одному из ядер повышается плотность
отрицательного заряда у данного атома
и, соответственно, атом получает
заряд, называемый эффективным
зарядом атома
![]() .
У второго атома повышается плотность
положительного заряда
.
У второго атома повышается плотность
положительного заряда![]() .
Вследствие этого молекула становитсядипольной,
т.е. электрически нейтральной системой,
состоящей из двух равных по величине и
противоположных по знаку зарядов (+ q
и - q),
находящихся на некотором расстоянии
друг от друга (рис.11). Расстояние между
центрами тяжести положительного и
отрицательного зарядов называется
длиной диполя
(l).
.
Вследствие этого молекула становитсядипольной,
т.е. электрически нейтральной системой,
состоящей из двух равных по величине и
противоположных по знаку зарядов (+ q
и - q),
находящихся на некотором расстоянии
друг от друга (рис.11). Расстояние между
центрами тяжести положительного и
отрицательного зарядов называется
длиной диполя
(l).
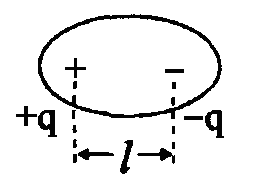
Рис. 11. Образование дипольной молекулы.
Вещества с полярной ковалентной связью количественно характеризуются дипольным моментом (µ). Дипольный момент молекулы определяется как векторная сумма из дипольных моментов отдельных связей и равен произведению величины заряда (q) на длину диполя (l):
µ = q l
Момент диполя имеет единицу измерения кулон на метр (Кл . м) и внесистемную единицу измерения дебай D, равную 3,3 . 10-30 Кл . м.
Дипольный момент даёт возможность определить тип связи, если µ = 0, то связь ковалентная неполярная; если 0 < µ < 4 D, то связь ковалентная полярная; а если 4 < µ < 11 D, то связь ионная.
Дипольный момент определяет геометрию простых молекул. Например, молекула СО2 имеет симметричное линейное строение:

И хотя связи С = О имеют сильно полярный характер, вследствие взаимной компенсации моментов их диполей молекула СО2 в целом неполярна (µ = 0D). Молекула SO2 полярна (µ = 1,61 D) и имеет угловое строение:

Под действием внешнего электрического поля молекула поляризуется, т.е. в ней происходит перераспределение зарядов, и молекула приобретает новое значение момента диполя. При этом неполярные молекулы могут превратиться в полярные, а полярные становятся ещё более полярными. Иначе говоря, под действием электрического поля в молекулах индуцируется диполь, называемый наведённым или индуцированным. В отличие от постоянных и мгновенных наведённые диполи существуют лишь при действии внешнего электрического поля. После прекращения действия поля, наведённые диполи исчезают.
Метод молекулярных орбиталей рассматривает молекулу как систему с объединенными электронами и ядрами. Согласно методу молекулярных орбиталей электроны в молекулах распределены по молекулярным орбиталям, которые подобно атомным орбиталям характеризуются определенной энергией (энергетическим уровнем) и формой. В отличие от атомных орбиталей молекулярные орбитали охватывают не один атом, а всю молекулу, т.е. являются двух - или многоцентровыми. Таким образом, молекулярная орбиталь - это результат сложения или вычитания атомных орбиталей.
Широко в методе молекулярных орбиталей используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил:
1. число молекулярных орбиталей равно общему числу атомных орбиталей;
2. энергия разрыхляющих молекулярных орбиталей оказывается выше, связывающих - ниже энергии исходных атомных орбиталей, а средние энергии приблизительно равны;
3. электроны заполняют молекулярные орбитали, как и атомные орбитали, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда;
4. прочность связи в методе молекулярных орбиталей пропорциональна степени перекрывания атомных орбиталей.
Если обозначить атомные орбитали атомов - А и В, а молекулярные орбитали - АВ, то согласно ЛКАО
ψАВ
= аψА![]() вψВ,
вψВ,
где ψАВ - волновая функция электрона в молекуле (МО);
а и в коэффициенты, учитывающие долю каждой АО в образовании МО;
ψА и ψВ - волновые функции электронов (АО) соответственно в атомах А и В.
При
формировании связывающих молекулярных
орбиталей электронная плотность в
основном сосредоточена между ядрами,
поэтому образование связывающих
орбиталей снижает энергию и упрочняет
молекулу. Разрыхляющие молекулярные
орбитали понижают электронную плотность
между ядрами, поэтому они не связывают
атомы в молекулу и называются
антисвязывающими
молекулярными
орбиталями. Молекулярные орбитали,
получающиеся при комбинации s
- АО, называются σs
- МО, при
комбинации рх
- АО - σх
- МО (где х -
линия,
соединяющая ядра атомов), при комбинации
ру -
и рz
- АО -
![]() у
и
у
и
![]() z
-
МО (рис. 12 - 14).
z
-
МО (рис. 12 - 14).
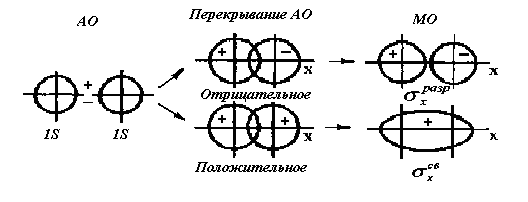
Рис.
12. Схема
образования связывающей σ![]() и разрыхляющей σ
и разрыхляющей σ![]() молекулярных
орбиталей при перекрывании атомныхs
- орбиталей.
молекулярных
орбиталей при перекрывании атомныхs
- орбиталей.

Рис.
13. Схема
образования из рх
- атомных
орбиталей связывающей σ![]() и разрыхляющей
σ
и разрыхляющей
σ![]() орбиталей двухатомной гомоядерной
молекулы.
орбиталей двухатомной гомоядерной
молекулы.

Рис.
14. Схема
образования из ру
.атомных орбиталей связывающей
![]()
![]() и разрыхляющей
и разрыхляющей
![]()
![]() молекулярных
орбиталей двухатомной гомоядерной
молекулы.
молекулярных
орбиталей двухатомной гомоядерной
молекулы.
С помощью метода молекулярных орбиталей можно определить порядок связи (n) в молекуле, который равен половине разности электронов на связывающих Nсв и разрыхляющих Nр молекулярных орбиталях:
![]()
Если Nсв = Nр, то n = 0 и молекула не образуется.
В отличие от метода ВС в методе МО допускается, что химическая
связь может быть образована не только парой, но и одним электроном и соответственно порядок связи может быть не только целым, но и дробным числом: п= 1/2, 1,3/2, 2,5/2, 3...
По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно расположить в следующий ряд:
σсв1S
< σразр1S
< σсв2S
< σразр2S
<
![]() св2ру=
св2ру=
![]() св2рz
< σсв2рх
<
св2рz
< σсв2рх
<
![]() разр2ру
=
разр2ру
=
![]() разр2рz
< σразр2рх
разр2рz
< σразр2рх
Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σсв1S
< σразр1S
< σсв2s
< σразр2S
< σсв2рх
<
![]() св2ру
=
св2ру
=
![]() св2рz<
св2рz<
![]() разр2ру
=
разр2ру
=
=
![]() разр2рz
< σразр2рх
разр2рz
< σразр2рх
Образование химической связи в молекуле водорода можно представить электронными конфигурациями:
![]()
В
соответствии с энергетической диаграммой
(рис. 14) при образовании связи два 1s
- электрона окажутся на σ![]() молекулярной
орбитали, а σ
молекулярной
орбитали, а σ![]() -орбиталь
будет незаполненной. Соответствующий
порядок связи равен (2-0)/2=1. Молекулярный
водород диамагнитен.
-орбиталь
будет незаполненной. Соответствующий
порядок связи равен (2-0)/2=1. Молекулярный
водород диамагнитен.

Рис. 15. Энергетическая диаграмма АО атомов водорода и МО молекул
водорода.
При взаимодействии атома и положительно заряженного иона водорода образуется молекулярный ион Н2+:
![]()
Порядок связи МО равен (1 - 0)/2=0,5, длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+.
Молекула Нe2 не образуется, порядок связи равен 0, т.к. при образовании связи по два 1s - электрона окажутся и на разрыхляющей, и на связывающей орбиталях.
Электронные конфигурации и некоторые экспериментальные данные двухатомных молекул элементов второго периода представлены в таблице 3.
Таблица 3
Электронные конфигурации и некоторые экспериментальные данные двухатомных молекул второго периода.
|
MO |
B2 |
C2 |
N2 |
O2 |
F2 |
Ne+Ne |
|
σразр2рх |
- |
- |
- |
- |
- |
|
|
|
- - |
- - |
- - |
|
|
|
|
σсв2рх |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
σразр2S |
|
|
|
|
|
|
|
σсв2s |
|
|
|
|
|
|
|
Порядок связи |
1 |
2 |
3 |
2 |
1 |
0 |
|
Длина связи, м |
0, 159 |
0,131 |
0,110 |
0,121 |
0,142 |
- |
|
Энергия диссоциации, кДж/моль |
288 |
627 |
941 |
495 |
159 |
Молеку - ла не образу – ется |
|
Магнитные свойства ПМ и ДМ – (парамагнитные и диамагнитные вещества) |
ПМ |
ДМ |
ДМ |
ПМ |
ДМ |
