
- •Конспект лекций*
- •Ведущий лектор:
- •1.1. Строение атома и периодическая система д.И. Менделеева.
- •2. Основные сведения по теории строения атома.
- •Экспериментально квантование энергии атомов обнаруживаегся в их
- •3. Квантово-механическая модель атома водорода.
- •4. Характеристика состояния электрона в атоме системой квантовых чисел. Атомные орбитали.
- •5. Принципы формирования электронной структуры атомов.
- •Соответственно принципу минимальной энергии и правилам Клечковского заполнение энергетических подуровней происходит в следующем порядке :
- •6. Периодическая система д.И. Менделеева как естественная классификация элементов по электронному строению.
- •6.1. Периодическая система д.И. Менделеева и электронная структура.
- •6.2. Структура периодической системы химических элементов.
- •Лекция 2. Химическая связь
- •1. Основные типы и характеристики химической связи
- •Энергия химической связи (кДж/моль) - это количество энергии, выделяющееся при образовании химической связи или затрачиваемое на ее разрыв.
- •2. Ионная связь
- •Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
- •Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
- •Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:
- •4. Металлическая связь
- •5. Основные виды межмолекулярного взаимодействия.
- •6. Донорно-акцепторное взаимодействие
- •7. Водородная связь.
- •Раздел 2. Основные закономерности протекания химических процессов.
- •1.Основные понятия термодинамики.
- •2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
- •3. Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
- •При нормальных температурах и незначительном изменении s:
- •4. Термодинамические представления о равновесном состоянии.
- •Химическая кинетика
- •Химическое и адсорбционное равновесие
- •Лекция 5. Растворы.
- •3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
- •4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
- •5. Произведение растворимости. Механизм накипеобразования.
- •Осадок кристаллизация раствор
- •6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
- •Лекция 6. Электрохимические процессы
- •1. Понятие об электродном потенциале
- •Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- •2. Гальванические элементы
- •3. Стандартный водородный электрод и водородная шкала потенциалов
- •Пример 2 Уравнение
- •Электролиз. Законы фарадея
- •1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
- •2. Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- •Коллоидные растворы.
- •Общие свойства металлов
- •Разбавленная азотная кислота восстанавливается малоактивными
- •Алканы.
- •Непредельные углеводороды.
- •Нафтены ( циклопарафины ).
- •Ароматические углеводороды.
- •Список рекомендуемой литературы
Экспериментально квантование энергии атомов обнаруживаегся в их
спектрах поглощения и испускания. Атомные спектры имеют линейчатый характер (рис. 2) .

Рис. 2 Линии видимого спекгра атомного водорода (серия Бальмера).
Возникновение линий в спектре обусловлено тем, что при возбуждении атомов (нагревании газа, электроразряде и пр.) электроны, принимая соответствующие порции энергии, переходят в состояние с более высокими энергетическими уровнями. В таком возбужденном состоянии атомы находятся лишь ничтожные доли секунды. Переход электронов в состояния с более низкими энергетическими уровнями сопровождается выделением кванта энергии. Это отвечает появлению в спектре отдельных линий, соответствующих излучению определенной частоты колебаний (длины волны). Поскольку газообразный атомный водород содержит множество атомов в разных степенях возбуждения, спектр состоит из большого числа линий.
Видимый спектр водорода (рис. 2) возникает при переходе возбужденных электронов в состояние с главным квантовым числом n=2 (серия Бальмера).
Теория Бора была усовершенствована его учеником А. Зоммерфельдом. Он предположил что электроны могут вращаться в атоме не только по круговым, но и по эллиптическим орбитам.
3. Квантово-механическая модель атома водорода.
Предположение о квантовой энергии впервые было высказано M. Планком (1900 г.) и позже обосновано А. Эйнштейном (1905 г.). Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу. Энергия кванта E зависит от частоты излучения (колебания) :
E = h - уравнение Эйнштейна, (2)
Частота колебаний и длина волны λ связаны соотношением:
λ = c,
где с - скорость света
В 1924 г. французский ученый Луи де Бройль предположил, что электронам присуща корпускулярно-волновая двойственность. Луи де Бройль предложил уравнение, связывающее длину волны λ с массой m и скоростью V электрона или любой другой частицы:
λ = hmV (3)
В 1927 г. английские ученые К.Д.Девиссон и Дж.Томсон
экспериментально подтвердили гипотезу де Бройля обнаружением дифракции электронов.
В 1927г. В. Гейзенбергом установлен принцип неопределенности: невозможно одновременно точно определить положение микрочастицы (ее координаты) и ее количество движения (импульс р= m V).
Математически выражение принципа неопределенности имеет вид:
ΔхΔр≥ h /2π или ΔхΔV≥h/2π m, (4)
где Δх, Δр, ΔV- соответственно неопределенности в положении, импульсе
и скорости частицы.
Из соотношения (4) следует, что чем точнее определена координата электрона в атоме (чем меньше неопределенность Δx ), тем менее определенной становится скорость (больше ΔV) и наоборот.
Квантование энергии, волновой характер движения микрочастиц, принцип неопределенности - все это показывает, что классическая механика непригодна для описания поведения микрочастиц.
В соответствие с квантово-механическими представлениями невозможно точно определить энергию и положение электрона, поэтому в квантово-механической модели атома используют вероятностный подход для характеристики положения электрона.
Поскольку движение электрона имеет волновой характер, квантовая механика описывает его движение в атоме при помощи волновой функции ψ. Волновая функция ψ является функцией трех координат. Математически это записывается равенством:
ψ = ψ(х, у, z),
где х, у, z - координаты точки.
Физический смысл волновой функции: ее квадрат ψ2 характеризует вероятность нахождения электрона в данной точке атомного пространства.
В качестве модели состояния электрона в атоме принято представление об электронном облаке, плотность соответствующих участков которого пропорциональна вероятности нахождения там электрона. Одна из возможных форм электронного облака в атоме показана на рис. 3.
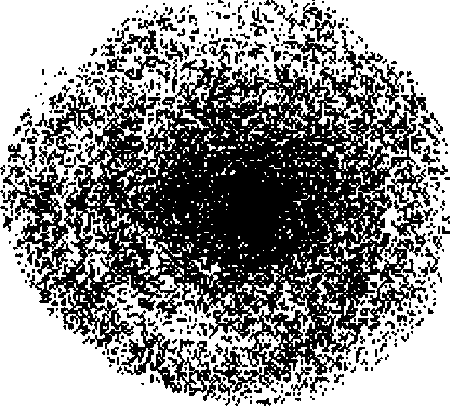
Рис. 3 Электронное облако
Электронное облако часто изображают в виде граничной поверхности, охватывающей примерно 90 % электронного облака. При этом обозначение плотности с помощью точек опускают.
Область пространства вокруг ядра, в которой наиболее вероятно пребывание электрона, определяет форму и размер электронного облака (орбитали).
Вычисление вероятности нахождения электрона в данном месте атома (молекулы) и его энергии решается с помощью волнового уравнения Шредингера:
|
H2
|
|
2 x2 |
2 y2 |
2
z2 |
|
+ (EU) = 0 |
(5), |
где первый член соответствует кинетической энергии электрона;
|
2 2 2
x2 y2 z2
|
сумма вторых производных волновой функции ψ по координатам x, y, z; |
E – полная энергия электрона;
U – потенциальная энергия электрона;
m – масса электрона;
h – постоянная Планка
Волновая функция, являющаяся решением уравнения Шредингера, называется орбиталью. Решая это уравнение, мы приходим к понятию определенной орбитали, т.е. s-орбитали (электронное облако симметрично), р-орбитали (электронное облако имеет форму гантели), d и f-орбитали (электронные облака имеют более сложные формы) (рис. 4).

 ·
82
m
·
82
m +
+ +
+


 2=
+ +
2=
+ +