
- •Конспект лекций*
- •Ведущий лектор:
- •1.1. Строение атома и периодическая система д.И. Менделеева.
- •2. Основные сведения по теории строения атома.
- •Экспериментально квантование энергии атомов обнаруживаегся в их
- •3. Квантово-механическая модель атома водорода.
- •4. Характеристика состояния электрона в атоме системой квантовых чисел. Атомные орбитали.
- •5. Принципы формирования электронной структуры атомов.
- •Соответственно принципу минимальной энергии и правилам Клечковского заполнение энергетических подуровней происходит в следующем порядке :
- •6. Периодическая система д.И. Менделеева как естественная классификация элементов по электронному строению.
- •6.1. Периодическая система д.И. Менделеева и электронная структура.
- •6.2. Структура периодической системы химических элементов.
- •Лекция 2. Химическая связь
- •1. Основные типы и характеристики химической связи
- •Энергия химической связи (кДж/моль) - это количество энергии, выделяющееся при образовании химической связи или затрачиваемое на ее разрыв.
- •2. Ионная связь
- •Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
- •Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
- •Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:
- •4. Металлическая связь
- •5. Основные виды межмолекулярного взаимодействия.
- •6. Донорно-акцепторное взаимодействие
- •7. Водородная связь.
- •Раздел 2. Основные закономерности протекания химических процессов.
- •1.Основные понятия термодинамики.
- •2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
- •3. Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
- •При нормальных температурах и незначительном изменении s:
- •4. Термодинамические представления о равновесном состоянии.
- •Химическая кинетика
- •Химическое и адсорбционное равновесие
- •Лекция 5. Растворы.
- •3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
- •4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
- •5. Произведение растворимости. Механизм накипеобразования.
- •Осадок кристаллизация раствор
- •6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
- •Лекция 6. Электрохимические процессы
- •1. Понятие об электродном потенциале
- •Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- •2. Гальванические элементы
- •3. Стандартный водородный электрод и водородная шкала потенциалов
- •Пример 2 Уравнение
- •Электролиз. Законы фарадея
- •1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
- •2. Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- •Коллоидные растворы.
- •Общие свойства металлов
- •Разбавленная азотная кислота восстанавливается малоактивными
- •Алканы.
- •Непредельные углеводороды.
- •Нафтены ( циклопарафины ).
- •Ароматические углеводороды.
- •Список рекомендуемой литературы
Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
Метод валентных связей включает 3 основных положения:
1) связь образована двумя электронами с антипараллельными спинами;
2) ковалентная связь насыщена и направлена в сторону максимального перекрывания электронных облаков в атомах, тем самым определяется геометрия молекулы;
3) если атомы вступают во взаимодействие электронами разного вида, их орбитали и энергии гибридизуются. При этом связи за счет перекрывания гибридных облаков становятся более прочными (область перекрывания облаков и энергия связи увеличивается).
Одно из важнейших свойств химической связи - ее насыщаемость. Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой.
Теория валентных связей (локализованных электронных пар) исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, в представлении теории валентных связей химическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная.
Валентность атома - это свойство атома данного элемента присоединять или замещать определенное число химических связей, образуемых данным атомом с другими атомами. В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода:
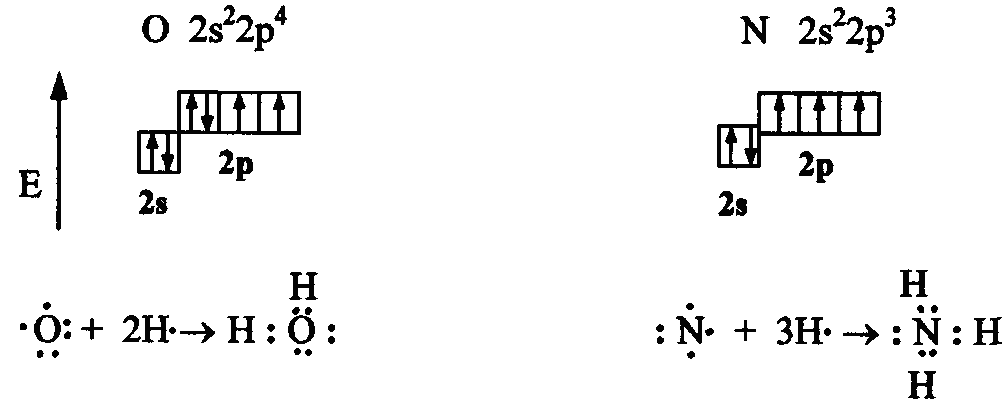
Рассмотрим валентные возможности атомов бериллия, бора, углерода и азота. Это - элементы 2-го периода и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2p - орбиталях.

Поскольку у бериллия, бора и углерода имеются энергетически близкие свободные 2p-орбитали, при возбуждении эти элементы могут приобрести новые электронные конфигурации:

В соответствии с числом непарных электронов атомы Be,B,C и N могут образовать соответственно две, три, четыре и три ковалентные связи, например, с атомами водорода:

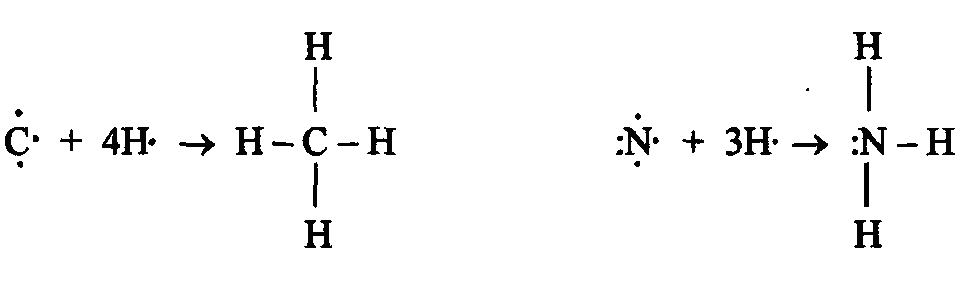
Атом
бериллия и бора имеют свободные орбитали,
поэтому в молекулах
![]() и
и![]() - дефицит электронов. В молекуле же
- дефицит электронов. В молекуле же![]() при атоме азота имеется неподеленная
(несвязывающая) электронная пара. Таким
образом, молекулы
при атоме азота имеется неподеленная
(несвязывающая) электронная пара. Таким
образом, молекулы![]() и
и![]() могут выступать как акцепторы, а молекула
могут выступать как акцепторы, а молекула![]() ,
наоборот, - как донор электронной пары.
Иными словами, центральные атомы этих
молекул способны к образованию четвертой
ковалентной связи по донорно - акцепторному
механизму.
,
наоборот, - как донор электронной пары.
Иными словами, центральные атомы этих
молекул способны к образованию четвертой
ковалентной связи по донорно - акцепторному
механизму.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей.
Геометрия
молекулы определяется направлением
перекрывания атомных орбиталей. В
зависимости от способа перекрывания и
симметрии образующегося облака различают
![]() -,
-,![]() -
и
-
и![]() -
связи (рис.4).
Кроме простых
-
связи (рис.4).
Кроме простых
![]() -
связей существуют кратные
(двойные и
тройные) связи, которые образуются при
наложении
-
связей существуют кратные
(двойные и
тройные) связи, которые образуются при
наложении
![]() -,
-,![]() -
и
-
и![]() -
связей.
-
связей.

Рис.4.
Перекрывание
атомных орбиталей при образовании
![]() -,
-,
![]() -
и
-
и
![]() -
связей.
-
связей.
