
- •5.1 Кремнийорганические соединения
- •5.1.1 Углерод и кремний. Физические и химические эффекты, связанные с заменой в органической молекуле углерода кремнием
- •5.1.2 Химические свойства связей атомов кремния и углерода с другими элементами
- •5.1.3 Способы получения органических производных кремния
- •5.1.4 Кремнийорганические полимеры
- •5.1.5 Биологическая активность кремнийорганических соединений
- •5.1.6 Метаболизм кремнийорганических соединений
5.1.6 Метаболизм кремнийорганических соединений
Повышенный интерес к метаболизму кремнийорганических соединений связан с их устойчивостью в окружающей среде. Показано, что чаще всего органические производные кремния включаются в предназначенные для функционализации ксенобиотиков стандартные последовательности превращений по аналогии с органическими соединениями подобного строения. Окисление протекает преимущественно по атомам углерода, которые находятся рядом с атомом кремния. Образование кислородсодержащих функциональных групп в соединённых с атомом кремния остатках приводит к расщеплению связи атома кремния с атомом углерода.
Как отмечалось выше (разд. 5.1.5), в живой природе нет ферментных систем, предназначенных для образования соединений с Si–C-связями. В соответствии с этим в метаболических превращениях кремнийсодержащих ксенобиотиков отсутствуют реакции, направленные непосредственно на связь атома кремния с атомом углерода. Лабильность силилированных по атомам кислорода, азота и серы соединений объясняет лёгкость расщепления таких соединений в биологических средах с образованием силанольных производных. Можно с уверенностью утверждать, что эти превращения идут по параметаболическому пути, т.е. без участия специфических ферментов.
В качестве примера можно привести катализируемое неизбирательными монооксигеназами превращение силамепробамата. Как и его углеродный прототип, он окисляется по метиленовой группе в пропильном остатке:
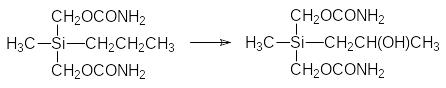
Однако в отличие от мепробамата, превращающегося в растворимый в воде глюкуронид по образовавшейся в результате окисления гидроксильной группе, окисленный силамепробамат отщепляет трёхуглеродный остаток с образованием силанола:

Две молекулы силанола в свою очередь могут превращаться в соответствующий дисилоксан:

Арилзамещённые кремнийорганические соединения могут окисляться монооксигеназами по арильным структурным элементам, а образовавшиеся фенольные соединения могут вступать во вторую фазу метаболизма ксенобиотиков, представленную их сочетанием с глюкуроновой кислотой или с серной кислотой.
Известны также примеры, в которых проявляются принципиальные различия в метаболизме кремнийорганических соединений и их углеродных прототипов. В частности, одно из направлений метаболизма галоперидола представлено превращением его в нейротоксичное соединение с пиридиниевой группой:

![]()

Атом кремния не образует кратных связей и поэтому не может включаться в ароматические структуры. Окисление шестичленного цикла с атомом кремния протекает по обычной для метаболизма аминных ксенобиотиков схеме с введением атома кислорода в α-положение к атому азота:
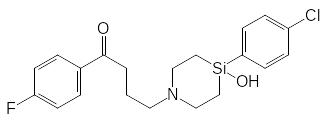
![]()

Кроме того установлено, что в продуктах метаболических превращений сила-галоперидола отсутствует соответствующий глюкуронид. Это может быть связано с тем, что глюкуронилтрансфераза не может переносить остаток глюкуроновой кислоты на связанную с атомом кремния гидроксильную группу, или же с тем, что образующийся глюкуронид быстро гидролизуется по Si–O–C-связи, образованной силанольной и аномерной гидроксильными группами.
Представленные выше особенности метаболизма сила-галоперидола объясняют более высокую эффективность и безопасность этого кремниевого аналога галоперидола.
