
- •5.1 Кремнийорганические соединения
- •5.1.1 Углерод и кремний. Физические и химические эффекты, связанные с заменой в органической молекуле углерода кремнием
- •5.1.2 Химические свойства связей атомов кремния и углерода с другими элементами
- •5.1.3 Способы получения органических производных кремния
- •5.1.4 Кремнийорганические полимеры
- •5.1.5 Биологическая активность кремнийорганических соединений
- •5.1.6 Метаболизм кремнийорганических соединений
5.1.2 Химические свойства связей атомов кремния и углерода с другими элементами
Наименьшие различия в химических свойствах показывают связи между атомами кремния и углерода в сравнении со свойствами связи между двумя атомами углерода. Стабильность этих связей в реакциях гомолитического разрыва практически одинакова, как и следовало ожидать при небольшом различии в энергии этих связей (соответственно 85 и 72 ккал/моль). В то же время гетеролитическое расщепление Si–С-связи протекает легче, чем гетеролитическое расщепление С–С-связи, вследствие более ионного характера Si–С-связи. Расщепление может протекать в результате нуклеофильной атаки по атому кремния или электрофильной атаки по атому углерода или же в результате более или менее согласованных атак двух этих типов. Однако в нормальных условиях связи атомов кремния с атомами углерода сравнительно устойчивы в химических превращениях. Только в особых случаях наблюдается значительное увеличение реакционной способности Si–С-связи. Так, например, легко разрывается Si–С-связь в β-галогензамещённых алкилсиланах R3SiСН2СН2Х, где Х означает атом галогена. Эти соединения гораздо менее устойчивы в условиях термического воздействия, действия оснований и трихлорида алюминия, чем соответствующие α- и γ-галогензамещённые аналоги. Основное направление реакции при этом представлено образованием олефина и галогенсилана, например:

Кремнийорганические соединения с 2‑хлорэтильными группами могут найти применение в качестве регуляторов роста растений, действие которых основано на генерировании этилена, представляющего собой один из растительных гормонов. Так, например, эффективным продуцентом этилена является этасиласил – трис(2-метоксиэтокси)-2-хлорэтилсилан:
![]()
Необычную реакционную способность демонстрируют и другие кремнийорганические соединения с функциональными группами в β‑положении. Далее приводятся некоторые из таких превращений:

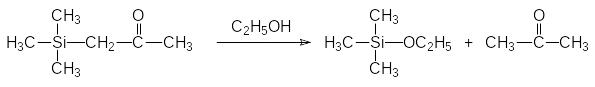
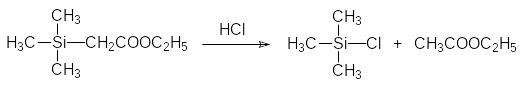
Важно, что Si–С-связь устойчива к действию воды. Только в особых случаях (например, в соединениях с функциональными группами в β‑положении к атому кремния, связанному с арильной группой) появляется возможность гидролиза связи атома кремния с арильной группой в присутствии сильных кислот.
В отличие от С–С-связи и Si–С-связи, связь между атомами кремния показывает невысокую термическую стабильность, что согласуется с низкой энергией этой связи (54 ккал/моль). Тем не менее, реакции по Si–Si-связям носят в основном ионный характер с нуклеофильной атакой по атому кремния. Органополисиланы достаточно устойчивы к гидролизу, хотя водные растворы щелочей и спиртовые растворы гидроксидов щелочных металлов расщепляют Si-Si-связи с выделением водорода:

В то же время Si–Si-связь в гексаалкилдисиланах достаточно устойчива к действию кислот. Так, например, взаимодействие гексаметилдисилана с концентрированной серной кислотой протекает преимущественно с расщеплением Si–С-связи:

Действие кислот на полисиланы с арильными группами приводит к частичному расщеплению Si–Si-связей. Небольшое различие в электроотрицательностях атомов кремния и водорода приводит к тому, что реакции с участием Si–Н-связей носят ионный характер. Они протекают в результате электрофильной атаки по атому водорода и/или в результате нуклеофильной атаки по атому кремния. Так, например, Si–Н-связь легко расщепляется водой с образованием соответствующих силанолов (или дисилоксанов) и водорода, например:
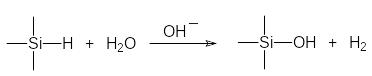
Эта реакция может катализироваться как щелочами, так и кислотами, но щелочи являются более эффективными катализаторами гидролитического расщепления Si–Н‑связей
Вследствие большого различия в электроотрицательностях между атомами кремния и галогенов связи между ними носят ионный характер. В соответствии с этим связи Si–F, Si–Cl и Si–Br очень устойчивы к гомолитическому расщеплению, но легко расщепляются в присутствии ионных реагентов, особенно если они имеют нуклеофильный характер. Начальная стадия реакции расщепления силилгалогенидов представлена, очевидно, нуклеофильной атакой по атому кремния, который может повышать своё координационное число от 4 до 5 или до 6. Реакционная способность силилгалогенидов в реакциях гидролитического расщепления понижается в ряду:
Si–I > Si–Br > Si–Cl > Si–F
Скорость гидролиза силилгалогенидов на много порядков превышает скорость гидролиза аналогичных алкилгалогенидов. В отличие от четырёххлористого углерода тетрахлорсилан бурно разлагается водой. Это объясняется тем, что ковалентный радиус атома кремния больше, чем ковалентный радиус углерода, кроме того (как отмечалось выше) атом кремния может образовывать переходные состояния с увеличением координационного числа до пяти или шести. Гидролиз галогенсиланов R3SiХ приводит к образованию соответствующих силанолов или дисилоксанов и НХ, например:
![]()
Различие в электроотрицательностях атомов в связях Si–О и Si–N объясняет склонность этих связей к гетеролитическому разрыву и сравнительно высокую устойчивость к гомолитическому разрыву. В отличие от С–О- и С–N-связей аналогичные Si–О- и Si–N-связи легко вступают в реакции сольволиза в спиртах и в воде. Гидролиз алкоксисиланов и аминосиланов приводит к соответствующим силанолам, которые могут далее конденсироваться с образованием силоксанов с Si‑O‑Si‑связями, например:


Эти гидролитические превращения идут с невысокой скоростью и в нейтральных средах, но они могут катализироваться кислотами и основаниями, при этом основания являются более эффективными катализаторами, чем кислоты. Поскольку щелочной гидролиз начинается с нуклеофильной атаки гидроксидного иона по атому кремния, скорость реакции в значительной мере зависит от стерического фактора и электронных эффектов заместителей. Гораздо менее чувствительны к стерическим и электронным эффектам у атома кремния реакции гидролиза в присутствии кислот, поскольку начальный этап этого процесса должен быть представлен протонированием атома кислорода алкоксильной группы.
Гидролитическое расщепление Si–N-связи в аминосиланах идёт с меньшей скоростью, чем гидролиз Si–O- и Si–Cl-связей в алкоксисиланах и хлорсиланах. Скорость этой реакции увеличивается в присутствии кислот. Связь Si–S в реакциях гидролиза аналогична Si–О-связи, но Si–S-связь гидролизуется более легко. Силтианы разлагаются даже влагой воздуха, превращаясь в соответствующие силанолы.
