
Методички, теория, все лекции 2022 / 2. ЭОС Литий, натрий
.docx2 ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ МЕТАЛЛОВ ПЕРВОЙ ГРУППЫ
Поскольку металлы первой группы Периодической таблицы Д. И. Менделеева представляют собой наиболее электроположительные элементы, связь их с атомом углерода в органических производных поляризована сильнее, чем у всех других металлорганических соединений. Алкильные производные натрия и калия реагируют со всеми органическими соединениями, кроме алифатических углеводородов, а их получение сопровождается образованием значительно количества побочных продуктов.
Менее реакционноспособные литийорганические соединения широко используются в органическом синтезе. В соответствии с диагональным принципом Периодической таблицы они аналогичны магнийорганическим соединениям. Кроме того, литийорганические соединения в отличие от натрий- и калийорганических соединений растворимы во многих органических растворителях.
2.1 Литийорганические соединения
Основной способ получения литийорганических соединений основан на реакции 1)металлического лития с соответствующим галогенидом. Течение этой реакции во многом определяется природой галогена и используемым растворителем. Важную роль играет также содержание натрия в литии. Так, например, не удаётся получить виниллитий из винилбромида и лития, если в реакции используется чистый металл (обычно металлический литий содержит около 2 % натрия). На практике оказалось, что примесь 1-2 % натрия в металлическом литии не приводит к снижению выхода в превращениях образующихся литийорганических соединений.
Нельзя использовать для получения литийорганических соединений алкилиодиды, поскольку они реагируют с литием по реакции Вюрца. Кроме того, в этой реакции образуется иодид лития, который, как и бромид лития, заметно растворим в используемых в качестве среды для проведения реакции простых эфирах. В соответствии с этим для увеличения выхода и для получения свободных от галогенидов лития растворов литийорганических соединений лучше всего использовать в качестве исходных соединений хлорпроизводные в алифатическом ряду и бромпроизводные в ароматическом. При этом следует отметить, что по схеме реакции Вюрца с металлическим литием реагируют и реакционноспособные органические хлориды, например, аллил- или бензилхлориды:


Все литийорганические соединения, за исключением метиллития и фениллития, растворимы в апротонных органических растворителях. Это связано с тем, что они образуют ассоциаты, в которых понижена полярность связи атома лития с атомом углерода. Так, например, кристалл метиллития упакован тетрамерами (CH3Li)4, в которых атомы лития расположены по углам тетраэдра:


А вот так представляется делокализация связей в структурном элементе гексамера бутиллития:

В растворах в образовании координационных связей в кластерах литийорганических соединений могут принимать участие и молекулы растворителей. При переходе от малоосновных растворителей к более основным степень ассоциации органических производных лития снижается. Так, например, в тетраметилэтилендиамине (СН3)2NСН2СH2N(CH3)2 метиллитий находится в виде мономера, а гексамерный в углеводородах н‑бутиллитий в серном эфире находится преимущественно в тетрамерном состоянии.
При выборе растворителя для проведения реакции органического галогенида с металлическим литием надо учитывать особенности, связанные с его очисткой от пероксидов и с освобождением от следов воды. Большое значение для растворителя имеют также температура кипения и температура перехода в кристаллическое состояние. Так, например, легко чистятся и абсолютируются углеводороды, но циклогексан и бензол с температурой плавления соответственно 6,5 и 5,5 °С редко используются для работ с литийорганическими соединениями, так как последующие превращения органических производных лития чаще всего протекают при минусовых температурах. Хорошим растворителем для получения литийорганических соединений является диэтиловый (серный) эфир. Он не так легко, как считается, реагирует с ними. Во всяком случае в течение дня в среде диэтилового эфира можно провести как получение литийорганического соединения, так и реакцию с его участием. Высокое давление паров эфира также играет положительную роль – создаваемая ими «подушка» достаточно хорошо защищает литийорганическое соединение от контакта с воздухом и позволяет работать без заполнения аппаратуры азотом или аргоном. Альтернативой эфиру может служить тетрагидрофуран, но его трудно абсолютировать. Обычно его перегоняют над алюмогидридом лития или добавляют к высушенному над твёрдой щелочью тетрагидрофурану раствор реактива Гриньяра, взаимодействующего с остающимися в высушенном над щелочью тетрагидрофуране водой и спиртами. К недостаткам тетрагидрофурана как растворителя для реакций с литийорганическими соединениями можно отнести его сравнительно высокую реакционную способность по отношению к этим реагентам и недостаточно низкую температуру плавления –65 °С, осложняющую проведение реакций при охлаждении сухим льдом (–70°С).
Хорошие результаты получаются при проведении реакций в смесях растворителей, так, например, тетрагидрофуран можно использовать в смеси с углеводородными растворителями. В частности, для работы при низких температурах можно брать смесь эфира, тетрагидрофурана и пентана (или петролейного эфира) в соотношении 4:4:1. Редко используются для работы с литийорганическими соединениями среды, содержащие третичные амины, но в отдельных случаях их можно добавлять в качестве промоторов.
Во всех случаях надо исключать контакт литийорганических соединений с воздухом. Это относится даже к отмериванию реактивного бутиллития в мерном цилиндре. Чаще всего работы с литийорганическими соединениями проводят в атмосфере азота, отбираемого непосредственно из баллона без дополнительной очистки, но всё же лучше работать в атмосфере аргона, так как при получении литийорганического соединения в атмосфере азота на поверхности лития образуется мешающая протеканию реакции пленка из нитрида лития. Специальные технические приёмы для переноса и хранения литийорганических соединений достаточно детально представлены в соответствующих руководствах по проведению практических работ.
Алифатические литийорганические соединения могут разлагаться с образованием олефина и гидрида лития. Определённое значение эта реакция приобретает при температуре от 50 до 150°С. В частности, вторбутиллитий элиминирует гидрид лития уже при температуре около 0°С:

Литий представляет собой достаточно прочный металл. В соответствии с этим для проведения реакции с его участием кусочки лития разбивают молотком в листочки толщиной 1-2 мм и уже от них отрезают ножницами небольшие порции так, чтобы они непосредственно падали в растворитель в реакционном сосуде. Литий с плотностью 0,534 г/см3 легче любого растворителя, поэтому реактор должен быть заполнен инертным газом для исключения контакта с воздухом плавающего на поверхности растворителя лития.
Органический галогенид прибавляют к литию и растворителю медленно при перемешивании, учитывая, что у реакции есть более или менее продолжительный индукционный период. Если сразу прибавить большое количество органического реагента, начавшаяся экзотермическая реакция образования литийорганического соединения может выйти из-под контроля. Поверхность лития может покрываться образующимся в реакции нерастворимым в органическом растворителе галогенидом, поэтому иногда для её освобождения от галогенида лития к перемешиваемой реакционной массе прибавляют кусочки битого стекла. Хороший результат достигается также при воздействии ультразвука.
В настоящее время стал коммерчески доступным н-бутиллитий в виде раствора в углеводородах. Нерастворимый в алифатических углеводородах фениллитий получают по реакции металлического лития с бромбензолом в абсолютном эфире, с которым образующееся литийорганическое соединение реагирует достаточно медленно. При получении фениллитияя в большом количестве лучше проводить реакцию в инертной атмосфере с эффективным обратным холодильником и с охлаждением реакционной массы в бане со льдом. Реакцию проводят при температуре кипения эфира, а внешнее охлаждение сокращает время проведения этой реакции.
Определенные сложности сопровождают получение третбутиллития. Если в качестве исходного соединения используют третбутилхлорид, то образующийся третбутиллитий и исходный хлорид могут реагировать друг с другом с образованием изобутана и изобутена:

Тем не менее в кипящем пентане реакцию третбутилхлорида с металлическим литием можно провести с выходом третбутиллития около 80 %.
2)Некоторые простые эфиры реагируют с металлическим литием так же, как и алкил- или арилгалогениды. Так, например, бензиллитий может быть получен с хорошим выходом из бензилалкиловых эфиров в тетрагидрофуране, например, по реакции:

3)В метилале СН2(ОСН3)2 действием лития на хлорметиловый эфир можно получить метоксиметиллитий:

Это вещество может храниться несколько дней при температуре ‑70 °С, тогда как при температуре около 0 °С оно разлагается в течение нескольких часов.
4)Определённое значение имеет способ получения литийорганических соединений в соответствии с общей схемой:

Равновесие в этой реакции сдвинуто в сторону образования литийорганического соединения, органическая составляющая которого лучше воспринимает состояние с частичным анионным статусом. В соответствии с этим реакции с обменом галогена на литий используются для получения ароматических литийорганических соединений и алкенильных литийорганических соединений при взаимодействии ароматических галогенидов с алифатическими литийорганическими соединениями(???). С достаточно высокой скоростью эта обменная реакция идёт в среде эфира даже при температурах около –70 °С; в гексане скорость реакции значительно ниже.
Хорошие результаты получаются, когда в этой обменной реакции галоген представлен атомом брома, но при использовании в качестве литиирующего реагента бутиллития побочным продуктом реакции становится достаточно реакционноспособный бутилбромид. При повышении температуры он может реагировать с образовавшимся литийорганическим соединением или вступать в реакцию с продуктом его дальнейшего превращения. Если присутствие бутилбромида в реакционной массе нежелательно, то для реакции литиирования берут два эквивалента третбутиллития. В этом случае образовавшийся третбутилбромид реагирует с избытком третбутиллития с образованием изобутена, изобутана и бромида лития:
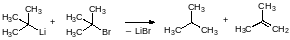
Легко вступают в реакцию обмена галогена на литий полихлорированные ароматические соединения. В частности, так из гексахлорбензола и бутиллития в эфире при температуре –70 °С можно получить пентахлорфениллитий, реакцию с которым можно проводить при температурах от –60 °С до –30 °С. При повышении температуры до примерно 0 °С пентахлорфениллитий элиминирует хлорид лития и превращается в тетрахлорбензин:

Если в составе ароматического галогенида присутствуют электронодонорные группы, то обмен атома галогена на литий может протекать и с фениллитием, например, по реакции:

5)Литийорганические соединения можно также получать из реактивов Гриньяра. В качестве примера можно привести реакцию бензилмагнийхлорида с металлическим литием:
![]()
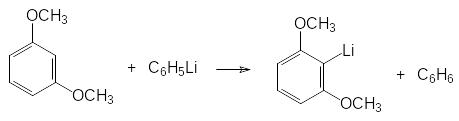
6)Ещё один способ получения литийорганических соединений представлен замещением литием атома водорода. Особенно легко эти реакции протекают на активированных СН-связях, например, при взаимодействии бутиллития с ацетиленом и с монозамещенными ацетиленами, а также с трифенилметанами. Ароматические соединения с электронодонорными заместителями также могут вступать в реакции обмена атома водорода на литий. В качестве примера можно привести реакцию фениллития с диметиловым эфиром резорцина:
Высокая нуклеофильность литийорганических соединений не позволяет проводить по этой схеме реакции обмена атома водорода на атом лития на соединениях с электрофильными функциональными группами. В этом случае в качестве литиирующего реагента используют диизопропиламид лития ([(CH3)2CH]2NLi, LDA) или 2,2,6,6-тетраметил-пиперидид лития, анионы которых проявляют исключительно основные свойства. В отдельных случаях можно использовать в реакция литиирования и менее основный гексаметилдисилазид лития [(CH3)3Si]2NLi.
Синтезы с участием литийорганических соединений во многом аналогичны превращениям, в которых участвуют представленные ниже реактивы Гриньяра, но более высокая реакционная способность органических производных лития позволяет проводить с их участием и специфические превращения. К ним относятся, например, реакции присоединения к двойным азот-углеродным связям в составе гетероциклических соединений. В качестве примера приводится реакция получения 2-фенилпиридина:

Взаимодействие пиридина с фениллитием протекает при температуре 110°С. В соответствии с этим в инертной атмосфере к раствору фениллития в эфире прибавляют раствор сухого пиридина в толуоле, отгоняют эфир и нагревают реакционную массу с обратным холодильником в течение 8 часов. После разложения образовавшегося продукта присоединения водой окисление образующегося 2‑фенилдигидропиридина идёт кислородом воздуха.
Определённое препаративное значение имеют также реакции литийорганических соединений, протекающие с образованием азот-углеродных связей. В их основе лежит замещение уходящей группы связанным с атомом лития остатком или присоединение литийорганического соединения по кратной связи между атомами азота, например:

Есть, конечно, и другие превращения, для реализации которых могут быть использованы литийорганические соединения.
Органические производные лития с высокой реакционной способностью не могут использоваться в качестве биоактивных соединений, но неорганические соли лития проявляют психотропные свойства. Хлорид лития представляет собой первое средство для лечения аффективных расстройств. Сейчас для лечения депрессий используют карбонат лития, он помогает при маниакальных стадиях биполярных расстройств, купирует суицидальные тенденции.
2.2 Натрий- и калийорганические соединения
Натрийорганические соединения могут быть получены теми же способами, что и соответствующие литийорганические соединения, однако при этом следует принимать во внимание, что натрийорганические соединения гораздо более реакционноспособны, чем их литиевые аналоги. Вследствие этого они могут реагировать с исходным галогенидом по реакции Вюрца-Фиттига или с используемым для проведения реакции растворителем.
Получение натрийорганических соединений и в этом случае проводят при интенсивном перемешивании в инертной атмосфере в среде углеводородов, свободных от непредельных примесей, например, в пентане, низкокипящем петролейном эфире и др. При этом металлический натрий должен быть диспергирован до мельчайших частиц (менее 25 мкм), поскольку натрийорганические соединения нерастворимы в углеводородах.
Ранее для получения натрийорганических соединений использовали взаимодействие металлического натрия с органическими производными цинка, кадмия, свинца и, прежде всего, ртути в инертном растворителе, например, реакцию:
![]()
Действием металлического натрия можно замещать подвижные атомы водорода в таких углеводородах, как алкины, флуорены, триарилметаны; действием натрия на диметилсульфоксид получают метилсульфинилметанид натрия, который можно использовать, например, для получения ацетиленидов натрия по реакции:
![]()
Этот способ замещения атомов водорода натрием через производное диметилсульфоксида можно использовать и для получения других труднодоступных натрийорганических соединений. Металлирование натрийорганическими соединениями протекает значительно легче, чем литийорганическими соединениями. Так, например, фенилнатрий можно получить действием этилнатрия на бензол.
Ещё более высокой реакционной способностью отличаются калийорганические соединения. Если, например, в толуоле можно проводить реакцию хлорбензола с натрием с получением фенилнатрия, то реакция хлорбензола с калием в толуоле даже при низких температурах приводит к получению с хорошим выходом бензилкалия. Реакция протекает по схеме:
![]()
![]()
Бензилкалий образуется также при действии металлического калия на толуол в присутствии оксида натрия, оксида кальция или оксида магния. При этом выход продукта калийорганического соединения может достигать 90 %. Реакционная способность алкильных производных калия настолько велика, что они могут обменивать атом калия на атом водорода у первичных и вторичных атомов углерода даже в таких инертных веществах, как пентан или циклогексан.
Основная область применения натрийорганических соединений представлена реакцией Вюрца (A. Wurz, 1855 г.), в которой они образуются в качестве промежуточных продуктов. В общем случае реакция Вюрца представляет собой отщепление атомов галогена от двух молекул алкилгалогенида при действии щелочного металла в соответствии с уравнением:
![]()
В настоящее время эта реакция используется только для получения длинноцепочечных соединений алифатического ряда.
Р. Фиттиг (R. Fittig, 1864 г.) распространил эту реакцию на получение алкилированных ароматических соединений из арилгалогенидов и алкилгалогенидов. При действии натрия на смесь ароматического и алифатического галогенидов с более высокой скоростью образуется арилнатрий, который, в свою очередь, реагирует преимущественно с алкилгалогенидом, а не с арилгалогенидом. В соответствии с этим основным продуктом реакции становится алкилированное ароматическое соединение, например:
![]()
В представленной реакции основным продуктом взаимодействия становится изобутилбензол, тогда как 2,5-диметилгексан и бифенил образуются лишь в незначительных количествах. По реакции Вюрца–Фиттига можно получать алкилированные ароматические соединения с алифатическими радикалами, которые не могут быть получены по реакции Фриделя–Крафтса алкилированием ароматических углеводородов соответствующими галогенированными соединениями. Так, например, в реакции бензола с изобутилбромидом в присутствии кислоты Льюиса образуется третбутилбензол, а не изобутилбензол.
