
- •5.1 Кремнийорганические соединения
- •5.1.1 Углерод и кремний. Физические и химические эффекты, связанные с заменой в органической молекуле углерода кремнием
- •5.1.2 Химические свойства связей атомов кремния и углерода с другими элементами
- •5.1.3 Способы получения органических производных кремния
- •5.1.4 Кремнийорганические полимеры
- •5.1.5 Биологическая активность кремнийорганических соединений
- •5.1.6 Метаболизм кремнийорганических соединений
5.1.5 Биологическая активность кремнийорганических соединений
В природе до настоящего времени не удалось обнаружить какие бы то ни было органические соединения с атомами кремния, тем не менее многие кремнийорганические соединения демонстрируют интересные виды биологической активности. Продолжающиеся синтетические и биологические исследования позволяют надеяться на обнаружение новых содержащих кремний биоактивных веществ.
Применение кремнийорганических соединений в фармакологии может привести к получению новых лекарственных средств в связи с тем, что с введением в молекулу вещества атома кремния проявляются новые химические и физические свойства, в частности, это относится к силанольным и силандиольным функциональным группам. Эти различия могут проявиться в уникальных формах взаимодействия кремнийорганических молекул с биологическими макромолекулами.
Введение изостерных углероду атомов кремния в известные биоактивные структуры позволяет оптимизировать фармакологическую активность, снижать токсичность и улучшать фармакокинетические показатели.
В качестве примера можно привести замещенный дифенилсиланол, полученный в качестве кремниевого аналога аминоэтилового эфира бензиловой кислоты амизила (бенактидина):


По антихолинэргической активности кремнийорганическое соединение в 200 раз превосходит алкалоид атропин, модификацией структуры которого был получен амизил.
Увеличенный ковалентный радиус атома кремния примерно на 20 % увеличивает длину связей с другими атомами по сравнению с атомом углерода. Следствием этого становится изменение углов связей и конформаций в циклических структурных элементах. С введением триметилсилильных, диметилтретбутилсилильных и диметилфенилсилильных групп растёт липофильность молекул и связанная с этим способность модифицированных силильными группами молекул проходить через ткани и клеточные мембраны. Кроме того, у атома кремния другой характер связей из-за доступности для гиперконъюгации 3d орбиталей и низколежащих Si−C или Si−X разрыхляющих орбиталей. Выше отмечалась невозможность формирования кратных связей у атома кремния. Следствием этого становится образование структур, которые не имеют аналогов у молекул, построенных только из атомов углерода. В качестве примера можно привести геминальные силандиолы, которые изостерны неустойчивым гидратированным формам карбонильных групп.
Электроположительный характер атома кремния (в сравнении с атомами углерода, азота, кислорода и водорода) объясняет обратную поляризацию его связей с другими атомами по сравнению с атомом углерода. В медицинской химии это приводит к упрочнению водородных связей и к повышению кислотности ОН-связи в силанолах. Эта особенность атома кремния может проявляться и в метаболических превращениях силильных производных.
Связи Si−OC и Si−NС термодинамически стабильны, но в водных и кислотных средах они кинетически лабильны, что может быть использовано для получения пролекарств и для защиты соответствующих функциональных групп. Важно также, что в кремнийорганических соединениях не проявляется токсичность, обусловленная самим атомом кремния. Лабильность SiOC-связей может быть использована также для получения биологически активных соединений с коротким временем полупревращения. Так, например, противосудорожное действие аминоалкиловых эфиров бензгидрола может длиться 1-2 дня, тогда как замена в структуре таких соединений связи СОС на связь СОSi сокращает время действия до получаса.
Уже сейчас получены кремнийорганические соединения, которые могут быть использованы для лечения сердечно-сосудистых заболеваний. В СССР для лечения облысения, ран и ожогов исследовались средства для наружного применения, содержащие 1‑хлорметилсилатран и 1‑этоксисилатран. Известны кремнийорганические соединения с противораковой активностью.
В общем случае биологически активные кремнийорганические соединения можно разделить на три основные группы:
- первая группа включает силилированные производные известных органических соединений, используемых в качестве лекарств;
- вторая группа биоактивных органических производных кремния представлена кремнийорганическими соединениями, у которых нет никаких аналогов в обычной органической химии;
- третья группа включает соединения, строение которых аналогично строению известных биоактивных соединений, но атомы кремния в их структурах занимают место атомов углерода.
Область химии биологически активных кремнийорганических соединений, относящихся к третьей группе, в англоязычной специальной литературе называют «Sila-pharmaca».
Практически все силилированные производные соединений с известной фармакологической активностью представлены веществами, в составе которых триметилсилильные или диметилтретбутилсилильные группы связаны с атомами кислорода, азота или углерода.
Очень легко получаются силилированные производные субстанций, в составе которых гидроксильные и азотсодержащие функциональные группы модифицированы образованием Si–O- или Si–N-связей. Для их синтеза могут быть использованы такие соединения, как триметилхлорсилан или гексаметилдисилазан, которые переносят триметилсилильные группы на реакционноспособные гидроксильные и аминные группы. Так, например, N–Н-группы замещаются гексаметилдисилазаном в присутствии сульфата аммония по реакции:


Эффективным силилирующим средством является бис(триметилсилил)ацетамид (BSA), образующийся из ацетамида и триметилхлорсилана в присутствии оснований:

Соответствующие силильные производные биоактивных соединений заметно отличаются от исходных веществ по физико-химическим свойствам. В частности, они становятся более липофильными, в то же время они легко гидролизуются водой, превращаясь в активные фармсубстанции. Такие триметилсилильные производные были получены, например, на основе местного анестетика лидокаина, жаропонижающего средства парацетамола и других активных начал лекарственных средств, например, для парацетамола:

Вызванное силилированием изменение гидрофильно-липофильного баланса молекул приводит к улучшению фармакокинетических параметров. Блокирование полярных центров в молекуле и постепенное гидролитическое отщепление триметилсилильных групп в жидких средах организма представляет собой перспективный путь к получению новых пролекарств, которые проникают через липидные зоны клеточных мембран и постепенно выделяют активное вещество в результате гидролиза.
Преимущество такого подхода к модификации активных начал показано в экспериментах с триметилсилильным производным тестостерона

В стандартном опыте с кастрированными самцами крыс с введением инъекционным путём тестостерона и его триметилсилильного производного была продемонстрирована эффективность соединения с защищённой гидроксильной группой, показавшего более высокую андрогенную и миотропную активность.
Интересные данные были получены на силилированных производных 2-дибутиламиноэтанола, проявляющего свойства репеллента по отношению к эктопаразитам. Полученные на основе этого соединения силоксановые производные значительно превосходили 2‑дибутиламиноэтанол по репеллентной активности и по длительности защитного действия в опытах на крысиных блохах Xenopsylla cheopis. При этом максимальную эффективность показало соединение формулы:

В дозе 20 г/м2 этот аминосилоксан был в полтора раза эффективнее исходного аминоэтанольного репеллента, а продолжительность защитного действия этого кремнийорганического соединения, составлявшая несколько часов для аминоэтанола, увеличивалась до 12 дней. Интересно, что в данном случае речь не идёт о проявлении активности в результате гидролитического отщепления аминоэтанола, поскольку он менее активен. Носителем более высокой репеллентной активности является сам диаминосилоксан.
Некоторые силилированные амидные производные индометацина – лекарства с широким спектром действия, относящегося к нестероидным противовоспалительным средствам, – были получены с целью повышения эффективности и безопасности этого препарата при использовании его в качестве противоракового средства. Индометацин блокирует обе циклооксигеназы СОХ-1 и СОХ-2, что осложняет его лекарственное применение. Силилированные амидные производные индометацина (n = 1 и 3, R = CH3 и C6H5) были получены по схеме:


Изучение биологической активности полученных соединений показало, что они являются более избирательными ингибиторами циклооксигеназ: СОХ-2 блокируется ими на три порядка эффективнее, чем СОХ-1. Кроме того, силилированные производные индометацина оказались и лучшими цитостатиками для клеток злокачественных опухолей поджелудочной железы и клеток множественной миеломы.
В кремнийорганических биологически активных соединениях со стабильными Si–С-связями силильный остаток играет роль обычного гидрофобного заместителя, который может определять даже механизм действия соответствующего активного вещества. Так, например, триметилсилильные производные нейростимуляторов из группы 2‑фенилэтиламинов могут быть как агонистами, так и антагонистами катехоламинов. В частности, 2-фенилэтиламин повышает давление крови, а 2-(4-триметилсилилфенил)этиламин и 2-(4-триэтилсилилфенил)- этиламин обладают гипотензивным действием. В отличие от этого 2‑(2‑триметилсилилфенил)этиламин и 2‑(3-триметилсилилфенил)- этиламин повышают давление крови, как и незамещённый фенилэтиламин. Исходным соединением для получения силилированных по 4-положению фенилэтиламинов является 4‑бромтолуол. Полученное на его основе магнийорганическое соединение реагирует с триалкилхлорсиланами с образованием 4-триалкилсилилтолуола, который бромируют N-бромсукцинимидом (NBS). Полученный в этой реакции 4-триалкилсилилбензилбромид по реакции с цианидом щелочного металла превращается в соответствующий нитрил, который восстанавливают до амина:



Введение силильных групп в известные активные соединения с образованием стабильных Si–C-связей не может быть использовано для получения пролекарств, но в то же время это ещё одна возможность модифицирования структуры с целью получения соединений с новыми свойствами.
Синтез и исследование биоактивности кремнийорганических соединений, у которых нет аналогов среди обычных органических соединений (или эти аналоги есть, но их биологическая активность неизвестна) представляет собой достаточно трудоёмкую работу. Полученные соединения должны пройти широкий скрининг на отдельных белках, клеточных культурах, культурах тканей и живых организмах, поскольку возможности их воздействия на биологические мишени непредсказуемы. Тем не менее такие исследования ведутся, и уже получены сотни новых кремнийорганических соединений с интересными видами фармакологической активности, некоторые из которых будут представлены далее.
Выше отмечалось, что полисилоксаны пассивны по отношению к живым клеткам и биологическим средам и контакт с ними не вызывает аллергических реакций. Однако циклические органосилоксаны с невысокими молекулярными массами могут взаимодействовать с биомишенями. Так, например, оказалось, что циклотетрасилоксаны, получаемые из соответствующего трисилоксана и дихлордиметилсилана по схеме:

оказывают ярко выраженный эффект на мужскую и женскую репродуктивную системы. В частности, они вызывают атрофию клеток мужской половой эндокринной системы, что позволяет использовать их в качестве средств для лечения опухолей предстательной железы. Одно из таких соединений с трансоидным расположением фенильных групп зарегистрировано в качестве лекарственного средства под названием Цисобитан.
Цисобитан выводится из организма преимущественно в неизменённом виде, а продуктами его метаболических превращений становятся диметилсиландиол, метилфенилсиландиол и фенол.
В организме человека максимальное содержание кремния отмечено в аорте, в сухожилиях и в соединительной ткани. Ещё в семидесятые годы прошлого века было показано, что кремнезём участвует в формировании костной и хрящевой тканей, участвует в синтезе гликозаминогликанов и коллагена, тормозит развитие атеросклеротических процессов. Для восполнения в организме потерь биокремнезёма во Франции были разработаны способы лечения возрастных изменений тканей с помощью препаратов на основе комплексов калиевых солей оксикарбоновых кислот и метилсилантриола CH3Si(OH)3, например, это конжонктил (Conjonctyl), в состав которого входит метилсилантриол и салицилат калия. Роль оксикарбоновых кислот сводится, очевидно, к предотвращению образования полисилоксановых соединений из метилсилантриола. В настоящее время конжонктил используют также для лечения витилиго и кистозной мастопатии. При лечении мастопатии его применение сопровождается снятием болевого синдрома, уменьшением уплотнений и повышением эластичности ткани грудных желез. Аналогичные лечебные свойства демонстрирует циклический эфир глицерина и диметилсиландиола:

Стабильный дифенилсиландиол, аналогов для которого в химии углерода нет, показывает хорошую антиконвульсантную активность, сравнимую с активностью известного противоэпилептического средства дифенилгидантоина (дифентоин, дифенин):

Аналогичные свойства демонстрируют другие дифенилсилильные соединения, которые могут превращаться в дифенилсиландиол в результате гидролиза.
В 1960 г. (A. B. Finestone, США) был запатентован способ получения одного из самых интересных и необычных типов кремнийорганических соединений – каркасных силатранов:

Предполагалось, что атом кремния и атом азота в этих соединениях образуют донорно-акцепторную связь, однако более поздние физико- химические исследования показали, что расстояние между этими атомами соответствует степени связывания не более 0,2. Основной способ получения силатранов представлен переэтерификацией триалкоксисиланов триэтаноламином в присутствии оснований, например:

Полученный по этой реакции фенилсилатран неожиданно проявил очень высокую токсичность для млекопитающих (ЛД50 0,33 мг/кг, мыши, в.б.), а для пресмыкающихся, растений и микроорганизмов арилсилатраны оказались малотоксичными. Так, например, лягушки не погибают от дозы фенилсилатрана, увеличенной на два порядка. Высокая токсичность наблюдается только у силатранов с арильным заместителем, который непосредственно связан с атомом кремния. Малотоксичны близкие по строению циклогексилсилатран с ЛД50 150 мг/кг и бензилсилатран с ЛД50 1115 мг/кг. Хорошие токсикологические показатели позволяют использовать арилсилатраны в качестве средств для борьбы с грызунами. Так, например, при введении через рот эти вещества на порядок менее токсичны для уток и обезьян. В США с 1971 г. в качестве родентицида использовался 4-хлорфенилсилатран.
В настоящее время считается, что механизм действия арилсилатранов основан на блокировке хлорных каналов ГАМК-эргической нервной системы, передающей сигналы торможения. Другие металлатраны оказались малотоксичными соединениями.
Интересной особенностью силатранов является широкий спектр фармакологической активности. Так, например, в сублетальных дозах 1‑фенилсилатран представляет собой эффективный аналептик. При внутрибрюшинном введении мышам он вызывает повышенную двигательную активность и стимулирует дыхание, а в дозе 0,35 мг/кг его действие вызывает клонические и тонические конвульсии. Аналогичный эффект возбуждения моторных и дыхательных центров сопровождает введение сублетальных доз 4‑хлорфенил- и п‑толилсилатрана.
Ускоренное заживление ран вызывают малотоксичные 1-хлорметил- силатран и 1-этоксисилатран. Кроме того, мази с 1-хлорметилсилатраном и 1‑этоксисилатраном стимулируют рост волос. В СССР были проведены широкие клинические испытания, показавшие перспективность использования этих соединений в качестве средств для лечения самых разных видов алопеции (облысения).
Хлорметилсилатран оказался также прекрасным регулятором роста растений. В смеси с триэтаноламинной солью о-крезоксиуксусной кислоты в составе препарата Мивал-Агро он используется для защиты растений от неблагоприятных факторов окружающей среды (как биотических, так и абиотических). Мивал-Агро повышает устойчивость растений к переохлаждению и к недостатку влаги, ускоряет восстановление растений после стрессовых воздействий, в числе которых физические, химические, радиационные факторы, поражение болезнями и вредителями. Мивал-Агро улучшает проникновение питательных веществ и фитогормонов внутрь клетки. Хлорметилсилатран легко проходит через клеточные мембраны, стимулируя обменные процессы в низких концентрациях (5-20 г/т при обработке семян и 10-20 г/га по вегетирующим растениям).
Наряду с ярко выраженной репеллентной активностью (см. с. 79) многие аминосиланы и силоксаны проявляют противомикробные и противогрибковые свойства. В частности, соединения общей формулы

где R означает бутильные или гексильные группы и R′ означает этильные или бутильные группы, проявляют туберкулостатическую активность.
Наиболее известны исследования, посвящённые силильным аналогам известных субстанций. Кремниевые и углеродные структуры

различаются по размерам центральных атомов и по полярности участвующих в их образовании связей, по основности или кислотности входящих в их состав функциональных групп и по реакционной способности, особенно, если с центральными атомами связаны ароматические остатки. При этом обусловленные стереохимическими характеристиками различия в физических и химических свойствах могут приводить и к различиям в биологической активности, если эти изменения могут влиять на механизм взаимодействия с биомишенями или на направление биотрансформации.
Классическим примером такого подхода служат два изостерных соединения с миорелаксантной активностью – мепробамат и его кремниевый аналог силамепробамат:


Используемый в качестве средства для расслабления мышц мепробамат получают из 2-метилпентаналя, образующегося в качестве побочного продукта в реакции оксосинтеза при формилировании пентена с целью получения гексаналя. Конденсация 2-метилпентаналя с формальдегидом в присутствии основания сопровождается восстановлением альдегидной группы:

Из полученного диола в реакции с фосгеном получают бис(хлоркарбонат) и переводят его в дикарбамат действием аммиака:


Более сложный процесс используется для получения силамепробамата. В качестве исходного продукта берут триметилхлорсилан. Его хлорируют при облучении УФ-светом, затем действием пропилмагнийбромида переводят полученный бис(хлорметил)-метилхлорсилан в бис(хлорметил)метилпропилсилан:

На следующей стадии действием ацетата калия в ледяной уксусной кислоте заменяют атомы хлора на ацетоксигруппы и в мягких условиях проводят гидрирование диацетатного производного в соответствующий диол алюмогидридом лития:


Такой способ перевода хлорметильных групп в гидроксиметильные связан с тем, что в присутствии оснований хлорметильные производные кремния разлагаются с разрывом Si–C-связи. Достаточно лабильны и кремнийорганические соединения с гидроксиметильными группами, поэтому для перевода их в карбаматные производные гидроксильные группы ацилируют фенилхлоркарбонатом в присутствии пиридина и после этого действием аммиака заменяют феноксигруппы на амидные:


В опытах на мышах (активность соединений определялась по увеличению продолжительности сна, вызванного введением гексобарбитала) силановый аналог мепробамата характеризовался пониженной токсичностью и незначительным увеличением активности.
В рамках обозначенного термином «сила-фармака» подхода к новым биологически активным веществам было синтезировано большое число силильных аналогов известных препаратов с фармакологической активностью, но лишь в редких случаях замена атома углерода атомом кремния приводила к получению более безопасных соединений или к появлению новых свойств в сравнении с углеродным прототипом.
Интересным объектом для модификации силильными структурными элементами стали трициклические соединения общей формулы

где R означает γ-аминозамещённую пропильную группу и Х означает атом серы, кислорода, пропилиденовую, этиленовую и другие группы. В зависимости от природы структурного элемента Х трициклическая основа молекулы может быть почти планарной или же угловой, когда сконденсированные с центральным гетероциклом бензольные кольца лежат в пересекающихся под углом плоскостях. Планарные структуры проявляют антипсихотическую активность, тогда как угловые являются прежде всего антидепрессантами (тимолептиками). В качестве примера можно привести практически планарную молекулу нейролептика хлорпромазина (Х = S) и угловую (Х = СН2СН2) антидепрессанта имипрамина:


Эти данные по зависимости активности от строения послужили основой для получения широкого ряда структурных аналогов этих соединений с силильными группами в шестичленном или семичленном центральном гетероциклическом структурном элементе (Х = Si(CH3)2, СН2Si(CH3)2, Si(CH3)C6H5, Si(CH3)H, Si(CH3)OH и др.). Все полученные соединения проявляли антипсихотическую или седативную активность, но никаких особых преимуществ в сравнении с углеродными аналогами они не показали.
Синтез таких трициклических кремнийорганических производных достаточно сложен. В качестве примера можно привести получение самого простого из этих соединений сила-диметакрина. Для получения его углеродного прототипа диметакрина проводят циклизацию дифениламина с ацетоном и алкилируют образующийся диметилдигидроакридин N,N‑диметил-3-хлорпропиламином:

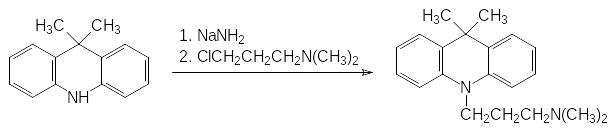
Для получения сила-диметакрина в качестве исходного соединения используют 2,2′-дибромдифениламин. Из него по аналогии с предыдущим в реакции с диметил-3-хлопропиламином получают N-3-диметиламино- пропил-N,N-дифениламин:

Затем проводят литиирование полученного соединения бутиллитием и циклизацией полученного дилитийорганического соединения по реакции с диметидихлорсиланом получают сила-диметакрин:


Определённый интерес представляют соединения с двумя четвертичными аммонийными группами, которые были получены как аналоги алкалоида кураре с парализующим действием. У этих блокаторов нервномышечной передачи наблюдается зависимость активности от расстояния, разделяющего четвертичные атомы азота. Один из максимумов активности проявляется у соединений, в молекуле которых это расстояние составляет 1,4 нм. В качестве примера приводятся формулы декаметония и дитилина (суксаметоний хлорид):

Декаметоний

Дитилин
Пары четвертичных атомов азота в этих соединениях разделены десятью атомами углерода (декаметоний) или восемью атомами углерода и двумя атомами кислорода (дитилин). При замене атомов углерода на атомы кремния надо учитывать, что длина связей при этом увеличивается примерно на 20 %. В соответствии с этим для получения кремнийорганических структурных аналогов этих соединений выбор был сделан в пользу соединений с двумя диметилсилильными группами и семью атомами углерода в разделяющем четвертичные аммонийные группы структурном элементе (спейсере) или же атомы азота были разделены спейсером из шести атомов углерода, двух атомов кремния и одного атома кислорода в составе дисилоксановой группы. Практически все полученные соединения оказались примерно на порядок более активными, чем декаметоний. В качестве примера приводится синтез одного из кремнийорганических аналогов декаметония.
В качестве исходного соединения используют бис(диметилхлорсилил)-метан, который образуется в цепочке превращений с участием кремнийорганического реактива Гриньяра:



Далее полученный по этой схеме дихлорид реагирует с реактивом Гриньяра, образующимся из N-(3-хлорпропил)пиперидина, а полученный в этой реакции диамин переводят в диаммонийное соединение действием метилиодида:

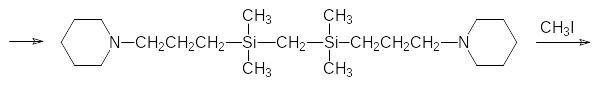

Синтезированное по представленной схеме соединение оказалось очень эффективным блокатором нервномышечной передачи с деполяризующим действием.
Широким спектром биологической активности отличаются синтетические структурные аналоги пространственных изомеров ретиноевой кислоты. В частности, они могут использоваться для лечения некоторых болезней кожи и в области онкологии. Одним из вошедших в практику агонистов ретиноевых рецепторов является 1‑(1,1,4,4,7-пентаметил-1,2,3,4-тетрагидронафт-6-ил)-1-(4-карбоксифенил)-этилен (таргретин, бексаротен):

Для синтеза его кремнийорганического аналога используют цепочку превращений, в которой исходным соединением является доступный 1,2‑бис(хлордиметилсилил)этан, реагирующий с этинилмагнийбромидом с образованием 1,2-бис(диметилэтинилсилил)этана:

Второй реагент для образования базовой структуры дисила-бексаротена получают из метилового эфира моноальдегида терефталевой кислоты:


К альдегидной группе присоединяют метилэтинилмагнийбромид и действуют на полученный аддукт триметилхлорсиланом: Далее проводят циклизацию двух этих соединений с этинильными группами в присутствии циклопентадиенилдикарбонилкобальта (СрСо(СО)2), протекающую с образованием бензольного кольца, и снимают триметилсилильную группу метанолом:


Полученный карбинол окисляют с получением кетона и действием метилида трифенилфосфония, образующегося из бромида метилтрифенилфосфония и гексаметилдисилазида калия, по реакции Виттига заменяют атом кислорода карбонильной группы на метиленовую группу:


Омыление сложноэфирной группы в полученном соединении гидроксидом калия приводит к образованию соли дисила-бексаротена, который оказался эффективным агонистом ретиноидных рецепторов, как и его прототип с атомами углерода вместо атомов кремния.
Известен также способ получения дисила-бексаротена с участием реакции Сузуки (см. стр. 47). В качестве исходного соединения при этом используют циклический эфир борной кислоты 4,4,5,5-тетраметил-2-изопропокси-1,3,2-диоксаборолан. Он реагирует с пропиниллитием с образованием циклического эфира пропинилбороновой кислоты. Продукт этой реакции циклизуют с 1,2-бис(диметилэтинилсилил)этаном в присутствии иодида кобальта и обработанного иодом цинка:



Взаимодействие продукта этой реакции с трифлатом енольной формы 4-метоксикарбонилацетофенона по реакции Сузуки приводит к образованию метилового эфира дисилабексаротена:


С использованием представленных выше синтетических подходов был синтезирован силановый аналог другого агониста ретиноидных рецепторов силатамибаротен:
В ряду ингибиторов обратного захвата серотонина и катехоламинных нейромедиаторов некоторые силановые производные оказались более избирательными в сравнении с углеродными аналогами. Так, например, силильный аналог антидепрессанта венлафаксина – силавенлафаксин блокирует преимущественно обратный захват норадреналина и дофамина:


Венлафаксин Силавенлафаксин
Силановые аналоги галоперидола (R = 4-Cl) и трифлуперидола (R = 3‑CF3)

были синтезированы с целью получения антипсихотического средства, лишённого хотя бы некоторых побочных эффектов, присущих углеродным прототипам.
Атом кремния был введён вместо атома углерода так, чтобы сохранялось сродство молекулы к соответствующему сайту дофаминовых рецепторов. При этом казалось, что сила-галоперидол в 4,7 раза прочнее связывается с дофаминовыми D2 рецепторами в нервной системе человека, тогда как сила-трифлуперидол мало отличается по эффективности от трифлуперидола. Рентгеноструктурный анализ, в котором исследуются кристаллические вещества, показывает, что в протонированном виде трифлуперидол (Х = С) и силатрифлуперидол (Х = Si) имеют одинаковую конформацию, но спектры ЯМР выявляют различие в окружении заместителей у атома азота, когда вещества находятся в виде растворов:

В растворе соотношение конформеров по атому азота для трифлуперидола составляет 2:1, тогда как у сила-трифлуперидола (X = Si) линейного пространственного изомера в 12 раз больше. Это связано, очевидно, с изменением углов связей в шестичленном цикле вследствие увеличения расстояния между атомами углерода и кремния по сравнению с расстоянием, разделяющем атомы углерода. Равновесие между силанольной (Si–ОН) и дисилоксановой (Si–О–Si) формой в щелочной среде и при физиологических значениях рН 7,4 полностью сдвинуто в сторону силанольной формы.
Интересны в практическом отношении силандиольные производные, в составе которых функциональная группа Si(ОН)2 изостерна переходному состоянию карбонильной группы при ферментативном гидролизе соответствующих пептидов. Кремнийорганические пептидомиметики с силандиольным структурным элементом могут выступать в роли ингибиторов протеаз, что послужило основанием для разработки способов их получения. В качестве примера приводятся структуры кремнийорганических ингибитора ангиотензинконвертирующего фермента (первая формула) и ингибитора протеазы вируса иммунодефицита человека (вторая формула):

и

Рентгеноструктурный анализ показывает, что в этих соединениях присутствует именно силандиольный структурный элемент, а не группы Si=О или Si–О–Si. При этом было установлено, что силандиольная группа ориентирована на связывающийся с тетраэдрическим переходным состоянием атома углерода ион цинка в активном центре фермента. Оказалось также, что силандиольные пептидомиметики эффективнее фосфорных аналогов, поскольку они активны в нейтральном состоянии и не нуждаются в защитных группах или в активации.
Стратегия синтеза силандиольных соединений основана на том, что связанные с атомом кремния алкоксильные или фенильные группы снимаются действием кислот:

В соответствии с представленной схемой можно избирательно снимать алкоксильные группы при атоме кремния трифторуксусной кислотой, а для отщепления арильной группы используют более сильную трифторметансульфокислоту.
Здесь приведены лишь отдельные примеры модификации структур биологически активных соединений с введением в их состав атомов кремния в соответствии с методологией сила-фармака. Силильные аналоги были получены практически для всех классов веществ с фармакологической активностью. В частности, такой модификации подвергались стероидные соединения, барбитураты, соединения с антигистаминной активностью и др. Несмотря на то что многие из них превосходили углеродные прототипы по многим показателям, в фармакологическую практику не введён пока ни один из таких препаратов. Это связано, очевидно, со сложностью их получения в требуемых для практического использования количествах.
