
- •Московская медицинская академия имени и.М. Сеченова
- •Распределение вопросов по темам
- •IV курс
- •Оформление контрольных работ
- •Методические указания к выполнению контрольных работ
- •Вопросы к контрольным работам контрольная работа № 1
- •Контрольная работа № 2
- •Контрольная работа №3
- •Контрольная работа № 4
- •Контрольная работа № 5
- •Контрольная работа № 6
- •Типовые варианты контольных работ контрольная работа № 1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Контрольная работа № 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Контрольная работа № 3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Контрольная работа № 4 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Контрольная работа № 5 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Контрольная работа № 6 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Приложение
Вариант 9
1. Обоснуйте условия проведения реакции комплексообразования с общеалкалоидными реактивами для кофеина и с солями тяжелых металлов для теобромина.
2. Напишите реакции гидролитического расщепления феназепама в кислой и щелочной среде. Какими испытаниями можно доказать образование продуктов гидролиза? Напишите уравнения реакций.
3. Дайте сравнительную оценку кислотно-основных свойств нозепама, сибазона и феназепама и приведите примеры их использования в количественном определении методом кислотно-основного титрования в неводных средах. Напишите уравнения реакций.
4. Дайте обоснование фармакопейному методу количественного определения кофеин-бензоата натрия (ГФ Х, ст. 173). Напишите уравнения соответствующих реакций и приведите формулы расчета содержания кофеина и натрия бензоата в лекарственном средстве.
5. Сравните кислотно-основные свойства и способность к гидролитическому расщеплению фенобарбитала и гексамидина и приведите методики, позволяющие отличить данные лекарственные вещества. Напишите уравнения реакций.
6. Приведите методики идентификации и количественного определения компонентов лекарственной смеси:
Кислоты ацетилсалициловой 0,025
Кофеина 0,05
Напишите уравнения соответствующих реакций и формулы расчета молярной массы эквивалента, титра и содержания каждого лекарственного вещества в смеси.
Вариант 10
1. Предложите способы отличия барбитала-натрия от барбитала на основе физических и химических свойств. Приведите уравнение реакции, подтверждающей их принадлежность к циклическим уреидам.
2. Охарактеризуйте кислотно-основные свойства теобромина и теофиллина. Приведите реакции, подтверждающие эти свойства и значение их в анализе подлинности и методик количественного определения данных лекарственных веществ.
3. Напишите реакции окисления тиамина хлорида и кислоты фолиевойи их значение для оценки качества данных лекарственных веществ.
4. Дайте обоснование применения реакции диазотирования и азосочетания для количественного определения феназепама. Напишите уравнения реакций, формулы расчета молярной массы эквивалента, титра и содержания лекарственного вещества.
5. Дайте обоснование окислительно-восстановительным свойствам рибофлавина. Укажите их значение для определения подлинности и количественного определения лекарственного вещества.
6. Объясните, почему лекарственные формы гексенала и аминазина не подвергают термической стерилизации. Напишите схемы возможных химических превращений указанных лекарственных веществ при нагревании в различных условиях.
Приложение
Эталон ответа на вопросы контрольной работы №5 (вариант 3)
1.
|
Phtivazidum Фтивазид 3-Метокси-4-оксибензилиденгидра- зид кислоты изоникотиновой. Светло-желтый или желтый мелкокристаллический порошок со слабым запахом ванилина.
|
Chinosolum Хинозол 8-Оксихинолина сульфат. Мелкокристаллический порошок лимонно-желтого цвета. |
|
Morphini hydrochloridum Морфина гидрохлорид Белые игольчатые кристаллы или белый кристаллический порошок слегка желтеющий при хранении |
Apomorphini hydrochloridum Апоморфина гидрохлорид Белый, слегка сероватый или слегка желтоватый порошок |
Фтивазид и хинозол являются окрашенными соединениями, поскольку в состав их молекул входят сопряжённые хромофоры – функциональные группы, ответственные за поглощение электромагнитных волн, в том числе и в видимой области спектра.
Оттенки в окраске морфина гидрохлорида и апоморфина гидрохлорида объясняются неустойчивостью данных веществ, их способностью легко вступать в окислительно-восстановительные реакции, проявляя при этом восстановительные свойства. У морфина гидрохлорида эти свойства обусловлены принадлежностью морфина (по химическому строению) к частично гидрированной системе фенантрена, а также наличием фенольного гидроксила и вторичной спиртовой группы.
В связи с этим, при хранении данных лекарственных веществ с доступом влаги и кислорода воздуха образуются окрашенные продукты окисления: дигидроморфин, N-оксид морфина, хиноидные структуры и т. д.:

Наибольшая устойчивость растворов препарата наблюдается при значении рН = 2,5. для повышения устойчивости 1% раствора морфина его стабилизируют 0,1 н раствором кислоты хлористоводородной до рН 3,0 – 3,5; рекомендуется также хранить растворы в атмосфере углекислого газа и азота. Для предотвращения образования окрашенных продуктов окисления целесообразно добавлять антиоксиданты.
Апоморфин является продуктом промежуточного окисления морфина:

Поэтому апоморфин неустойчив при хранении, особенно на свету и легко окисляется, как в нейтральной, так и в кислой и щелочной среде:

Растворы апоморфина в воде очень неустойчивы. Разложению способствуют кислород воздуха, свет, следы тяжёлых металлов, поэтому для повышения устойчивости целесообразно добавлять к растворам препарата 0,1 н кислоту хлористоводородную, тиомочевину, аскорбиновую кислоту, метабисульфит натрия, трилон Б.
2.
а) С раствором серебра нитрата взаимодействуют: изониазид, фтивазид (после гидролиза).
Д анное
взаимодействие объясняется
восстановительными свойствами остатка
гидразина:
анное
взаимодействие объясняется
восстановительными свойствами остатка
гидразина:
Если проводить данную реакцию с аммиачным раствором серебра нитрата (щелочная среда) препарат сразу вступает в окислительно-восстановительную реакцию:

б) С раствором концентрированной азотной кислоты при нагревании взаимодействуют: атропина сульфат, морфина сульфат и папаверина гидрохлорид:

Если к упаренному остатку в выпарительной чашке добавить несколько капель спиртового раствора КОН и ацетона, образуется азаоксаноловый краситель фиолетового цвета (реакция Витали-Морена):

Взаимодействие папаверина гидрохлорида с концентрированной азотной кислотой обусловлено восстановительными способностями препарата, поскольку в его структуре присутствуют два ароматических фрагмента, связанных метиленовой группой, а также четыре метоксидных группы:

Взаимодействие морфина сульфата с концентрированной азотной кислотой также обусловлено восстановительными способностями препарата. Образуется оранжево-красный внутримолекулярный хелатный комплекс:

3 .
.
В гидроксамовую реакцию способны вступать никотинамид, нифедипин и тровентол, так как в момент гидролиза у всех этих соединений образуется ацильный остаток. Пармидин не вступает в данную реакцию, так как при гидролизе образуются следующие продукты:

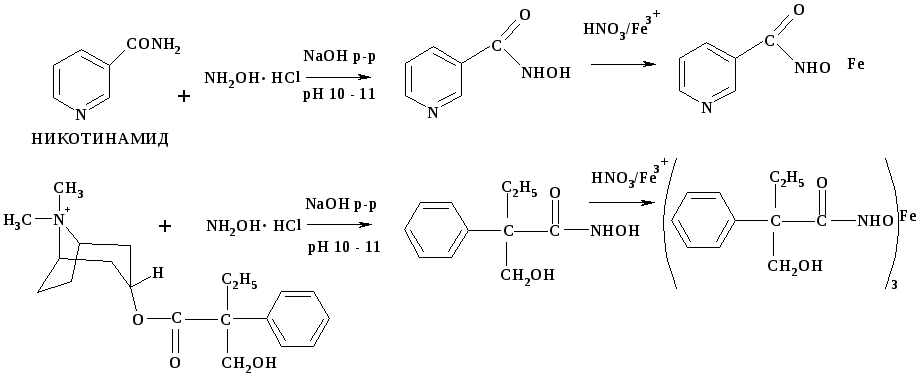
Данная реакция неспецифична, так как в неё способны вступать вещества, принадлежащие к различным химическим классам: сложные эфиры, лактоны, амиды, лактамы, хлорангидриды кислот.
4.
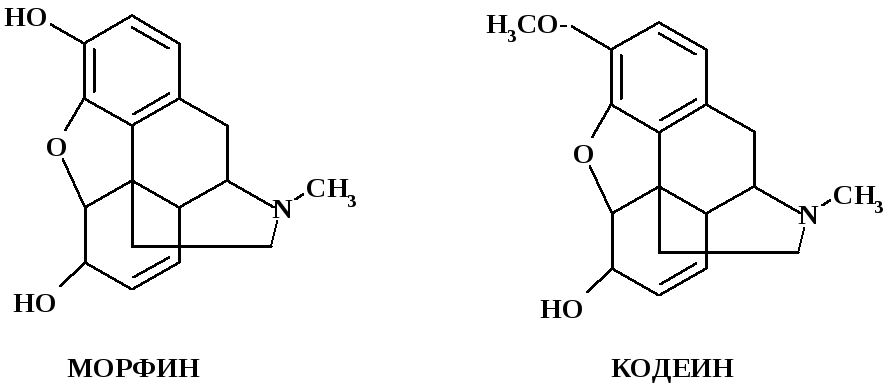
Проведение испытания на примесь морфина в кодеине основано на способности морфина, как вещества, в структуре которого присутствует свободный фенильный радикал, вступать в реакцию с нитритом натрия в среде кислоты хлористоводородной. Кодеин, как эфир морфина в данную реакцию не вступает:
Навеска кодеина
+ NaNO2/H+
+ NH4OH
Навеска морфина + NaNO2/H++NH4OH



Окраска испытуемого раствора не должна превышать окраски эталонного раствора.
5. Изониазид, как вещество, проявляющее основные свойства в связи с наличием в его структуре пиридинового атома азота и аминогруппы в гидразиновом фрагменте, может быть количественно определён методом кислотно-основного титрования в неводной среде:

Нитроксолин, проявляющий кислотные свойства за счёт наличия в структуре молекулы фенольного гидроксила и нитрогруппы (электроно-акцептор), количественно определяют в среде протофильного растворителя – диметилформамида (ДМФА). В этих условиях кислотные свойства препарата усиливаются:

6.Сумму трех кислотаскорбиновой, никотиновой и хлороводородной (пиридоксина гидрохлорид является солью слабого основания и сильной кислоты)определяют алкалиметрически с применением 0,1 н. раствора натрия гидроксида.
Кислоту аскорбиновую (как восстановитель) определяют методом йодометрии в отдельной навеске 0,1 н. раствором йода.
Пиридоксина гидрохлорид определяют аргентометрически.
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов.
Методика.Кислота аскорбиновая, кислота никотиновая, пиридоксина гидрохлорид. Точную навеску, соответствующую массе одного порошка, помещают в мерную колбу емкостью 50 мл, растворяют в 10 мл воды, добавляют 1 – 2 капли нейтрального красного и титруют 0,1 н. раствором натрия гидроксида до желтого окрашивания. Объем оттитрованного раствора доводят водой до метки (раствор А).
Кислота аскорбиновая. К 10 мл раствора А прибавляют 1 мл раствора крахмала и титруют 0,1 н. раствором йода до синего окрашивания.
1 мл 0,1 н. раствора йода соответствует 0,008806 г кислоты аскорбиновой.

Из уравнения реакции (где кислота аскорбиновая отдает два электрона), следует, что молярная масса эквивалента кислоты аскорбиновой равна ее молекулярной массе деленной на два.
Титр кислоты аскорбиновой (М.м. 176,13) рассчитывают по формуле:
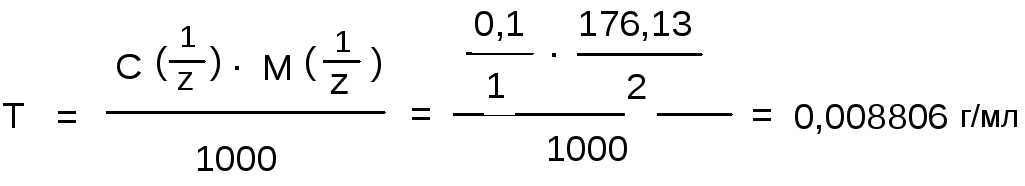
Содержание кислоты аскорбиновой (в г на один порошок) определяют по формуле:

где а– масса навески, в г;
10,0 – объем аликвотной части, в мл;
50,0 – объем разведения, в мл;
0,27– масса порошка по прописи.
Пиридоксина гидрохлорид. К 10 мл раствора А прибавляют 2-3 капли бромфенолового синего, по каплям кислоту уксусную разведенную до получения зеленовато-желтого окрашивания и титруют 0,1 н. раствором серебра нитрата до сине-фиолетового окрашивания.
1 мл 0,1 н. раствора серебра нитрата соответствует 0,02056 г
C8H11NO3HCl(пиридоксина гидрохлорида).
Пиридоксина гидрохлорид взаимодействует с серебра нитратом в соотношении (1 : 1), поэтому молярная масса эквивалента лекарственного вещества в данном случае равна его молярной массе – 205,6.
Титр пиридоксина гидрохлорида рассчитывают по формуле:

Содержание пиридоксина гидрохлорида (в г на один порошок) определяют по формуле:
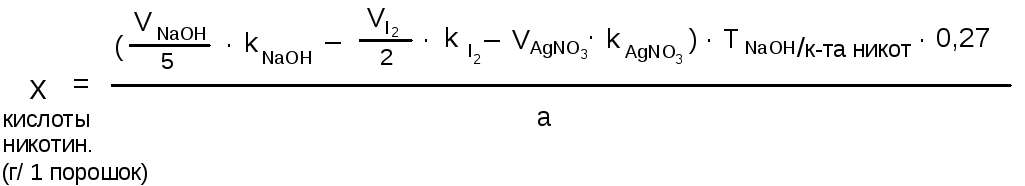
где VNaOH/5– объем 0,1 н. раствора натрия гидроксида, пошедший
на титрование суммы ингредиентов с учетом
последовательного титрования лекарственных
веществ, в мл.
1 мл 0,1 н. раствора натрия гидроксида соответствует 0,01231 г C6H5O2N(кислоты никотиновой).
Молярная масса эквивалента кислоты никотиновой в реакции с натрия гидроксидом равна молярной массе вещества – 123,1, а титр, рассчитанный по фомуле приведенной выше – 0,01231 г/мл.




