
- •Часть 3
- •Оглавление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа и контроль знаний студентов
- •После изучения главы необходимо знать следующее:
- •1.1. Геометрическая оптика
- •1.2. Интерференция света
- •1.3. Дифракция света
- •1.4. Поляризация света
- •1.5. Дисперсия и поглощение света
- •После изучения главы необходимо знать следующее:
- •2.1. Тепловое излучение
- •2.2. Взаимодействие электромагнитного излучения с веществом
- •После изучения главы необходимо знать следующее:
- •3.1. Строение атомов
- •3.2. Спектр атома водорода
- •3.3. Волновые свойства частиц вещества
- •3.4. Элементы квантовой механики
- •3.5. Электронная оболочка атома
- •3.6. Атом водорода в квантовой механике
- •После изучения главы необходимо знать следующее:
- •4.1. Строение и свойства атомного ядра
- •4.2. Радиоактивность
- •4.3. Ядерные реакции
- •После изучения главы необходимо знать следующее:
- •5.1. Краткие исторические сведения
- •5.2. Классы элементарных частиц
- •5.3. Основные характеристики элементарных частиц
- •В опросы для самоконтроля По теме Волновая оптика
- •По теме Квантовая оптика
- •По теме Физика атома
- •По теме Физика атомного ядра
- •По теме Физика элементарных частиц
- •Т олковый словарь
- •З аключение
- •Библиографический список
- •Краткий курс физики
- •Часть 3
- •394026 Воронеж, Московский просп.,14
3.2. Спектр атома водорода
Спектр испускания электромагнитных волн отдельными атомами представляет собой набор спектральных линий, соответствующих излучениям с определенной длиной волны (частотой), и поэтому называется линейчатым. Изучение линейчатых спектров испускания атомов послужило ключом к познанию строения атомов. Прежде всего, было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы, или, как их называют, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома – водорода. Расстояние между спектральными линиями закономерно убывает по мере перехода от более длинных волн к более коротким волнам.
Первые успехи были получены при изучении спектра водорода в 1885 г. И. Бальмером, который показал, что длины волн, соответствующие спектральным линиям видимого участка спектра водорода, определяются формулой:
= 0
![]() ,
n
= 3, 4, 5, ,
,
n
= 3, 4, 5, ,
где 0 = 367,56 нм – некоторая постоянная. Спектральные линии, определенные этой формулой, назвали серией Бальмера. Если перейти к частоте, получается формула Бальмера:
= R
(![]() ),
n
= 3, 4, 5, ,
),
n
= 3, 4, 5, ,
где R = 2,071016 с-1 – постоянная Ридберга (для циклической частоты). В спектроскопии принято характеризовать спектральные линии величиной, обратной длине волны:
![]() =
=
![]() ,
,
где
называют волновым
числом (не
путать с волновым числом k
=
![]() =
=
![]() ).
Формула Бальмера для волнового числа
принимает вид:
).
Формула Бальмера для волнового числа
принимает вид:
= R ( ), n = 3, 4, 5, ,
где R = 10973731, 77 м-1 – постоянная Ридберга (для обратной длины волны).
Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий. В ультрафиолетовой части спектра находится серия Лаймана. Остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены формулами:
серия
Лаймана
= R
(![]() ),
n
= 2, 3, 4, ,
),
n
= 2, 3, 4, ,
серия
Пашена
= R
(![]() ),
n
= 4, 5, 6, ,
),
n
= 4, 5, 6, ,
серия
Брэккета
= R
(![]() ),
n
= 5, 6, 7, ,
),
n
= 5, 6, 7, ,
серия
Пфунда
= R
(![]() ),
n
= 6, 7, 8, .
),
n
= 6, 7, 8, .
Частоту всех линий спектра атома водорода (рис. 33) можно представить обобщенной формулой Бальмера:
= R
(![]() ),
),
где при заданном m число n принимает целочисленные значения, начиная с m +1.
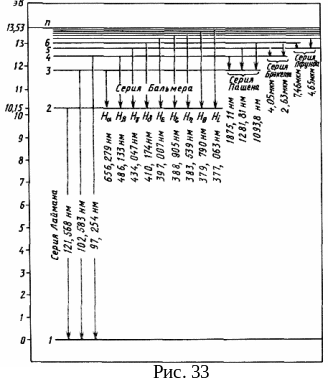
При возрастании
n
частота линии в каждой серии стремится
к предельному значению
![]() ,
которое называется границей
серии.
Частота, соответствующая границе серии,
называется термом
и обозначается Тm:
,
которое называется границей
серии.
Частота, соответствующая границе серии,
называется термом
и обозначается Тm:
Тm = (для водорода).
Терм для изоэлектронного водороду иона равен: Тm = Z .
Механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных серий, однако оставались непонятными. Решить эту проблему удалось только Бору.
Бор предложил общий принцип объяснения происхождения атомных спектров, вывел теоретически точные количественные закономерности распределения линий в спектрах атома водорода и водородоподобных ионов (Не+, Li++, Be3+, C5+). Водородоподобными ионами называются атомы, у которых удалены все электроны кроме одного, находящегося в поле ядра с положительным зарядом Ze, где Z – порядковый номер элемента в периодической таблице, е – элементарный заряд.
Положение линий в линейчатом спектре испускания вещества точно совпадает с положением линий в линейчатом спектре поглощения этого же вещества. У атомов разных химических элементов электрический заряд атомных ядер имеет различное значение, поэтому стационарные состояния их различны, что приводит к различиям в их линейчатых спектрах испускания и поглощения.
Атом водорода в классической физике. Согласно полуклассической теории Бора, движение электрона вокруг ядра в стационарных состояниях определяется законами классической механики, для описания же процессов перехода атома из одного стационарного состояния в другое необходимо пользоваться квантовыми представлениями.
Для
движения электрона по круговой орбите
с радиусом rn
в рамках модели атома Резерфорда из
уравнения движения (кулоновская сила
притяжения электрона к ядру атома
уравновешивается центробежной силой
отталкивания электрона от ядра) Fкул
= mеац.с.
и
правила квантования орбит (второй
постулат) mevnrn
= nћ,
после подстановок выражений для
кулоновской силы Fкул
=
![]() и центростремительного ускорения ац.с
= vn2/rn,
получается соотношение:
и центростремительного ускорения ац.с
= vn2/rn,
получается соотношение:
= mеац.с,
из которого можно выразить скорость электрона на n – й орбите и ее радиус:
vn
=
![]() ,
rn
=
,
rn
=
 .
.
Минимальное
возможное значение орбитального момента
импульса электрона равно (при n
= 1) mev1r1
= ћ
=
![]() = 1,05510-34
Джс.
Радиус первой круговой стационарной
орбиты, называемый боровским
радиусом,
равен
= 1,05510-34
Джс.
Радиус первой круговой стационарной
орбиты, называемый боровским
радиусом,
равен
r1
=
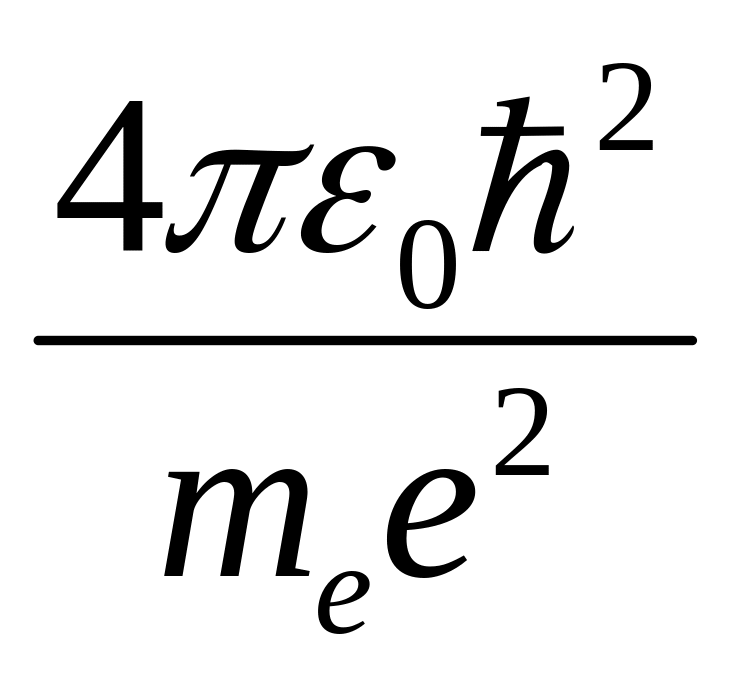 = 5,2910-11
м.
= 5,2910-11
м.
Радиусы последующих стационарных орбит вычисляются для n = 2, 3, .
Потенциальная энергия Ер электростатического взаимодействия электрона с ядром в атоме водорода определяется формулой:
Ер
= -
![]() .
.
Кинетическая энергия электрона при движении по круговой орбите равна:
Еk
=
![]() =
=
![]() .
.
Полная энергия Е системы из атомного ядра и электрона, обращающегося по круговой орбите радиусом r, равна:
Е = Ер + Еk = - .
Подставляя выражение для радиуса rn, получаем значение полной энергии Еn атома водорода в данном стационарном состоянии:
Еn
= -
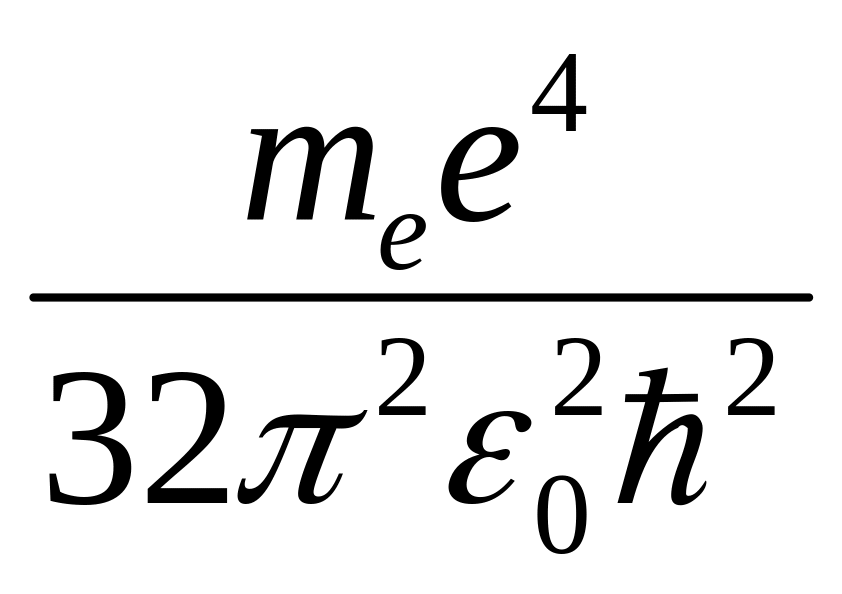
![]() .
.
При n = 1 (основное состояние атома водорода) E1 = -13,6 эВ
При переходе электрона со стационарной круговой орбиты радиусом rn на стационарную круговую орбиту радиусом rm изменение энергии атома равно:
∆Е = Еn – Еm = ( ).
Частота кванта mn, соответствующего этому переходу, равна:
mn
=
![]() =
=
![]() =
=

(
),
(
),
где величина R = = 3,291015 с-1 – постоянная Ридберга (для частоты). С учетом этого формула принимает вид:
mn = R ( ),
что согласуется с обобщенной формулой Бальмера, при замене в ней частоты на , а постоянной Ридберга R на величину R = 2R.
Расчет спектра водорода был серьезным успехом боровской теории, основные положения которой экспериментально были подтверждены в 1913 г. опытами Дж. Франка и Г. Герца по установлению факта дискретности энергетических состояний атома при исследовании столкновений электронов с атомами ртути. Однако, добившись определенного успеха в объяснении спектра атома водорода, теория Бора не позволила вычислить интенсивности излучения тех или иных частот в спектре атома водорода.
Дальнейшее развитие физики показало, что трудности теории Бора были не случайными, так как боровская теория не являлась последовательной и идея квантованности энергетических состояний атома не являлась ее следствием, а формулировалась в качестве постулата. Теория Бора не описывала и тонкую структуру водородоподобных атомов, а также свойства многоэлектронных атомов, начиная с атома гелия.
