
- •Часть 3
- •Оглавление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа и контроль знаний студентов
- •После изучения главы необходимо знать следующее:
- •1.1. Геометрическая оптика
- •1.2. Интерференция света
- •1.3. Дифракция света
- •1.4. Поляризация света
- •1.5. Дисперсия и поглощение света
- •После изучения главы необходимо знать следующее:
- •2.1. Тепловое излучение
- •2.2. Взаимодействие электромагнитного излучения с веществом
- •После изучения главы необходимо знать следующее:
- •3.1. Строение атомов
- •3.2. Спектр атома водорода
- •3.3. Волновые свойства частиц вещества
- •3.4. Элементы квантовой механики
- •3.5. Электронная оболочка атома
- •3.6. Атом водорода в квантовой механике
- •После изучения главы необходимо знать следующее:
- •4.1. Строение и свойства атомного ядра
- •4.2. Радиоактивность
- •4.3. Ядерные реакции
- •После изучения главы необходимо знать следующее:
- •5.1. Краткие исторические сведения
- •5.2. Классы элементарных частиц
- •5.3. Основные характеристики элементарных частиц
- •В опросы для самоконтроля По теме Волновая оптика
- •По теме Квантовая оптика
- •По теме Физика атома
- •По теме Физика атомного ядра
- •По теме Физика элементарных частиц
- •Т олковый словарь
- •З аключение
- •Библиографический список
- •Краткий курс физики
- •Часть 3
- •394026 Воронеж, Московский просп.,14
После изучения главы необходимо знать следующее:
Модели атома Томсона и Резерфорда. Постулаты Бора.
Линейный спектр атома водорода. Атом водорода в классической физике.
Корпускулярно-волновой дуализм свойств вещества. Волны де Бройля. Соотношения неопределенностей.
Общее уравнение Шредингера. Описание микрочастиц с помощью волновой функции. Уравнение Шредингера для стационарных состояний.
Движение свободной частицы. Частица в одномерной прямоугольной «потенциальной яме». Туннельный эффект.
Водородоподобный атом в квантовой механике. Квантовые числа. Спектр атома водорода.
Спин электрона. Принцип Паули. Распределение электронов в атоме по состояниям.
3.1. Строение атомов
Атом – наиболее простая из сложных конструкций, окружающего нас материального мира. Открытие электрона и обнаружение электронов в составе всех атомов на основании экспериментов: М. Фарадея в 1833 г. при изучении электролиза; Дж. Томсона в 1897 г. по изучению электрического заряда в разряженных газах, исследованиям термоэлектронной эмиссии и фотоэффекта; Р. Милликена в 1909 г. по измерению заряда электронов, было первым доказательством сложности их строения.
Важным фактом, свидетельствующим о сложной внутренней структуре атомов, было открытие в начале в. линейчатых спектров испускания электромагнитного излучения атомами химических элементов.
Еще одним доказательством сложности строения атомов явилось открытие в 1896 г. А. Беккерелем радиоактивности при изучении солей урана.
В 1869 г. Д. И. Менделеев упорядочил атомы большого количества химических элементов, расположив элементы в таблице по возрастанию веса их атомов, и сформулировал периодический закон повторяемости химических свойств элементов, носящий его имя. Самый легкий – атом водорода. Последний природный (не созданный искусственно) атом – атом урана, который тяжелее атома водорода в 200 с лишним раз.
Понимание строения атома объясняло бы все многообразие имеющихся экспериментальных данных. Однако в конце в. - начале в. отсутствовали даже ясные представления о структуре атома, то есть о массивном ядре и электронных орбитах, поэтому были проведены теоретические исследования по систематизации результатов и по разработке модели строения атома.
Модель атома Томсона. Одну из первых моделей строения атома предложил в 1903 г. Дж. Томсон. Он предположил, что атом имеет форму шара; положительный заряд распределен равномерно по всему объему этого шара, а отрицательно заряженные электроны находятся внутри него (рис. 28). В модели Томсона максимальное отклонение испытывают частицы, пролетающие вблизи края атома–шара, где напряженность электрического поля максимальна. Радиус шара оценивался по межатомному расстоянию и приравнивался величине R 310-10 м.
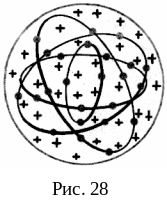
В настоящее время эта модель имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атомов.
Ядерная модель атома. Только в 1911 г. Э. Резерфорд убедительно показал, что почти вся масса атома сосредоточена в его ядре – небольшой (даже по сравнению с атомом) области пространства: радиус ядра приблизительно в 100 тысяч раз меньше размера атома. В опыте Резерфорда было установлено, что при бомбардировке узким пучком альфа–частицы (-частица - ядро гелия, содержащее 2 протона и 2 нейтрона), энергия которых 5 7 МэВ, проникают сквозь тонкие металлические пластинки почти без отклонения от своего прямолинейного пути. При прохождении через слой золота толщиной 410-7 м большинство альфа–частиц отклонялось от прямолинейного пути на углы не более 1 2 градусов. Небольшая часть альфа–частиц испытывала отклонение на значительно большие углы, а на угол 180 градусов, то есть обратно к источнику, отражалась в среднем одна частица из 8 тысяч (рис. 29).

Величина угла отклонения вычислялась из формулы:
tg
=
![]() =
=
![]() ,
,
при
рассмотрении рассеяния
- частиц массой m,
налетающих на отталкивающий кулоновский
центр Fr
=
![]() =
=
![]() ,
заряд которого (+ Ze,
при порядковом номере Z
= 79), с начальной кинетической энергией
Еk
= mv02/2
и прицельным параметром, равным b
310-10
м (рис. 30).
,
заряд которого (+ Ze,
при порядковом номере Z
= 79), с начальной кинетической энергией
Еk
= mv02/2
и прицельным параметром, равным b
310-10
м (рис. 30).
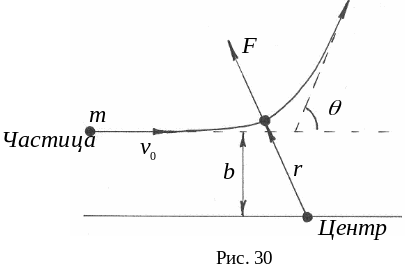
Опыты Резерфорда не только привели к открытию атомных ядер, но и показали, что в атоме действуют те же электростатические силы, которые отталкивают друг от друга одноименно заряженные тела и притягивают друг к другу разноименно заряженные.
Ядерная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц в веществе, но не смогла объяснить устойчивость атома, так как оказалась в противоречии с законами классической механики и электродинамики.
Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Резерфорду пришлось отказаться от статической модели атома и ввести планетарную модель атома, предположив, что электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем согласно классической электродинамике он должен непрерывно излучать электромагнитные волны. Процесс излучения сопровождается потерей энергии, так что электрон должен в конечном счете упасть на ядро за время порядка 10-10 с (рис. 31).
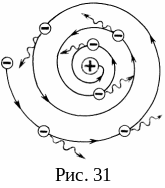
Таким образом, атом, согласно законам классической физики, неустойчив. Он может существовать лишь короткое время, за которое электроны израсходуют всю свою энергию на излучение и упадут на ядро. Но в действительности атомы устойчивы и в невозбужденном состоянии не излучают электромагнитные волны.
Квантовые постулаты Бора. Выход из создавшегося тупика был найден в 1913 г. Н. Бором, который на уровне гениальной догадки ввел некоторые допущения в рамках модели Резерфорда, для объяснения устойчивости атомов и закономерностей в их линейчатых спектрах. Допущения, противоречащие классическим представлениям, содержались в высказанных Бором постулатах:
Первый постулат (постулат стационарных состояний) – атомная система (атом) может находиться только в некоторых стационарных состояниях, в которых не происходит излучения энергии. Стационарным состояниям атома соответствуют дискретные разрешенные значения энергии, изменение которой связано с квантовым (скачкообразным) переходом атома из одного стационарного состояния в другое. Стационарным состояниям атома соответствуют стационарные орбиты, по которым с ускорением могут двигаться электроны без излучения электромагнитных волн;
Второй постулат (правило квантования орбит) – в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантовые (дискретные) значения момента импульса, удовлетворяющие условию:
mevnrn = nћ,
где mevnrn – момент импульса электрона на n – й орбите, me - масса электрона, vn – скорость электрона на n – й орбите, rn – радиус n – й орбиты, n – целое число (n 0), называемое главным квантовым числом, ћ = h/2, h – постоянная Планка;
Третий постулат (условие частот Бора) – атом излучает (или поглощает) квант электромагнитной энергии, когда электрон переходит с орбиты с большим (или меньшим) числом n на орбиту с меньшим (или большим) n. Энергия кванта равна разности энергий электронов на орбитах до и после перехода:
Е = ћmn = hmn = Em – En,
где частота кванта (фотона), излучаемого или поглощаемого при переходе, равна:
mn
=
![]() =
=
![]() .
.
Для наглядного представления возможных энергетических состояний атомов (электронов) используются энергетические диаграммы, на которых каждое стационарное состояние отмечается горизонтальной линией, называемой энергетическим уровнем. Бесконечно долго атом (электрон) может находиться на низшем уровне диаграммы с минимальной энергией Е1, которая соответствует основному (нормальному) стационарному состоянию. Все остальные состояния с энергиями Е2, Е3, , Еn называются возбужденными стационарными состояниями, время нахождения в которых обычно не превышает 10-7 10-9 с. Переходы атома (электрона) из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода обозначается стрелкой и сопровождается либо поглощением фотона (переход в состояние с большей энергией), либо излучением фотона (переход в состояние с меньшей энергией) (рис. 32).

Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома.
Постулаты Бора позволяют объяснить происхождение линейчатых спектров испускания и поглощения, связывая их появление с наличием дискретного ряда энергетических состояний атомов и переходами между ними.
Простейшей атомной системой является атом водорода, состоящий из одного электрона, движущегося в кулоновском поле одного протона. Полуклассическая теория Бора позволила рассчитать спектр атома водорода.
