
- •Биомолекулы: свойства, роль в биохимии человека, технологии получения
- •Введение
- •Биомолекулы
- •1.1. Определение и становление биохимии как науки
- •Контрольные вопросы
- •Химический состав живой материи. Понятие о макро- и микроэлементах. Биологические структуры живых систем
- •Химические элементы в клетках человека [1]
- •Основные химические соединения в клетках человека[1]
- •Контрольные вопросы
- •Вода - самое распространенное соединение в живых организмах
- •Участие в химических реакциях
- •Поддержание структуры клеток
- •Транспорт веществ
- •Участие в терморегуляции
- •Приспособленность живых организмов к водной среде
- •Круговорот воды в природе
- •Запасы воды в различных частях гидросферы [5]
- •«Кислые» дожди загрязняют наши озера и реки [6]
- •Контрольные вопросы
- •1.4. Аминокислоты: строение, свойства и биологическая роль
- •Протеиногенные α-аминокислоты
- •Контрольные вопросы
- •1.5. Белки: ковалентная структура и биологические функции
- •Классификация белков
- •Химические свойства
- •Физические:
- •Химические:
- •Функции белков
- •Белки в обмене веществ
- •Контрольные вопросы
- •1.6. Ферменты: строение, свойства, биологическая роль
- •Функции ферментов
- •Кинетика ферментативных реакций [6-8]
- •Влияние физико-химических факторов на активность ферментов
- •Нарушение каталитической активности ферментов
- •Контрольные вопросы
- •1.7. Углеводы: строение, биологические функции
- •Значение углеводов
- •Моносахариды
- •Олигосахариды
- •Полисахариды
- •Углеводы − заменители сахара [10-12]
- •Контрольные вопросы
- •1. 8. Липиды и их биохимические функции
- •Методы контроля показателей качества жиров [13]
- •Коэффициенты пересчета кислотного числа чк жира на процентное содержание свободных жирных кислот (кислотность, %)
- •Контрольные вопросы
- •1.9. Витамины – незаменимые микрокомпоненты пищи
- •Водорастворимые витамины
- •Жирорастворимые витамины
- •Авитаминозы
- •Витаминоподобные вещества
- •Контрольные вопросы
- •2. Биохимия человека
- •2.1. Питание человека
- •Питательные вещества, необходимые человеку*
- •Контрольные вопросы
- •2.2. Энергетические потребности организма
- •Суточная потребность в энергии [18]
- •Энергетические потребности при разных видах деятельности [18]
- •Контрольные вопросы
- •Перечень основных профессий, относящихся к различным группам интенсивности труда
- •Контрольные вопросы
- •2.4. Рациональное питание
- •Некоторые аспекты биохимии человека
- •Качество белков некоторых пищевых продуктов
- •Пищевые добавки
- •Список вредных пищевых добавок [30]
- •Вредные добавки в продуктах питания [23, 29-31]
- •Контрольные вопросы
- •3. Биотехнология
- •3.1. Научные основы биотехнологии
- •Контрольные вопросы
- •3.2. Новые направления биотехнологии
- •Контрольные вопросы
- •3.3. Генная инженерия. Методы генной инженерии
- •Контрольные вопросы
- •3.4. Биотехнология и проблемы защиты окружающей среды
- •Биотехнологические методы защиты окружающей среды [47]
- •История возникновения экологических проблем и классификация загрязнителей окружающей среды
- •Источники загрязнения окружающей среды
- •Контрольные вопросы
- •Словарь наиболее употребляемых терминов и определений
- •Заключение
- •Библиографический список к части 1
- •6. Комов, в.П. Биохимия: учебник для студентов вузов / в.П. Комов, в.Н. Шведова. – м.: Дрофа, 2008. – 639 с.
- •К части 2
- •К части 3
- •Оглавление
- •3.4. Биотехнология и проблемы защиты окружающей среды …………...127
- •394006 Воронеж, ул. 20-летия Октября, 84
«Кислые» дожди загрязняют наши озера и реки [6]
Чистая вода, контактирующая с «нормальным» воздухом, имеет рН около 5,6, а не теоретическую величину рН = 7. Это связано с тем, что воздух содержит небольшое количество газообразной СО2 (около 0,04 %, что соответствует парциальному давлению 0,3 мм рт. ст.). Когда чистая вода, имеющая рН 7,0, приходит в равновесие с СО2 воздуха, в ней происходят обратимые реакции, в ходе которых образуются ионы Н+ и НСО3- и рН воды снижается приблизительно до 5,6. За последние сто или более лет кислотность осадков – дождей и снега в восточной части США и Северной Европе постепенно возросла в тридцать раз, что привело к снижению рН воды в озерах и реках этих областей примерно от 5,6 до величин значительно ниже 5,0.
«Кислые» дожди возникают при взаимодействии дождевой воды с содержащимися в атмосфере диоксидами серы и оксидами азота, образующимися в результате сжигания угля и нефти, содержащих небольшие количества соединений серы и азота. Таким образом, дождевая вода превращается по существу в разбавленный раствор серной и азотной кислот. Тепловые электростанции и металлургические предприятия, сжигающие уголь и нефть, обычно снабжены высокими дымовыми трубами, через которые продукты сгорания выбрасываются в атмосферу, чтобы исключить загрязнение нижних слоев воздуха, поэтому верхние слои атмосферы над огромными областями земного шара оказались загрязненными этими кислотами, выпадающими на землю в виде дождя. Иногда местные дожди могут быть особенно кислыми: во время ливней в Шотландии в 1974 г. дождевая вода имела рН 2,4 (более низкая величина, чем рН уксуса!). Вследствие «кислых» дождей вода во многих озерах Скандинавских стран, восточной части Канады, северной части Новой Англии, а также в горах Адирондака и во Флориде стала настолько кислой, что рыба в этих озерах частично или полностью погибла, так как многие виды рыб не выносят кислотности ниже рН 5. Более того, повышение кислотности воды уже вызвало нарушение неустойчивого равновесия между животными и растениями в некоторых пресноводных экологических системах. Поскольку в будущем количество сжигаемого угля увеличится, можно ожидать, что это приведет к еще большей загрязненности запасов пресной воды, если тепловые электростанции и металлургические предприятия не будут снабжены эффективными установками, предотвращающими выброс загрязняющих веществ в атмосферу.
Контрольные вопросы
Представьте схему содержания воды в организме человека.
Охарактеризуйте участие воды в химических реакциях.
Перечислите функции воды в живых организмах.
Какова приспособленность живых организмов к водной среде?
В чем опасность «кислотных» дождей?
1.4. Аминокислоты: строение, свойства и биологическая роль
Гетерофункциональные соединения, молекулы которых содержат одновременно амино- и карбоксильную группы называются аминокислотами. Общее число встречающихся в природе аминокислот достигает 100. При этом в организме человека найдено около 70 аминокислот, из которых 20 входят в состав белка. Они относятся к α-аминокислотам и называются протеиногенными (см. табл. 4).
Все 20 α-аминокислот, встречающиеся в белках, характеризуются общей структурной особенностью – наличием 2-х различных функциональных групп, связанных с одним и тем же атомом углерода. Различаются же аминокислоты только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде.
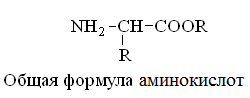
Аминокислоты в молекуле белка соединены между собой пептидными связями (–СО–NH–), образуя полипептидные цепи. Пептидная связь возникает между карбоксильной группой одной аминокислоты и аминогруппой другой, что сопровождается выделением молекулы воды. В белках различают несколько уровней структурной организации.
Все аминокислоты – амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 -CH2 -COOH + HCl → HCl • NH2 -CH2 -COOH
(гидрохлорид глицина)
NH2 -CH2 -COOH + NaOH → H2O + NH2 -CH2 -COONa
(натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NH2 - CH2COOH ↔N+H3 - CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Таблица 4
