
- •Энтропия. Теоретические и практические материалы
- •Предисловие
- •1. Теоретическая часть
- •1.1. Приведённое количество тепла.
- •1.2. Энтропия
- •1.3. Свойства энтропии
- •1.4. Второе начало термодинамики
- •1.5. Теорема Нернста (III начало термодинамики)
- •1.6. Энтропия и термодинамическая вероятность
- •2. Примеры решения задач на вычисление энтропии
- •Решение
- •Решение
- •3. Задачи для самостоятельного решения по теме «энтропия»
- •Энтропия теоретические и практические материалы
- •394026 Воронеж, Московский просп., 14
- •Энтропия. Теоретические и практические материалы
3. Задачи для самостоятельного решения по теме «энтропия»
3.1. А. Определить изменение энтропии одного моля идеального газа в изобарном, изохорном и изотермическом процессах.
Ответ:
![]() ;
;
![]() ;
;![]() .
.
3.2.
А. Смешали воду массой m1=5
кг при температуре Т1=280 К с водой
m2=8 кг при температуре
Т2=350 К. Найти: 1)температуру
![]() смеси
смеси
2) изменение энтропии, происходящее при смешивании.
Ответ:
![]() .
.
![]() .
.
3.3. А. В результате изохорного нагревания водорода массой m=1г давление Р газа увеличилось в 2 раза. Определить изменение энтропии газа.
Ответ: 7,2 Дж/К.
3.4. А. Найти изменение S энтропии при изобарном расширении азота массой m= 4г от обьёма V1= 5 л до обьёма V2=9 л.
Ответ: 2,43 Дж/К.
3.5. В. Объем гелия, масса которого 2 кг, увеличился в
раз: 1)изотермически; 2) адиабатически.
Чему равно изменение энтропии в этих случаях?
Ответ: 1)
![]() ,
2)
,
2)
![]() .
.
3.6. В. Кусок льда массой m=200 г, взятый при температуре t1= -10C, был нагрет до температуры t2= 0С и расплавлен, после чего образовавшаяся вода была нагрета до t3= 10C. Определить изменение энтропии в ходе указанных процессов.
Ответ: 291 Дж/К.
3.7. В. Лед массой m1=2кг при температуре t1= 0С был превращен в воду той же температуры с помощью пара, имеющего температуру t2= 100C. Определить массу m2 израсходованного пара. Каково изменение энтропии системы ледпар?
Ответ:
![]() .
.
![]() где r – удельная теплота
парообразования,
-
удельная теплота плавления.
где r – удельная теплота
парообразования,
-
удельная теплота плавления.
3.8. А. Кислород массой m=2 кг увеличил свой объем в n=5 раз один раз изотермически, другой – адиабатно. Найти изменения энтропий в каждом из указанных процессов.
Ответ:
![]() ;
;
![]() .
.
3.9. В. Гелий массой m=200г был изобарно нагрет так, что объем его увеличился в n=4 раза, затем гелий был изохорно охлажден так, что давление его уменьшилось в n=4 раза. Найти изменение энтропии в ходе указанных процессов.
Ответ:
![]() Дж/кг.
Дж/кг.
3.10. В. 10 граммов кислорода нагреваются от t1=50С до t2=150С. Найти изменение энтропии, если нагревание происходит: 1) изохорически; 2)изобарически
Ответ: 1)
![]() ;
2)
;
2)
![]() .
.
3.11. А. Энтропия системы изменяется с температурой по закону: S=a+bT, где а и b – константы. Какое количество тепла Q система получает при обратимом нагревании от Т1 до Т2?
Ответ: dQ=TdS;
dS=bdT;
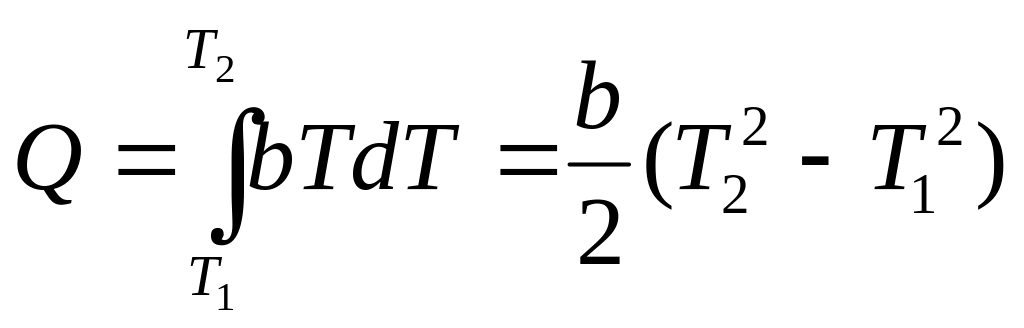 .
.
3.12. А. Во сколько раз необходимо
увеличить объем
![]() идеального газа при изотермическом
расширении, если его энтропия увеличилась
на 57,6 Дж/К?
идеального газа при изотермическом
расширении, если его энтропия увеличилась
на 57,6 Дж/К?
Ответ: 4.
3.13. В. Кислород, масса которого m=200г нагревают от температуры t1=27С до t2=127С. Найти изменение энтропии, если известно, что начальное и конечное давления одинаковы и близки к атмосферному.
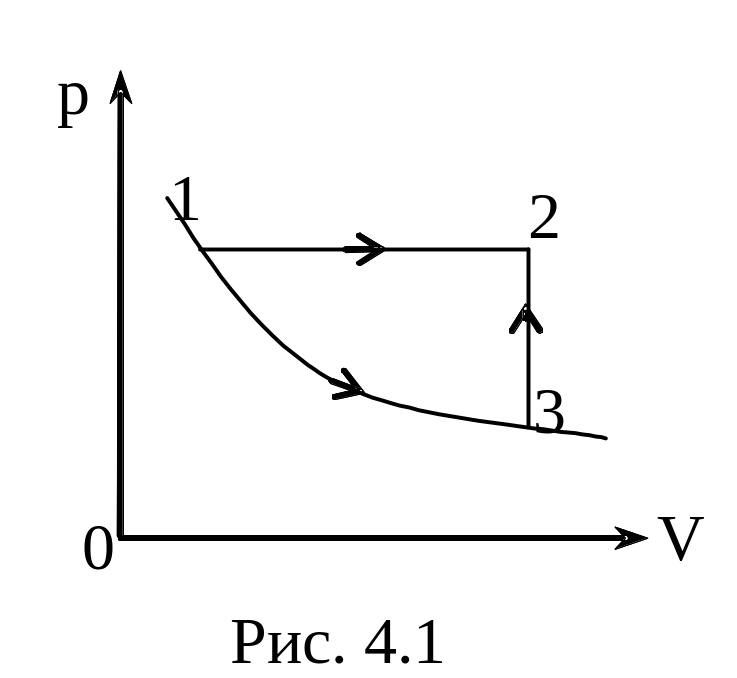
Ответ: На рис. 4.1 представлены 2 пути перехода системы из состояния 1 в состояние 2.
Для процесса 1-2
![]() (1)
(1)
где
![]()
Для процессов 1-3-2
![]() ,
(2)
,
(2)
где
![]() ,
,
![]()
вычисления по (1) и (2) дают одинаковый результат
![]() .
.
3.14. В. Горячая вода отдает теплоту холодной воде такой же массы, после чего их температуры становятся одинаковыми. Показать что энтропия при этом увеличивается.
Ответ: Изменение энтропии системы
![]() (1),
(1),
с учетом
![]() (2),
(2),
имеем
![]() .
(3).
.
(3).
Так как
(T1+T2)2
>4T1T2
, то
![]() (4)
(4)
3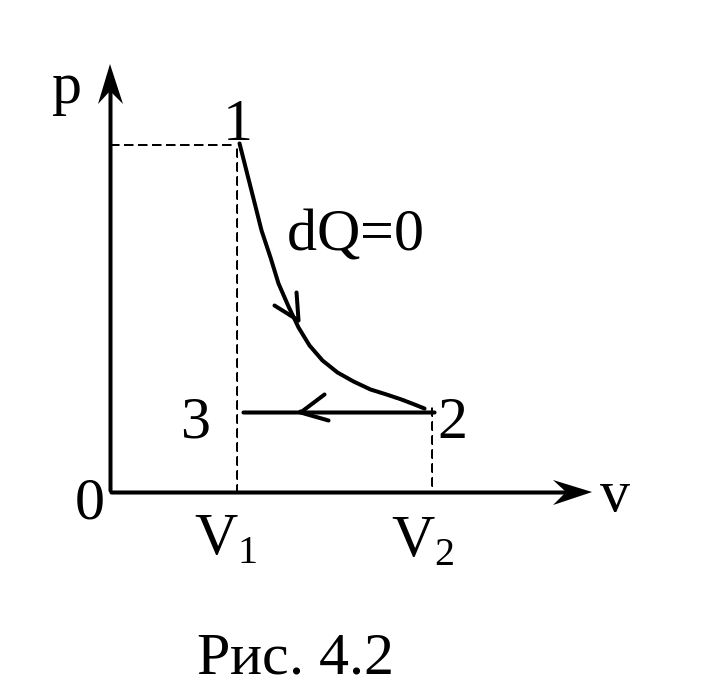 .15.
А. При нагревании двухатомного
идеального газа (
.15.
А. При нагревании двухатомного
идеального газа (![]() )
его термодинамическая температура
увеличилась в n=2 раза.
Определить изменение энтропии, если
нагревание происходит: 1)изохорно;
2)изобарно.
)
его термодинамическая температура
увеличилась в n=2 раза.
Определить изменение энтропии, если
нагревание происходит: 1)изохорно;
2)изобарно.
Ответ: 1) 28,8 Дж/К,
2) 40,3 Дж/К.
3.16. А. Идеальный газ (![]() )
сначала изобарно нагревали так, что
объем газа увеличился в n1=2
раза, а затем изохорно охладили так, что
давление его уменьшилось в n=2раза.
Определить приращение энтропии в ходе
указанных процессов.
)
сначала изобарно нагревали так, что
объем газа увеличился в n1=2
раза, а затем изохорно охладили так, что
давление его уменьшилось в n=2раза.
Определить приращение энтропии в ходе
указанных процессов.
Ответ: 11,5 Дж/К
3.17. B. Азот массой 28 г адиабатно расширили в n=2 раза, а затем изобарно сжали до начального объёма. Определите изменение энтропии газа в ходе указанных процессов (рис. 4.2).
Ответ:
![]() ,
,
![]() ,
,![]() .
.
3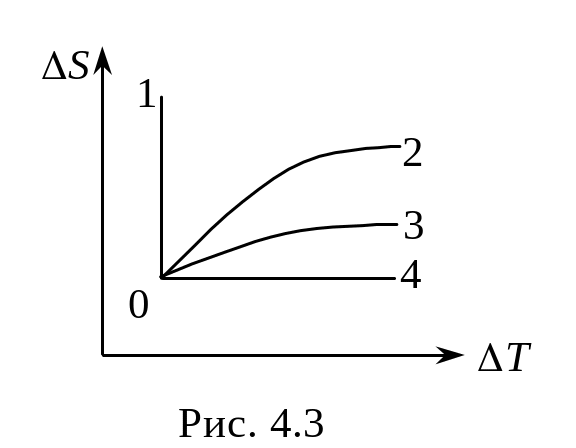 .18.
А. Из начального состояния 0 газ
переходит в другие состояния 1,2,3,4 по
различным изопроцессам (рис. 4.3). Установить
какому изопроцессу соответствует каждая
из кривых S(T)
на рисунке.
.18.
А. Из начального состояния 0 газ
переходит в другие состояния 1,2,3,4 по
различным изопроцессам (рис. 4.3). Установить
какому изопроцессу соответствует каждая
из кривых S(T)
на рисунке.
Ответ: 01 – изотермическому,
04 – адиабатическому,
0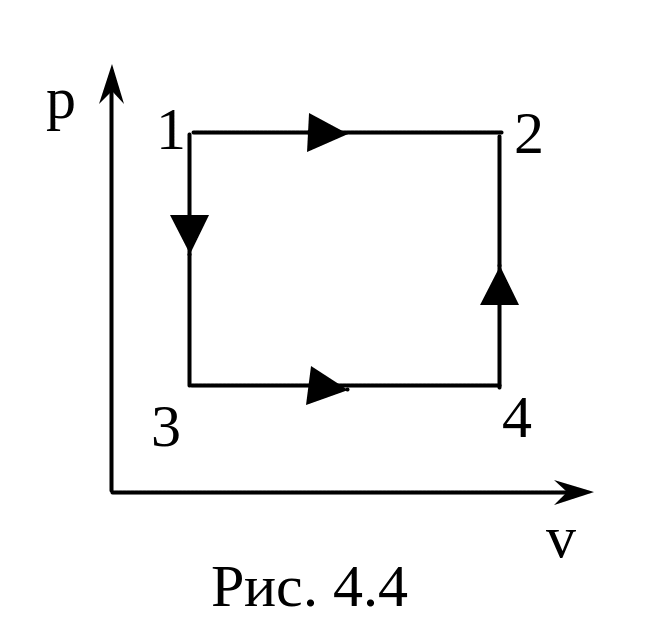 2
– изобарическому,
2
– изобарическому,
03 – изохорическому.
3.19. В. Газ в количестве одного моля из состояния 1 переходит в состояние 2 в одном случае непосредственно по изобаре, а в другом – сначала по изохоре 1-3, затем по изобаре 3-4 и, наконец, по изохоре 4-2 (рис. 4.4) Доказать прямым расчетом, что приращение энтропии в обоих случаях одинаково.
Ответ:

3.20. В. Во сколько раз необходимо
увеличить объем идеального газа (
)
при изотермическом расширении, если
его энтропия увеличилась на
![]() ?
?
Ответ:
![]()
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Савельев И.В. Курс общей физики. Кн. 3. Молекулярная физика и термодинамика / И.В. Савельев. - М.: Астрель-АСТ, 2001. – 208 с.
Савельев И.В. Курс общей физики / И.В. Савельев. - М.: Наука, 1966. – Т. 1. - 404 с.
Кикоин А.К. Молекулярная физика / А.К. Кикоин, И.К. Кикоин. - М.: Наука, 1976.- 480 с.
Дмитриева В.Ф. Основы физики / В.Ф. Дмитриева, В.Л. Прокофьев. – М.: Высш. шк., 2001.-527 с.
Бабаджан Е. И. Сборник качественных вопросов и задач по общей физике: учеб. пособие для втузов / Е.И. Бабаджан, В.И. Гервидс, В.М. Дубовик, Э.А. Нерсесов. – М.: Гл. ред. физ- мат лит., 1990. – 400 с.
Трофимова Г.И. Сборник задач по курсу физики с решениями / Г.И. Трофимова, З.Г. Палова. – М.: Высш. шк., 2004. – 591 с.
Чертов А.Г. Задачник по физике / А.Г. Чертов, А.А. Воробьёв. – М.: Интеграл Пресс, 1997. – 544 с.
Волькинштейн В.С. Сборник задач по общему курсу физики / В.С. Волькинштейн. – СПб.: Спец. лит., 2002. – 327 с.
Сборник задач по общему курсу физики для втузов / Л.Г. Гурьев, А.В. Кортнев, А.Н. Куценко, Б.В. Латьев, С.Е. Минкова, Ю.В. Рублёв, В.В. Тищенко, М.М. Шелепуха. М.: Высш. шк., 1972.- 432 с.
Новодворская Е.М. Сборник задач по физике для ВТУзов / Е.М. Новодворская, Э.М. Дмитриева. – М.: ОНИКС 21 век “Мир и образование”, 2003. - 368 с.
CОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ…………………………………………………..1
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ…………………………………….2
1.1. Приведенное количество тепла. Неравенство Клаузиуса....... 2
1.2. Энтропия……………………………………………………5
1.3. Свойства энтропии…………………………………………9
1.4. Второе начало термодинамики…………………………...13
1.5. Теорема Нернста (III начало термодинамики)…………..14
1.6. Энтропия и термодинамическая вероятность……………15
2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ НА ВЫЧИСЛЕНИЕ
ЭНТРОПИИ………………………………...........................19
3. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ ПО ТЕМЕ «ЭНТРОПИЯ»………………………………………………...36
БИБЛИОГРАФИЧЕСКИЙ СПИСОК……………………………42
