
- •Энтропия. Теоретические и практические материалы
- •Предисловие
- •1. Теоретическая часть
- •1.1. Приведённое количество тепла.
- •1.2. Энтропия
- •1.3. Свойства энтропии
- •1.4. Второе начало термодинамики
- •1.5. Теорема Нернста (III начало термодинамики)
- •1.6. Энтропия и термодинамическая вероятность
- •2. Примеры решения задач на вычисление энтропии
- •Решение
- •Решение
- •3. Задачи для самостоятельного решения по теме «энтропия»
- •Энтропия теоретические и практические материалы
- •394026 Воронеж, Московский просп., 14
- •Энтропия. Теоретические и практические материалы
Решение
Разность энтропий
![]() двух состояний 1 и 2 определим по формуле
двух состояний 1 и 2 определим по формуле
![]() (1)
(1)
Согласно первому началу термодинамики:
![]() (2)
(2)
Здесь
![]() - молярная теплоемкость при постоянном
объеме.
- молярная теплоемкость при постоянном
объеме.
![]() ,
,
где i- число степеней свободы молекулы (для кислорода i=5).
Из уравнения Клайперона –Менделеева
![]() ,
,
тогда
 (3)
(3)
Подставив числовые значения в (3) и вычислив, получим
![]() .
.
Ответ:
![]() Дж/К.
Дж/К.
Задача 2.6. Найти изменение энтропии
при переходе 6г водорода от объема в 20л
под давлением
![]() к
объему в 60л под давлением в
к
объему в 60л под давлением в
![]() .
.
Дано: m=6г=0,006кг
|
|
По первому закону термодинамики
![]() (1)
(1)
Применяя уравнение Клайперона- Менделеева
![]() ,
,
получим
![]() (2)
(2)
Из уравнения Клайперона –Менделеева имеем
![]() .
(3)
.
(3)
Подставляя (3) в (2), получим:
![]() ,
(4)
,
(4)
где - молярная теплоемкость водорода при постоянном объеме
![]()
![]() -
молярная теплоемкость водорода при
постоянном давлении
-
молярная теплоемкость водорода при
постоянном давлении
![]()
Подставив числовые значения в выражение (4), получим
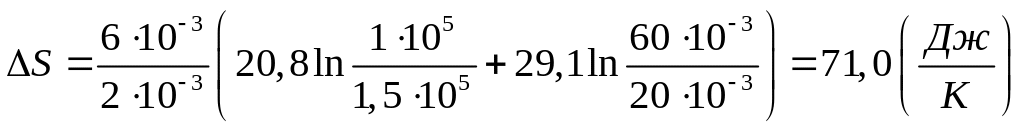 .
.
Ответ:
![]() Дж/К.
Дж/К.
Задача 2.7. Водород массой m=100г был изобарно нагрет так, что объем его увеличился в n=3 раза, затем водород был изохорно охлажден так, что давление его уменьшилось в n=3 раза. Найти изменение энтропии в ходе указанных процессов.
Дано: m=100г=0,1кг
а)
n=3 б)
n=3 |
|
Изменение энтропии в ходе указанных процессов будет складываться из изменения энтропии при и , т.е.
![]() (1)
(1)
Изменение энтропии водорода в любом процессе можно определить по формуле
![]() ,
(2)
,
(2)
где dQ – элементарное количество теплоты, полученное водородом при температуре T.
В случае изобарного нагревания, изменение энтропии будет равно
![]() ,
(3)
,
(3)
где
![]() .
(4)
.
(4)
подставляя выражение (4) в (3), получим
 (5)
(5)
По закону Гей-Люссака
![]() (6)
(6)
Используя (6), выражение (5) приведем к виду
 (7)
(7)
При изохорном охлаждении
![]() (8)
(8)
где
![]() (9)
(9)
С учетом (9) выражение (8) примет вид
 (10)
(10)
По закону Шарля
![]() (11)
(11)
С учетом (11) выражение (10) будет иметь вид
 . (12)
. (12)
Подставив (7) и (12) в (1), найдем
 (13)
(13)
По условию задачи
![]() и
и
![]()
тогда

следовательно,
![]() .
.
Так как
![]() ,
то
,
то
![]() .
(14)
.
(14)
В условиях данной задачи
![]() .
.
Ответ:
![]() Дж/К.
Дж/К.
Задача 2.8. Определить изменение энтропии одного моля идеального газа в изобарном, изохорном и изотермическом процессах.
Решение
Физическая система – один моль идеального газа – участвует в трех различных изопроцессах. Эти процессы квазистатические и обратимые. Следовательно, изменение энтропии можно получить непосредственно по формуле
![]() (1)
(1)
Для изобарного процесса
 (2)
(2)
При постоянном давлении
![]() .
.
Для изохорного процесса
 . (3)
. (3)
При постоянном объеме
![]() .
.
Для изотермического процесса
 .
(4)
.
(4)
Ответ:
![]() ;
;
![]()
![]() .
.
Задача 2.9. Адиабатно изолированный
сосуд разделен на две равные части
жесткой и нетеплопроводной перегородкой
(рисунок). В каждой половине сосуда
находится по одному молю одинакового
идеального трехатомного газа: в левой
половине — при температуре
![]() ,
в правой — при температуре
,
в правой — при температуре
![]() .
Перегородку убирают. Определить изменение
энтропии газа после того, как установится
равновесное состояние.
.
Перегородку убирают. Определить изменение
энтропии газа после того, как установится
равновесное состояние.
Дано: i = 6 1=2= 1 моль T1=600 K T2= 300 K V1=V2=V0 |
|
Р
![]() .
До снятия перегородки она также адиабатно
изолирована и находится в равновесном
состоянии. Система III (общая) является
объединением систем I и II. После снятия
перегородки и в системе III и в каждой
из систем I и II происходят
не-квазистатические и необратимые
процессы, в результате которых в них
устанавливаются равновесные состояния.
Так как возникающие процессы необратимы,
то применять непосредственно формулу
.
До снятия перегородки она также адиабатно
изолирована и находится в равновесном
состоянии. Система III (общая) является
объединением систем I и II. После снятия
перегородки и в системе III и в каждой
из систем I и II происходят
не-квазистатические и необратимые
процессы, в результате которых в них
устанавливаются равновесные состояния.
Так как возникающие процессы необратимы,
то применять непосредственно формулу
![]()
для нахождения
изменения энтропии системы III нельзя
Необходимо найти такие процессы, в
результате которых системы I и II из
начального в то же конечное состояние
перешли бы обратимым образом. Для этого
необходимо нарушить первоначальную
адиабатную изолированность систем I и
II. Поставим вместо нетеплопроводящей
идеально проводящую теплоту невесомую
перегородку. Теперь системы I и II имеют
тепловой контакт (они адиабатно не
изолированы). В каждой системе происходит
обратимый изохорный процесс (в левой -
охлаждения, в правой - нагревания до
температуры смеси
![]() ).
Нетрудно найти конечную равновесную
температуру. Если в результате теплообмена
температура газа в левой части сосуда
уменьшиться, так, что
).
Нетрудно найти конечную равновесную
температуру. Если в результате теплообмена
температура газа в левой части сосуда
уменьшиться, так, что
![]() ,
,
то в правой части температура увеличится и
![]() .
.
При выравнивании температур
![]() ,
,
тогда
![]() и
и
![]() ,
,
следовательно
![]() .
.
Теперь можно убрать и эту (теплопроводящую)
перегородку. Так как обе подсистемы I и
II находятся в термодинамическом
равновесии при температуре
,
то и общая система III находится в
равновесном состоянии. Заметим, если
изохорные процессы в системах I и II можно
считать обратимыми, то процесс
теплопередачи в системе III нельзя считать
обратимым. Обозначим
![]() и
и
![]() изменения энтропии систем I и II. Тогда
изменение энтропии системы III
изменения энтропии систем I и II. Тогда
изменение энтропии системы III
![]() (2)
(2)
Для системы I
 (3)
(3)
где
![]() -
молярная теплоемкость газа при постоянном
-
молярная теплоемкость газа при постоянном
объеме.
Для системы II
 (4)
(4)
Так как
![]() ,
то
,
то
![]() а
а
![]() ,
т. е. энтропия системы I убывает, а энтропия
системы II возрастает (вспомним, что эти
системы, после того как была поставлена
теплопроводящая перегородка, перестали
быть адиабатно изолированными и энтропия
каждой из них может и возрастать, и
убывать). Общая система III остается
адиабатно изолированной, и энтропия в
ней в результате необратимого процесса
должна возрастать. Действительно,
,
т. е. энтропия системы I убывает, а энтропия
системы II возрастает (вспомним, что эти
системы, после того как была поставлена
теплопроводящая перегородка, перестали
быть адиабатно изолированными и энтропия
каждой из них может и возрастать, и
убывать). Общая система III остается
адиабатно изолированной, и энтропия в
ней в результате необратимого процесса
должна возрастать. Действительно,
![]() и
и
 (4)
(4)
Подставив числовые значения в выражение (5), получим
![]() .
.
Таким образом, если количество теплоты
![]() переданной системой I, равно количеству
теплоты
переданной системой I, равно количеству
теплоты
![]() полученной системой II
полученной системой II
![]() ,
то изменение энтропии
систем
I по модулю не равно
изменению энтропии
системы II в этом же процессе теплопередачи
,
то изменение энтропии
систем
I по модулю не равно
изменению энтропии
системы II в этом же процессе теплопередачи
![]() .
.
Ответ:
![]() Дж/К.
Дж/К.
Задача 2.10. Теплоизолированный сосуд разделен на две равные части перегородкой, в которой имеется закрывающееся и отверстие. В одной половине сосуда содержится m= 10 г водорода. Вторая половина откачана до высокого вакуума. Отверстие в перегородке открывают, и газ заполняет весь объем. Считая газ идеальным, найти приращение его энтропии.
Дано: dQ=0 m=10г=10-2кг M=210-3кг/моль |
|
Расширение газа здесь является необратимым процессом. Поэтому было бы ошибкой применить формулу
![]() (1)
(1)
для данного процесса. Так как газ теплоизолирован (dQ = 0), то по (1) получили бы
![]() .
.
В действительности же, как это следует из второго начала термодинамики, энтропия газа при его необратимом расширении должна увеличиться.
Воспользуемся тем, что энтропия функция состояния и ее изменение полностью определяется начальным и конечным состояниями системы, независимо от того процесса, в ходе которого система перешла из начального состояния в конечное. Поэтому представим такой процесс расширения газа, который переводил бы его в то же самое конечное состояние, но являлся бы обратимым процессом. Найдя по формуле (1) приращение энтропии в таком обратимом процессе, мы решим поставленную задачу.
Так как данный газ изолирован от окружающей среды (Q = 0, А = 0), то его внутренняя энергия U, как это следует из первого начала термодинамики, должна оставаться постоянной. При этом будет постоянной и температура идеального газа во время его расширения. Значит, в качестве обратимого процесса, переводящего газ в то же конечное состояние, что и данный процесс, можно рассматривать процесс обратимого изотермического расширения, в ходе которого объем газа увеличивается в два раза. Так как в этом процессе , и, следовательно, Q =А, получим ответ по (1) с учетом того, что в изотермическом процессе
![]() (2)
(2)
При этом приращение энтропии будет равно
![]()
![]()
Подставив численные значения данных величин, получим
![]() .
.
Ответ:
![]() Дж/К.
Дж/К.
