
- •Энтропия. Теоретические и практические материалы
- •Предисловие
- •1. Теоретическая часть
- •1.1. Приведённое количество тепла.
- •1.2. Энтропия
- •1.3. Свойства энтропии
- •1.4. Второе начало термодинамики
- •1.5. Теорема Нернста (III начало термодинамики)
- •1.6. Энтропия и термодинамическая вероятность
- •2. Примеры решения задач на вычисление энтропии
- •Решение
- •Решение
- •3. Задачи для самостоятельного решения по теме «энтропия»
- •Энтропия теоретические и практические материалы
- •394026 Воронеж, Московский просп., 14
- •Энтропия. Теоретические и практические материалы
1.3. Свойства энтропии
П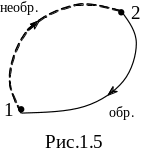 ри
обратимом процессе сумма приведенных
количеств тепла (1.12), равна приращению
энтропии. Выясним, в каком соотношении
находятся сумма приведенных количеств
тепла и приращение энтропии при
необратимом процессе. Для этого
рассмотрим, цикл, состоящий из
необратимой и обратимой ветвей (рис.
1.5) Поскольку
цикл в целом необратим, сумма приведенных
количеств тепла, взятая по всему циклу,
должна быть меньше нуля.
ри
обратимом процессе сумма приведенных
количеств тепла (1.12), равна приращению
энтропии. Выясним, в каком соотношении
находятся сумма приведенных количеств
тепла и приращение энтропии при
необратимом процессе. Для этого
рассмотрим, цикл, состоящий из
необратимой и обратимой ветвей (рис.
1.5) Поскольку
цикл в целом необратим, сумма приведенных
количеств тепла, взятая по всему циклу,
должна быть меньше нуля.
Разобьём эту сумму на две части, отнесённые к разным ветвям:
![]() (1.14)
(1.14)
Вторая из этих сумм в соответствии с (1.12) равна разности значений энтропии в состояниях 1 и 2. Поэтому соотношением (1.14) можно записать следующим образом:
![]() ,
,
откуда следует, что
S2 - S1>![]() (1.15)
(1.15)
Объединяя вместе выражения (1.12) и (1.15), получаем:
S2 – S1![]() (1.16)
(1.16)
где знак равенства соответствует любому обратимому переходу из состояния 1 в состояние 2, а знак неравенства — любому необратимому переходу 1 2. Температура Т в (1.16) означает температуру того тела, от которого система получает тепло 'Q. При обратимом процессе эта температура совпадает с температурой системы.
Соотношение (1.16) очевидно, должно выполняться для каждого элементарного процесса:
![]() (1.17)
(1.17)
или
![]() (1.18)
(1.18)
Отметим, что, поскольку энтропия – функция состояния, выражение
![]()
справедливо всегда, независимо от того, обратим соответствующий переход или необратим. Формула же
S2 – S1![]()
справедлива только в том случае, если переход обратим.
Если система изолирована, т.е. не
обменивается теплом с внешней средой,
то все
![]() в (1.16) будут равны нулю, вследствие чего
в (1.16) будут равны нулю, вследствие чего
![]() (1.19)
(1.19)
или соответственно
![]() (1.20)
(1.20)
Таким образом, энтропия изолированной системы может только возрастать (если и системе протекает необратимый процесс), либо оставаться постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может.
Процесс, протекающий без теплообмена с внешней средой, называется, как известно, адиабатическим. Следовательно, для обратимого адиабатического процесса характерно то, что он протекает при постоянной энтропии, поэтому обратимая адиабата может быть названа изэнтропой. Пользуясь новой терминологией, можно сказать, что цикл Карно состоит из двух изотерм и двух изэнтроп. На диаграмме (T,S) цикл Карно, очевидно, будет иметь вид прямоугольника (рис. 1.6). Площадь прямоугольника численно равна количеству тепла, получаемому системой за цикл. В самом деле, согласно (1.17) элементарное количество тепла, получаемого системой при обратимом процессе, равно
![]() (1.21)
(1.21)
Следовательно, количество тепла, получаемое системой при обратимом изотермическом процессе, может быть представлено следующим образом:
Q=T(S2 – S1), (1.22)
где S1 – энтропия в начале, а S2 – в конце процесса.
Используя (1.22), количества тепла, получаемые системой в ходе изотермических процессов, образующих цикл, можно записать в виде
Q12=T1(S1 - S2), Q34=T2(S2 – S1).
Полное же количество тепла, получаемое за цикл, равно
Q= Q12+ Q34= T1(S1 - S2)+ T2(S2 – S1)= (S1– S2)(T1 – T2).
Последнее выражение, как легко видеть, равно площади цикла.
С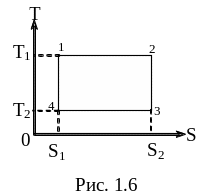 оотношение
(1.20), означающее,
что энтропия не может убывать,
относится только к изолированным
системам. Если система обменивается
теплом с внешней средой, ее энтропия
может вести себя любым образом. В
частности, если система отдает тепло
внешним телам (получаемое системой 'Q
отрицательно), энтропия системы
уменьшается.
оотношение
(1.20), означающее,
что энтропия не может убывать,
относится только к изолированным
системам. Если система обменивается
теплом с внешней средой, ее энтропия
может вести себя любым образом. В
частности, если система отдает тепло
внешним телам (получаемое системой 'Q
отрицательно), энтропия системы
уменьшается.
Если неизолированная система совершает цикл, то ее энтропия, будучи функцией состояния, принимает в конце цикла первоначальное значение. Однако в ходе цикла энтропия, вообще говоря, меняется, причем должно иметь место как возрастание энтропии на одних участках цикла, так и убывание ее на других участках, поскольку суммарное изменение энтропии за цикл должно равняться нулю.
