
- •Технология получения тканей полотняного переплетения на основе углеродных нитей
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •5. Контрольные вопросы
- •Технологии получения препрегов на основе углеродной ткани и эпоксидных связующих
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •4. Отчет о работе
- •5. Контрольные вопросы
- •Определение содержания летучих веществ, связующего и растворимой смолы в препрегах
- •1. Краткие теоретические сведения
- •1.1.Метод определения содержания летучих веществ и
- •1.2.Метод определения массовой доли растворимой смолы в препрегах
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •5. Контрольные вопросы
- •Технология получения ненаполненных и наполненных полимерных связующих на основе эпоксидных смол
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •4. Отчет о работе
- •5. Контрольные вопросы
- •Определение качественного состава эпоксидных связующих методом инфракрасной спектроскопии
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •5. Контрольные вопросы
- •Жидкостная хроматография эпоксидных связующих
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •4. Отчет о работе
- •5. Контрольные вопросы
- •Определение вязкости эпоксидных связующих ротационным методом
- •1. Краткие теоретические сведения
- •2. Методика эксперимента
- •3. Порядок выполнения работы
- •4. Отчет о работе
- •5. Контрольные вопросы
- •1. Краткие теоретические сведения
- •3. Порядок выполнения работы
- •5. Контрольные вопросы
- •394026 Воронеж, Московский просп., 14
5. Контрольные вопросы
1. В чем заключается метод ИК спектроскопии?
2. Преимущества метода ИК спектроскопии перед другими современными физико-химическими методами идентификации полимеров и их структурного анализа?
3. Как осуществляется идентификация неизвестного соединения по инфракрасному спектру?
4. Устройство и принцип работы ИК спектрометров.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Паукштис, Е. А. Оптическая спектроскопия в адсорбции и катализе. Применение ИК спектроскопии: научно-образовательное пособие для студентов, аспирантов и исследователей в области катализа, использующих методы оптической спектроскопии для изучения поверхности твердых катализаторов / Е. А. Паукштис. – Новосибирск: Институт катализа им. Г. К. Борескова сибирского отделения РАН, 2010. – 55 с.
Лабораторная работа № 6
Жидкостная хроматография эпоксидных связующих
Цель работы: определение качественного и количественного составов эпоксидных связующих методом жидкостной хроматографии.
1. Краткие теоретические сведения
Хроматография – динамический сорбционный метод разделения и анализа смесей веществ, основанный на распределении компонентов между двумя фазами: подвижной и неподвижной. В жидкостной хроматографии неподвижной (стационарной) фазой обычно служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза (элюент) представляет собой жидкость, которая проходит через неподвижную фазу под давлением. Компоненты анализируемой смеси (сорбаты) вместе с подвижной фазой перемещаются вдоль стационарной фазы, помещенной в хроматографическую колонку (стеклянную или металлическую трубку). Если молекулы разных компонентов разделяемой смеси обладают различной адсорбируемостью или растворимостью, то время их пребывания в неподвижной фазе, а следовательно, и средняя скорость передвижения по колонке различны. Одни компоненты остаются в верхнем слое сорбента, другие, с меньшей адсорбируемостью, оказываются в нижней части колонки, а некоторые покидают колонку вместе с подвижной фазой. Так достигается разделение компонентов. После прохождения колонки происходит непрерывное детектирование выходящих веществ, которое позволяет определять концентрацию веществ по интенсивности сигнала и качественный состав по ультрафиолетовому спектру выходящих веществ.
2. Методика эксперимента
От представленного образца эпоксидного связующего отбирают точечную пробу. Масса навески точечной пробы должна составлять 1-5 мг. Навеску помещают в виалу и добавляют ацетонитрил для получения концентрации связующего 1-5 мг/мл. Затем виалу помещают в устройство автоматического забора проб и проводят хроматографический анализ не менее 2-х раз. Отклонение времени удерживания не должно превышать 3%. Отклонение площади пика не должно составлять более 5%. Полученные результаты обрабатывают на компьютере с помощью специального программного обеспечения.
Для проведения измерений используется следующее оборудование и реактивы:
1. Жидкостной хроматограф Agilent 1200 series или аналог, который включает в себя систему автоматического ввода проб; систему дегазации растворителей; градиентный бинарный насос (максимальное давление 400 бар, поток 0,1 – 10 мл/мин); термостат колонок; хроматографическую колонку размером 4,6х150 мм, заполненную октадецилсиликагелем с размером частиц 3,5 мкм, с предколонкой с аналогичным сорбентом и УФ-детектор с фотодиодной матрицей (оптическое разрешение не менее 1,2 нм, шум не более ±1·10-5 AU и дрейф не более ±1·10-5 AU) (рис. 1).
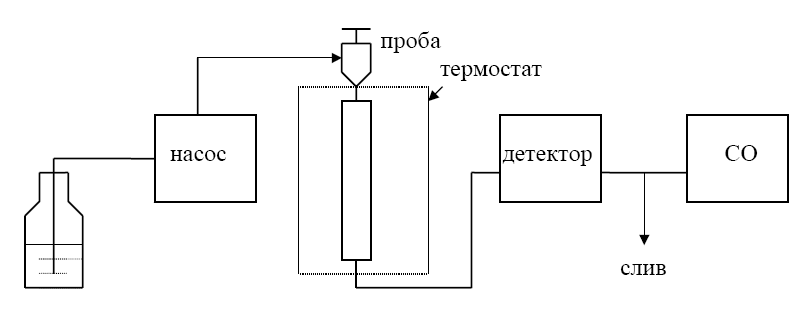
Рис. 1. Схема жидкостного хроматографа
2. Виалы из стекла с крышкой, инертной к ацетонитрилу.
3. Компьютер для управления хроматографом.
4. Аналитические весы с возможностью взвешивания до 0,1 мг.
5. Ацетонитрил.
6. Метанол.
7. Водный раствор муравьиной кислоты.
