
Механизм присоединения-отщепления (snAr)
Наличие в ароматическом кольце электроноакцепторных заместителей (NO2, CN, N2+ и др.) снижает основность аренов и повышает их реакционную способность по отношению к нуклеофильным реагентам. Ароматическое нуклеофильное замещение в этом случае протекает в гораздо более мягких условиях и по принципиально иному механизму. Реакция является бимолекулярной. Однако, в отличие от алифатического нуклеофильного замещения SN2, процесс включает две последовательные стадии - присоединение и отщепление. На первой стадии ароматический субстрат присоединяет нуклеофил с образованием анионного -комплекса, который получил название комплекса Мейзенгеймера. На второй стадии происходит отщепление уходящей группы с образованием конечного продукта замещения.
В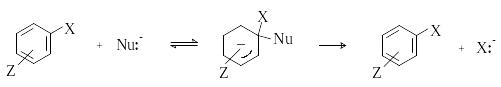
 пользу этого механизма собрано много
доказательств. Одним из таких доказательств
является выделение комплексов
Мейзенгеймера в индивидуальном виде
или идентификация их с помощью
физико-химических методов в растворе.
Такие относительно стабильные -комплексы
могут быть получены в том случае, если
в орто- и пара-положениях к
уходящей группе имеются сильные
электроноакцепторные заместители
(Z=NO2),
а сама уходящая группа относится к
разряду плохих уходящих групп (X=H,
OR). Мейзенгеймер получил
аддукты из метилового и этилового эфиров
пикриновой кислоты, действуя на них,
соответственно, этилатом или метилатом
калия, и доказал идентичность соединений,
полученных обоими путями.
пользу этого механизма собрано много
доказательств. Одним из таких доказательств
является выделение комплексов
Мейзенгеймера в индивидуальном виде
или идентификация их с помощью
физико-химических методов в растворе.
Такие относительно стабильные -комплексы
могут быть получены в том случае, если
в орто- и пара-положениях к
уходящей группе имеются сильные
электроноакцепторные заместители
(Z=NO2),
а сама уходящая группа относится к
разряду плохих уходящих групп (X=H,
OR). Мейзенгеймер получил
аддукты из метилового и этилового эфиров
пикриновой кислоты, действуя на них,
соответственно, этилатом или метилатом
калия, и доказал идентичность соединений,
полученных обоими путями.
А нионные
-комплексы, которые
можно принять за модели переходного
состояния, стабилизируются за счет
делокализации отрицательного заряда
с участием электроноакцепторных
группировок. Наибольшая стабилизация
достигается при наличие электроноакцепторных
заместителей в орто- и пара-положениях
к уходящей группе, так как в этом случае
акцепторная группа находится в прямом
полярном сопряжениии с отрицательно
заряженным атомом углерода.
нионные
-комплексы, которые
можно принять за модели переходного
состояния, стабилизируются за счет
делокализации отрицательного заряда
с участием электроноакцепторных
группировок. Наибольшая стабилизация
достигается при наличие электроноакцепторных
заместителей в орто- и пара-положениях
к уходящей группе, так как в этом случае
акцепторная группа находится в прямом
полярном сопряжениии с отрицательно
заряженным атомом углерода.
В большинстве случаев стадия образования -комплекса является скоростьопределяющей. Об этом, а также о двухстадийном механизме реакции, свидетельствует влияние природы уходящей группы на скорость процесса. При ароматическом нуклеофильном замещении SNAr скорость реакции обычно уменьшается в ряду ArF>>ArCl>ArBr>ArI, что противоположно ряду реакционной способности алкилгалогенидов в SN-реакциях (I>Br>Cl>F). Поскольку энергия разрыва связи С-Hal наибольшая для фтора, это означает, что на скоростьопределяющей стадии разрыва этой связи не происходит. Лимитирующей является первая стадия, а роль уходящей группы сводится к стабилизации анионного -комплекса за счет индуктивного эффекта, который у атома фтора наибольший.
Наиболее распространенными субстратами в SNAr-реакциях являются 2-нитро-, 4-нитро-, 2,4-динитро- и 2,4,6-тринитрогалогенбензолы. Примеры реакций с их участием приведены в таблице.
Реакции ароматического нуклеофильного замещения SNAr

SN1-механизм ароматического нуклеофильного замещения
SN1-механизм предполагает образование карбокатинного интермедиата и реализуется для субстратов, способных давать достаточно стабильный карбокатион. В случае ароматических субстратов при диссоциации связи Ar-X должен образоваться арил-катион. Его стабильность очень мала, поскольку sp2-гибридная вакантная орбиталь ориентирована ортогонально -системе ароматического кольца и с ней не взаимодействует.
![]()
Это приводит к тому, что реакции мономолекулярного замещения в ароматическом ряду возможны только случае очень хороших уходящих групп. Наиболее типичный пример – гетеролитический распад диазосоединений, когда в результате диссоциации образуется бедная энергией молекула азота и процесс является выгодным термодинамически.
Р еакции
разложения ионов диазония имеют все
характерные черты SN1-процессов.
Разложение протекает как реакция первого
порядка. Скорость реакции не зависит
от концентрации присутствующих в
реакционной среде нуклеофилов, но
существует конкуренция нуклеофилов на
стадии образования конечного продукта
при взаимодействии с арил-катионом.
еакции
разложения ионов диазония имеют все
характерные черты SN1-процессов.
Разложение протекает как реакция первого
порядка. Скорость реакции не зависит
от концентрации присутствующих в
реакционной среде нуклеофилов, но
существует конкуренция нуклеофилов на
стадии образования конечного продукта
при взаимодействии с арил-катионом.
По такому механизму протекают реакции солей диазония с водой, спиртами и галогенид-анионами:

См. также лек.№ 29 и 43.
