
- •Процессы катаболизма и анаболизма в клетках. Эндергонические и экзергонические реакции в живой клетке. Макроэргические соединения: определение, примеры.
- •3. Окислительное фосфорилирование: сущность процесса, обобщенная схема, субстраты, коэффициент р/о. Строение митохондрий.
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром c-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •5 Комплекс
- •1. Первичные акцепторы водорода
- •Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Термогенная функция энергетического обмена в бурой жировой ткани.
- •Пируватдегидрогеназный мульферментный комплекс
- •11. Пируватдегидрогеназный комплекс животных. Строение, коферменты активных центров, тонкий механизм катализа.
- •12. Цикл лимонной кислоты: биологическая роль, последовательность реакций, характеристика ферментов.
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •13. Ключевые реакции цикла лимонной кислоты. Механизмы регуляции скорости цикла лимонной кислоты.
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •14. Анаплеротические реакции цикла лимонной кислоты (уравнения реакций, ферменты, биологическая роль). Анаболическое значение цикла лимонной кислоты.
- •Фосфоенолпируваткарбоксикиназа
- •Реакции катаболизма аминокислот
- •Реакции катаболизма жирных кислот
- •16. Основное понятие – углеводы. Классификация углеводов. Распространение углеводов в живой природе. Их биологическая роль.
- •Классификация моносахаридов
- •Производные моносахаридов
- •Строение некоторых производных моносахаридов
- •18. Дисахариды. Строение. Роль в питании. Олигосахариды. Их роль в рецепции. Группы крови.
- •Строение мальтозы и изомальтозы
- •Строение сахарозы
- •Строение лактозы и целлобиозы
- •19. Полисахариды. Крахмал. Гликоген. Гетерополисахариды. Строение и биологическая роль.
- •Строение целлюлозы Гетерополисахариды
- •20. Переваривание углеводов. Всасывание углеводов. Транспорт глюкозы в тканях.
- •Переваривание углеводов в желудочно-кишечном тракте
- •Транспорт моносахаров через мембраны Всасывание в кишечнике
- •Вторично-активный транспорт
- •Вторично-активный транспорт глюкозы и галактозы через мембраны энтероцитов Пассивный транспорт
- •Транспорт из крови через мембраны клеток
- •21. Синтез гликогена.
- •22. Распад гликогена и мобилизация глюкозы.
- •23. Регуляция синтеза и распада гликогена в печени. Роль гормонов и протеинкиназ в регуляции. Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •24. Гликолиз. Химические реакции и ферменты.
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Реакция 4
- •Реакция 5
- •Реакция 6
- •Реакция 9
- •Реакция 11
- •25. Глюконеогенез. Схема процесса, необратимые реакции. Субстратные циклы.
- •26. Регуляция гликолиза и глюконеогенеза. Фосфофруктокиназа-2 и ее роль в гормональной регуляции обмена углеводов.
- •Гормональная регуляция гликолиза, глюконеогенеза и обмена гликогена.
- •27. Анаэробный гликолиз. Превращение пировиноградной кислоты в анаэробных условиях. Лактатдегидрогеназа. Цикл Кори.
- •29. Схема пентозофосфатного цикла. Биологическое значение.
- •30. Регуляция содержания глюкозы в крови. Влияние инсулина и контринсулярных гормонов на уровень «сахара» в крови. Глюкозоксидазный метод определения содержания глюкозы крови.
- •Глюкозооксидазный метод
- •31. Наследственные нарушения обмена моносахаридов и дисахаридов.
1. Первичные акцепторы водорода
Первичные акцепторы водорода окислительно- восстановительных реакций относят К 2 типам дегидрогеназ: никотинамидзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина (см. раздел 2).
Никотинамидзависимые дегидрогеназы содер-жат в качестве коферментов
NАD+
NАDР+ (см. раздел 2).
NАD* и NАDР+ - производные витамина РР.
Эти коферменты входят в состав активных центров дегидрогеназ, Но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции.
Субстраты NАD- и NАDР-зависимых дегидрогеназ находятся В матриксе митохондрий И В цитозоле. Р абочей частью никотинамидных коферментов служит никотинамид (рис. 6-5).составе порфириновых колец, ионы Сu.
Большинство дегидрогеназ, поставляющих электроны В ЦПЭ, содержат NАDt. Они ката- лизируют реакции типа:
R-CHOH-R + NADt t R-CO-R, +NADH + H*.
Таким образом, NАDt, присоединяя протоны и электроны ОТ различных субстратов, служит главНЫМ коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
NАDРН не является непосредственным доно- ром электронов В ЦПЭ, а используется ПОчти ИС- ключительно В восстановительных биосинтезах (см. раздел 8). Однако возможно включение элек- тронов с NАDРН В Ц ПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализи- рующей реакцию:
NФлавиновые дегидрогеназы содержат В каче- стве коферментов FАD или FМN. Эти кофер- менты образуются В организме человека из вита- мина В, (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей час- тью FАD и FМN служит изоаллоксазиновая со- пряжённая циклическая система (рис. 6-6).
FАD служит акцептором электронов от мно- гих субстратов в реакциях типа:
R-CH,-CH,-R, + E (FAD) H R-CH=CH-R + E (FADH,),
где Е - белковая часть фермента.
Большинство FАD-зависимых дегидрогеназ - растворимые белки, локализованные В матриксе митохондрий. Исключение составляет сукцинат- дегидрогеназа, находящаяся ВО внутренней мем- бране митохондрий. К FМN-содержащим фер- ментам принадлежит NАDН-дегидрогеназа, ко- торая также локализована во внутренней мембране митохондрий; она окисляет NАDН, образующий- ся В митохондриальном матриксе.
6. Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании. H+-АТФ-синтаза: биологическая роль, локализация, строение, механизм синтеза АТФ.
Преобразование энергии электронов в энергию АТФ происходит в два этапа. На первом энергия электронов преобразуется в энергию протонного градиента. Концентрация протонов в межмембранном пространстве больше чем в матриксе митохондрии. Поскольку каждый протон несет положительный заряд, вследствие этого появляется разность потенциалов по обе стороны мембраны. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал (ДцН4). АцН* - Источник энергии для синтеза АТФ. Активный транспорт протонов происходит в трех участках дыхательной цепи, в ферментативных комплексах I, III и IV (рис. 21). Эти участки часто называют пунктами сопряжения дыхания и фосфорилирования, хотя правильнее считать пунктом сопряжения окисления (дыхания) и фосфорилирования комплекс V, в котором синтезируется АТФ.
Механизм вращательного катализа при синтезе АТФ
Механизм синтеза АТФ при участии АТФ-синтазы получил название вращательный катализ (роторный катализ, ротационный катализ).
Фермент АТФ-синтаза состоит из множества белковых цепей, формирующих два больших компонента:
компонент Fо (олигомицин-чувствительный) – его функция каналообразующая, через него выкачанные наружу ионы водорода устремляются в матрикс,
компонент F1 (fraction 1, англ. - часть 1) – его функция каталитическая. Именно он, используя энергию протонного градиента, синтезирует АТФ.
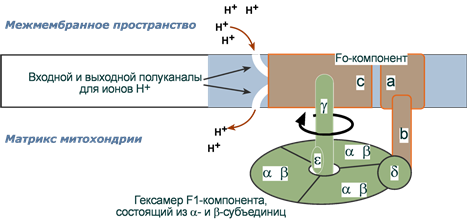
Строение компонента Fо
Данный компонент погружен в мембрану, является интегральным белком цилиндрической формы, образован субъединицами типов a и b, и 10-12 субъединицами типа с, собранными в единый комплекс. В каждой из c-субъединиц есть отрицательно заряженные центры связывания протонов – остатки аспарагиновой кислоты. Эти центры взаимодействуют с полуканалами для ионов H+, открывающимися наружу (в межмембранное пространство), и внутрь (в матрикс).
a- и b-Субъединицы являются структурными. Их задача - обеспечить прикрепление к мембране F1-компонента.
Строение АТФ-синтазы
Строение компонента F1
Молекулы этого компонента состоят из девяти субъединиц пяти различных типов (3α, 3β, γ, δ, ε). Основной функциональной субъединицей F1-компонента является гексамер, состоящий из 3α- и 3β-субъединиц. Через δ-субъединицу гексамер присоединен к b-субъединице (Fo), которая в свою очередь зацеплена в мембране за a-субъединицу Fo-компонента. Таким образом, гексамер 3αβ фиксирован и неподвижен. Каталитический центр, в котором и происходит синтез АТФ, находится в β-субъединице.
γ-Субъединица одним концом жестко связана с комплексом c-субъединиц (Fo), другим концом она входит внутрь гексамера 3αβ. С ней дополнительно связана минорная субъединица ε.
Взаимодействие F1 и Fo
Синтез АТФ происходит за счет энергии, высвобождающейся при прохождении протонов через каналы комплекса Fo.
Протоны из межмембранного пространства достигают своих центров связывания на с-субъединицах (Fo) через входной полуканал и прикрепляются к аспартату, нейтрализуя его отрицательный заряд. Лишенная заряда с-субъединица меняет свою конформацию и принуждает Fo-комплекс вращатьсявокруг своей оси, доставляя протоны к другому полуканалу, который направлен уже в матрикс митохондрий. Поскольку концентрация ионов H+ в матриксе низка, то они легко отрываются от аспартата и уходят внутрь, а оставшийся, уже заряженный, аспартат не позволяет комплексу вращаться в обратном направлении.
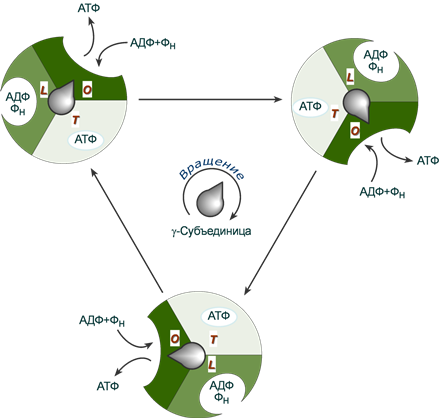
При связывании ионов H+ происходит поворот не только комплекса c-субъединиц Fo-компонента, но и жестко связанной с ним γ-субъединицы F1-компонента. Стержень γ–субъединицы проворачивается внутри неподвижного гексамера 3αβ и при каждом повороте на 120° она поочередно вступает в контакт с каталитическими β-субъединицами, что меняет их функционирование.
Взаимодействие γ-субъединицы с β-субъединицами при синтезе АТФ
β-субъединицы могут находиться в трех конформациях, выполняющих разную функцию:
loose, L (англ. слабо связано) – удерживает АДФ и ион фосфата,
tight, T (англ. тесно) – "прижимает" молекулы АДФ и фосфат-иона, т.е. происходит синтез АТФ,
open, O (англ. открыто) – в этом состоянии субъединица высвобождает АТФ и захватывает АДФ и ион фосфата.
При каждом обороте γ-субъединицы на 360º синтезируются три молекулы АТФ.
Синтез АТФ регулируется
Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль.
Регуляция функционирования системы окислительного фосфорилирования. Дыхательный контроль. Нарушения энергетического обмена. Гипоэнергетические состояния как результат гипоксии, гиповитаминозов и других причин.
Регуляция окислительного фосфорилирования
Скорость окислительного фосфорилирования определяется потребностями организма в АТФ и, следовательно, скоростью ее распада до АДФ.
Интенсивность потока электронов по дыхательной цепи зависит от уровня АДФ
При добавлении АДФ к тканевым гомогенатам скорость поглощения О2 значительно повышается, а затем, когда вся АДФ превратится в АТФ, возвращается к исходному уровню.
Зависимость скорости дыхания митохондрий от содержания АДФ называется дыхательным контролем
Физиологическое значение этого регуляторного механизма очевидно. При усиленном потреблении АТФ (например, при интенсивной физической работе) концентрация АДФ увеличивается, что приводит к повышению интенсивности дыхания и, следовательно, скорости ресинтеза АТФ. При уменьшении потребности в АТФ перенос электронов по дыхательной цепи, наоборот, замедляется.
Синтез АТФ регулируется
Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль.
Дыхательный контроль
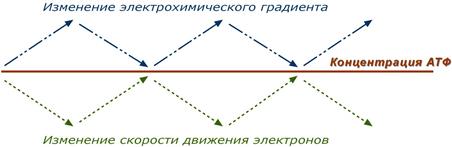
Дыхательный контроль – это прямое ингибирующее влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ / АДФ, количественная сумма которых в клетке примерно постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Зависимость величины электрохимического градиента и скорости движения электронов
Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т.е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН2 на I и II комплексах, ингибирование ферментов ЦТК и пируват-дегидрогеназы под влиянием НАДН и замедление катаболизма в клетке.
Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+.
При этом протонный градиент, естественно, снижается, подавление движения электронов не происходит и поэтому величина потока электронов по цепи возрастает. В результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров.
Ингибирование ферментов дыхательной цепи
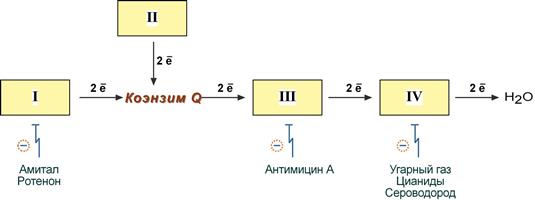
Ряд веществ может ингибировать ферменты дыхательной цепи и блокировать движение электронов от НАДН и ФАДН2 на кислород. В результате прекращается движение электронов, выкачивание ионов Н+ и работа АТФ-синтазы. Синтез АТФ резко снижается, метаболизм в клетке нарушается вплоть до ее гибели. Выделяют три основных группы ингибиторов:
действующие на I комплекс, например, амитал (успокаивающее и снотворное средство), ротенон (пестицид широкого спектра),
действующие на III комплекс, например, антимицин А (экспериментальный антибиотик),
действующие на IV комплекс, например, сероводород (H2S), угарный газ(СО), цианиды (-CN).
Ингибиторы ферментов дыхательной цепи
Ротенон - растительный пестицид из семян и стеблей некоторых растений. Он малоопасен для человека, поскольку плохо всасывается в желудочно-кишечном тракте, и быстро разлагается на солнечном свете. Но умышленное поглощение ротенона может быть смертельным.
Амитал, Амитал натрия - производное барбитуровой кислоты из серии средств, которые ранее широко использовались в качестве успокоительных и снотворных, но из-за ряда причин, в том числе узкого терапевтического диапазона, развития привыкания и зависимости, были заменены на более безопасные средства.
Антимицины - группа вторичных метаболитов, синтезируемых бактериями рода Streptomyces, обладающих антигрибковой активностью. Как активный компонент используется в рыбоводстве.
Причиной гипоэнергетических состояний может быть следующее:
+
гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты,
дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности,
снижение потребления углеводов и липидов как основных источников энергии,
дефицит кислорода – отсутствие акцептора для электронов вызывает "переполнение" дыхательных ферментов, повышение электрохимического градиента, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма,
дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы.
Энергетические процессы в клетках зависят от концентрации и активности большого числа разнообразных гуморальных факторов (витамины, гормоны, продукты обмена, нервные медиаторы, ионы и т. д.). Обмен энергии регулируется деятельностью нервной и эндокринной систем.
Кора головного мозга. Эмоциональное возбуждение сопровождается изменением корковой регуляции теплопродукции и повышает ее. Высвобождение энергии усиливается в эректильной фазе травматического шока.
Гипоталамус. Одной из важнейших функций гипоталамуса является терморегуляция. При возбуждении латеральных гипоталамических полей увеличивается теплопродукция. Повреждение этих областей, а также медиальной части заднего гипоталамуса ведет к возникновению гипотермии и затрудняет защиту от воздействия холода. Опухоли преоптического поля и туберальной части сопровождаются гипертермией.
Гипофиз. Удаление гипофиза приводит к снижению энергетических процессов в результате прекращения регулирующего влияния тропных гормонов (ТТГ, АКТГ) на периферические эндокринные железы. Отсутствует секреция соматотропного гормона, который увеличивает теплообразование за счет стимуляции свободного окисления.
При опухолях гипофиза повышается энергетический обмен. Эозинофильная аденома сопровождается гиперпродукцией соматотропного гормона, увеличивающего теплообразование. Базофильная аденома приводит к гиперпродукции тиреотропного (ТТГ) и адренокортикотропного (АКТГ) гормонов, возникает гиперплазия щитовидной железы и коркового слоя надпочечных желез, теплопродукция увеличивается.
Щитовидная железа. Тироксин и другие гормоны щитовидной железы являются основными регуляторами проницаемости митохондрий и, следовательно, энергетического обмена. При гиперфункции щитовидной железы усиливается как свободное, так и фосфорилирующее окисление, теплопродукция увеличивается. При уменьшении продукции тироксина (гипофункция щитовидной железы) теплопродукция уменьшается.
Надпочечные железы. Адреналэктомия ведет к снижению энергетического обмена. При опухолях надпочечников энергетический обмен повышается.
Поджелудочная железа. Инсулин — гормон поджелудочной железы — угнетает теплопродукцию и вызывает гипотермию. Удаление поджелудочной железы повышает освобождение энергии.
Половые гормоны. Гормоны половых желез — тестостерон и прогестерон — активизируют свободное окисление, стимулируют высвобождение энергии.
Витамины. Свободное окисление активизируется аскорбиновой кислотой. Фосфорилирующее окисление усиливают витамины Е, К, В1, В2, B12, биотин. При В-авитаминозах наблюдается гиперпродукция энергии, поскольку многие из них входят в состав коферментов цикла трикарбоновых кислот и переноса электронов в дыхательной цепи.
