
- •Процессы катаболизма и анаболизма в клетках. Эндергонические и экзергонические реакции в живой клетке. Макроэргические соединения: определение, примеры.
- •3. Окислительное фосфорилирование: сущность процесса, обобщенная схема, субстраты, коэффициент р/о. Строение митохондрий.
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром c-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •5 Комплекс
- •1. Первичные акцепторы водорода
- •Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Термогенная функция энергетического обмена в бурой жировой ткани.
- •Пируватдегидрогеназный мульферментный комплекс
- •11. Пируватдегидрогеназный комплекс животных. Строение, коферменты активных центров, тонкий механизм катализа.
- •12. Цикл лимонной кислоты: биологическая роль, последовательность реакций, характеристика ферментов.
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •13. Ключевые реакции цикла лимонной кислоты. Механизмы регуляции скорости цикла лимонной кислоты.
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •14. Анаплеротические реакции цикла лимонной кислоты (уравнения реакций, ферменты, биологическая роль). Анаболическое значение цикла лимонной кислоты.
- •Фосфоенолпируваткарбоксикиназа
- •Реакции катаболизма аминокислот
- •Реакции катаболизма жирных кислот
- •16. Основное понятие – углеводы. Классификация углеводов. Распространение углеводов в живой природе. Их биологическая роль.
- •Классификация моносахаридов
- •Производные моносахаридов
- •Строение некоторых производных моносахаридов
- •18. Дисахариды. Строение. Роль в питании. Олигосахариды. Их роль в рецепции. Группы крови.
- •Строение мальтозы и изомальтозы
- •Строение сахарозы
- •Строение лактозы и целлобиозы
- •19. Полисахариды. Крахмал. Гликоген. Гетерополисахариды. Строение и биологическая роль.
- •Строение целлюлозы Гетерополисахариды
- •20. Переваривание углеводов. Всасывание углеводов. Транспорт глюкозы в тканях.
- •Переваривание углеводов в желудочно-кишечном тракте
- •Транспорт моносахаров через мембраны Всасывание в кишечнике
- •Вторично-активный транспорт
- •Вторично-активный транспорт глюкозы и галактозы через мембраны энтероцитов Пассивный транспорт
- •Транспорт из крови через мембраны клеток
- •21. Синтез гликогена.
- •22. Распад гликогена и мобилизация глюкозы.
- •23. Регуляция синтеза и распада гликогена в печени. Роль гормонов и протеинкиназ в регуляции. Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •24. Гликолиз. Химические реакции и ферменты.
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Реакция 4
- •Реакция 5
- •Реакция 6
- •Реакция 9
- •Реакция 11
- •25. Глюконеогенез. Схема процесса, необратимые реакции. Субстратные циклы.
- •26. Регуляция гликолиза и глюконеогенеза. Фосфофруктокиназа-2 и ее роль в гормональной регуляции обмена углеводов.
- •Гормональная регуляция гликолиза, глюконеогенеза и обмена гликогена.
- •27. Анаэробный гликолиз. Превращение пировиноградной кислоты в анаэробных условиях. Лактатдегидрогеназа. Цикл Кори.
- •29. Схема пентозофосфатного цикла. Биологическое значение.
- •30. Регуляция содержания глюкозы в крови. Влияние инсулина и контринсулярных гормонов на уровень «сахара» в крови. Глюкозоксидазный метод определения содержания глюкозы крови.
- •Глюкозооксидазный метод
- •31. Наследственные нарушения обмена моносахаридов и дисахаридов.
1 Комплекс. Надн-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков.
Функция
Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
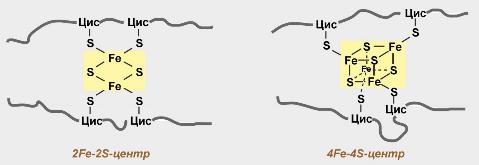
Железосерные белки (FeS-белки) – это белки содержащие атомы железа, которые соединены с атомами серы и с серой остатков цистеина. В результате образуется железо-серный центр.
2 Комплекс. Фад-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода).
Функция
Восстановление ФАД в окислительно-восстановительных реакциях.
Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон).
3 Комплекс. КоQ-цитохром c-оксидоредуктаза
По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей.
Функция
Принимает электроны от коэнзима Q и передает их на цитохром с.
Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
Имеются разногласия по поводу количества переносимых ионов H+ при участии 3-го и 4-го комплексов. По одним данным, третий комплекс переносит 2 иона H+ и четвертый комплекс переносит 4 иона H+. По другим авторам, наоборот, третий комплекс переносит 4 иона H+ и четвертый комплекс переносит 2 иона H+.
4 Комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция
Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 Комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+ используется для транспорта неорганического фосфата в матрикс митохондрии и для антипорта АДФ (в митохондрию) ↔ АТФ (в цитозоль). Таким образом, для получения одной молекулы АТФ из АДФ требуется 4 иона Н+.
Поскольку при прохождении одной пары электронов по всей дыхательной цепи выкачивается 10 ионов Н+, то окисление одного моля НАДН+Н+ приведет к образованию 2,5 молей АТФ.
Ферменты, катализирующие окислительно-восстановительные реакции, называют оксидоредуктазами. Согласно международной классификации и номенклатуре ферментовоксидоредуктазы относятся к1 классу, в пределах которого выделяют двадцать два подкласса:
Их разделяют на 5 групп.
1. Оксидазы. Они катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород.
Оксидазы содержат медь, продуктом реакции является вода.Она служит конечным компонентом цепи дыхательных переносчиков, локализованных в митохондриях, и катализирует реакцию, в результате которой электроны, высвобождающиеся из молекул субстрата при их окислении дегидрогеназами, переносятся на кислород.
2. Аэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата они переносят водород непосредственно на молекулярный кислород и в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие как метиленовый синий.
Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода. Аэробные дегидрогеназы содержат в качестве простетической группы флавинмононкулеотид (ФМН) или флавнадениндинуклеотид (ФАД). (ФМН) и (ФАД) образуются в организме из рибофлавина (витамин В2). Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют флавопротеинами.
Альдегиддегидрогеназа – FAD-содержащий фермент, находящийся в печени млекопитающих. Это – металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты. Глюкозооксидаза – FAD-специфичный фермент, получаемый из грибов; используется при определении глюкозы.
3. Анаэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода.
Эти ферменты выполняют две главные функции:
а) Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции. Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же кофермент или переносчик водорода.
б) Функцию компонентов дыхательной цепи, обеспечивающих транспорт электоронов от субстрата на кислород.
Среди анаэробных дегидрогеназ различают дегидрогеназы, зависимые от никотинамидных коферментов, рибофлавиновые дегидрогеназы, цитохромы. NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма – гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-зависимые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности, во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути.
Большинство раибофлавин-зависимых аэробных дегидрогеназ либо участвуют в транспорте электронов по дыхательной цепи, либо поставляют электроны для этой цепи. NADН-дегидрогеназа – компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например, сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь.
Цитохромы служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5 ), в растительных клетках, бактериях и дрожжах.
4. Гидроксипероксидазы – ферменты, использующие в качестве субстрата перекись водорода или органические перекиси. К этой категории относятся два типа ферментов: пероксидазы, находящиеся в составе молока, в растениях, лейкоцитах, тромбоцитах, эритроцитах и т. д., и каталаза, функционирующая в тканях животных и растений.
5. Оксигеназы – катализирующие прямое введение кислорода в молекулу субстрата. Оксигеназы не относятся к ферментам, катализирующим реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов. Ферменты этой группы делятся на две подгруппы:
а) Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
А + О2 АО2
Примером служат железосерные ферменты гомогентизатдиоксигеназа и 3-гидроксиантранилат-диоксигеназа, а также гемсодержащие ферменты, в частности L-триптофандиоксигеназа (триптофанпирролаза).
б) Монооксигеназы (оксидаза со смешанной функцией, гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для этой цели необходим дополнительный донор электронов (косубстрат):
А – Н + О2 + ZН2 А – ОН + Н2О + Z
