
- •Процессы катаболизма и анаболизма в клетках. Эндергонические и экзергонические реакции в живой клетке. Макроэргические соединения: определение, примеры.
- •3. Окислительное фосфорилирование: сущность процесса, обобщенная схема, субстраты, коэффициент р/о. Строение митохондрий.
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром c-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •5 Комплекс
- •1. Первичные акцепторы водорода
- •Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Термогенная функция энергетического обмена в бурой жировой ткани.
- •Пируватдегидрогеназный мульферментный комплекс
- •11. Пируватдегидрогеназный комплекс животных. Строение, коферменты активных центров, тонкий механизм катализа.
- •12. Цикл лимонной кислоты: биологическая роль, последовательность реакций, характеристика ферментов.
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •13. Ключевые реакции цикла лимонной кислоты. Механизмы регуляции скорости цикла лимонной кислоты.
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •14. Анаплеротические реакции цикла лимонной кислоты (уравнения реакций, ферменты, биологическая роль). Анаболическое значение цикла лимонной кислоты.
- •Фосфоенолпируваткарбоксикиназа
- •Реакции катаболизма аминокислот
- •Реакции катаболизма жирных кислот
- •16. Основное понятие – углеводы. Классификация углеводов. Распространение углеводов в живой природе. Их биологическая роль.
- •Классификация моносахаридов
- •Производные моносахаридов
- •Строение некоторых производных моносахаридов
- •18. Дисахариды. Строение. Роль в питании. Олигосахариды. Их роль в рецепции. Группы крови.
- •Строение мальтозы и изомальтозы
- •Строение сахарозы
- •Строение лактозы и целлобиозы
- •19. Полисахариды. Крахмал. Гликоген. Гетерополисахариды. Строение и биологическая роль.
- •Строение целлюлозы Гетерополисахариды
- •20. Переваривание углеводов. Всасывание углеводов. Транспорт глюкозы в тканях.
- •Переваривание углеводов в желудочно-кишечном тракте
- •Транспорт моносахаров через мембраны Всасывание в кишечнике
- •Вторично-активный транспорт
- •Вторично-активный транспорт глюкозы и галактозы через мембраны энтероцитов Пассивный транспорт
- •Транспорт из крови через мембраны клеток
- •21. Синтез гликогена.
- •22. Распад гликогена и мобилизация глюкозы.
- •23. Регуляция синтеза и распада гликогена в печени. Роль гормонов и протеинкиназ в регуляции. Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •24. Гликолиз. Химические реакции и ферменты.
- •Реакция 1
- •Реакция 2
- •Реакция 3
- •Реакция 4
- •Реакция 5
- •Реакция 6
- •Реакция 9
- •Реакция 11
- •25. Глюконеогенез. Схема процесса, необратимые реакции. Субстратные циклы.
- •26. Регуляция гликолиза и глюконеогенеза. Фосфофруктокиназа-2 и ее роль в гормональной регуляции обмена углеводов.
- •Гормональная регуляция гликолиза, глюконеогенеза и обмена гликогена.
- •27. Анаэробный гликолиз. Превращение пировиноградной кислоты в анаэробных условиях. Лактатдегидрогеназа. Цикл Кори.
- •29. Схема пентозофосфатного цикла. Биологическое значение.
- •30. Регуляция содержания глюкозы в крови. Влияние инсулина и контринсулярных гормонов на уровень «сахара» в крови. Глюкозоксидазный метод определения содержания глюкозы крови.
- •Глюкозооксидазный метод
- •31. Наследственные нарушения обмена моносахаридов и дисахаридов.
3. Окислительное фосфорилирование: сущность процесса, обобщенная схема, субстраты, коэффициент р/о. Строение митохондрий.
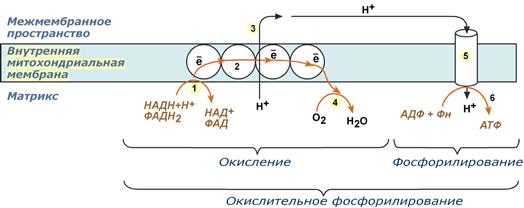
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Согласно гипотезе Питера Митчела перенос электронов, происходящий во внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н+ между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу.
По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью или электрон-транспортной цепью.
Принцип работы дыхательной цепи
Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
Электроны движутся по ферментам дыхательной цепи и теряют энергию.
Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
При этом они теряют энергию, которая используется для синтеза АТФ.
Общая схема окислительного фосфорилирования
Таким образом, восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи. Благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
Коэффициент Р/О – это отношение количества неорганического фосфата, включенного в молекулу АТФ АТФ-синтазой, к количеству атомов кислорода, включенного в молекулу Н2О, при переносе одной пары электронов по дыхательной цепи.
Расчет энергетической ценности окисления вещества и коэффициента Р/О
По современным данным значение коэффициента P/O для НАДH+H+ соответствует 2,5, для ФАДH2 – 1,5.
При расчете энергетической ценности, т.е. количества АТФ, образующейся при окислении вещества, и коэффициента Р/О необходимо представлять себе весь путь этого вещества до полного окисления его углеродных атомов в СО2. При этом необходимо учитывать число атомов углерода в молекуле.
Для расчета Р/О при окислении какой-либо молекулы необходимо учитывать следующее:
для синтеза одной молекулы АТФ и ее переноса ее в цитозоль требуется 4 протона,
восстановленный эквивалент (молекула НАДН+H+ или ФАДН2) передает в цепь переноса электронов по 2 электрона.
для восстановления кислорода в воду необходима 1 пара электронов.
при прохождении пары электронов через всю дыхательную цепь (от НАДН+H+), т.е. через I, III, IV комплексы выкачивается 10 ионов Н+, их энергии достаточно для синтеза 2,5 молей АТФ.
при прохождении пары электронов от ФАДН2 через III и IV комплексы дыхательных ферментов выкачивается 6 ионов Н+, их энергии достаточно для синтеза 1,5 моля АТФ.
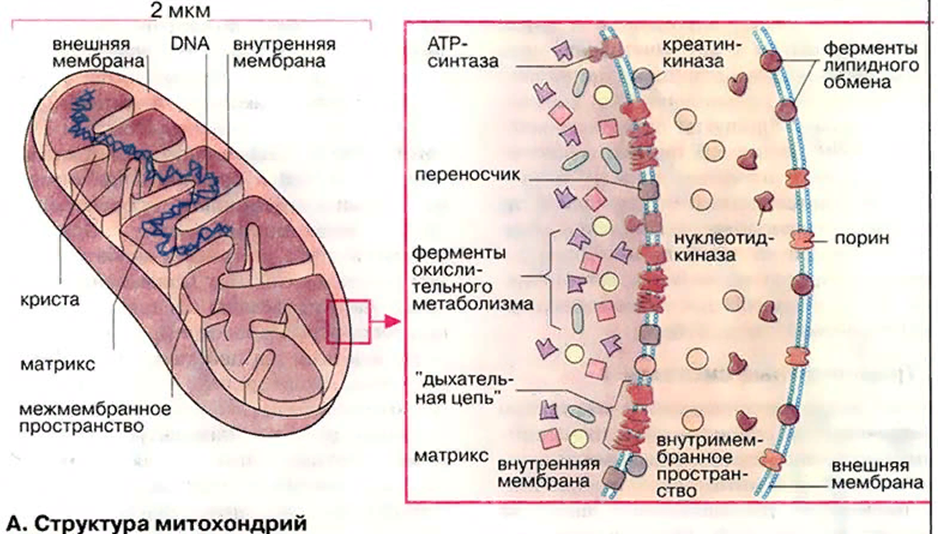
Строение митохондрий
Митохондрии — это органеллы размером с бактерию (около 1×2 мкм).
Во всех эукариотических клетках.
Митохондрия ограничена двумя мембранами — гладкой внешней и складчатой внутренней, имеющей очень большую поверхность.
Складки внутренней мембраны глубоко входят в матрикс митохондрий, образуя поперечные перегородки — кристы.
Пространство между внешней и внутренней мембранами обычно называют межмембранным пространством.
4. Дыхательная цепь — ключевой компонент митохондриальной системы окислительного фосфорилирования. Структурная организация дыхательной цепи. Митохондриальная цепь переноса электронов как часть системы дыхания всего организма.
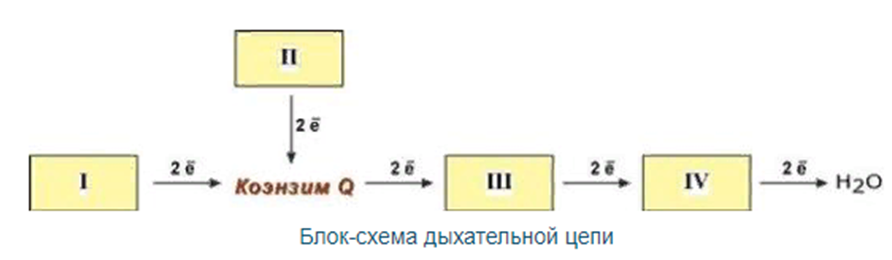
Дыхательная цепь включает множество белков-переносчиков
Всего цепь переноса электронов ( включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
1 комплекс. НАДН-КоQ-оксидоредуктаза
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Функция
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон).
3 комплекс. КоQ-цитохром c-оксидоредуктаза
Функция
1. Принимает электроны от коэнзима Q и передает их на цитохром с.
2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
Функция
1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
• субъединицу Fo – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
• субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
5. НАД-зависимые и флавиновые дегидрогеназы. НАДН-дегидрогеназа. Убихинол-дегидрогеназа (цитохром с-редуктаза). Цитохром с-оксидаза. Особенности состава, строения, функций. Коферменты компонентов дыхательной цепи митохондрий.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый ИЗ которых способен присоединять электроны от предыдущего компонента И передавать следующему. Так возникает цепь окислительно-восстановительных реакций, В результате чего происходят восстановление О2, и синтез Н2О. В дыхательную цепь митохондрий входит большое число переносчиков
Дыхательная цепь включает:
ферменты: НАД- или ФМН(ФАД)-зависимые дегидрогеназы;
цитохромы (гемопротеины, (комплексы), связанные между собой убихиноном (КоQ) и цитохромом с.)
Все участники этой цепи разделены на четыре окислительно-восстановительные системы бы ни был исходный субстрат, электроны и протоны от флавинов переносятся к коферменту Q, после которого пути электронов и протонов расходятся: электроны далее транспортируются по цепи цитохромов, а протоны переносятся из матрикса в межмембранное пространство.
За исключением убихинона ( КоQ), все Компоненты ЦПЕ - белки. В составе этих белков содержатся различные небелковые компоненты: FМN, Fе В составе железо-серных белков и в составе порфириновых колец, ионы Cu.
NAD — зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD+ является коферментом и выполняет роль акцептора водорода.
FAD — зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Коферментом является FAD, который является акцептором водорода от субстрата. NADH — дегидрогеназа катализирует окисление NADH и восстановление убихинона (CoQ). Переносчиком водорода является кофермент — FMN (комплекс 1). В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем передается на убихинон. Флавиновые коферменты (FAD и FMN) прочно связаны с ферментом как простетические группы, поэтому ферменты, в состав которых они входят, называются флавопротеины. Флавинмононуклеотид (FMN), или рибофлавин фосфат, неразрывно связан с белковой частью фермента. Строго говоря, FMN не является нуклеотидом, так как флавиновая часть связана с рибитолом, а не с рибозой.
Убихинон (кофермент Q) — производное изопрена. Кофермент Q действует как переносчик электронов на цитохромы.
Цитохромы — это гемопротеины — белки, содержащие в качестве прочно связанной простетической группы гем.
Атом железа в геме может менять валентность, присоединяя или отдавая электроны.
В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно—восстановительного потенциала следующим образом: B, С1, С, а, а3.
Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:
Цитохромоксидаза переносит электроны с цитохрома С на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3.
Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов на нескольких стадиях, однако, не совсем ясны их локализация и механизм действия.
Строение ферментативных комплексов дыхательной цепи
