
- •Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •1. Зависимость скорости ферментативной реакции от количества ферментов.
- •2. Зависимость скорости ферментативной реакции от температуры среды.
- •3. Зависимость скорости ферментативной реакции от рН среды.
- •4. Зависимость скорости ферментативной реакции от количества субстрата.
- •Выражается уравнением Михаэлиса-Ментена
- •Vmах и Km – кинетические характеристики эффективности фермента.
- •Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
- •3. Роль металлов в ферментативном катализе.
- •Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
- •Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
- •Специфические и неспецифическиеингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Модификации подвергаются ОН-группы фермента.
Фосфорилирование осуществляется ферментами протеинкиназами,
Дефосфорилирование – фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты приводит к изменению конформации
АЦ и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие становятся менее активными.
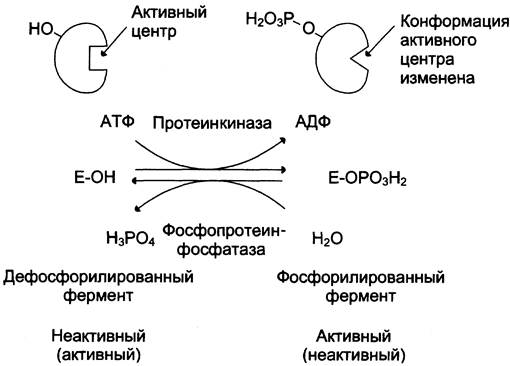
Изменение активности фермента, вызванное фосфорилированием, обратимо.
Отщепление остатка фосфорной кислоты осуществляется фосфопротеинфосфатазами.
Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что
позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфорилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Под действием глюкагона (в период между приемами пищи) происходит распад
гликогена, жира, вызванное фосфорилированием ключевых ферментов этих процессов.
Под действием инсулина (во время пищеварения) – активируется синтез
гликогена, ингибируется его распад, т.к. взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию ключевых ферментов
Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
Протеинкиназы – группа ферментов, катализирующих перенос остатка
фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков).
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов:
2 регуляторных (R)
2 каталитических (С).
Такой тетрамер не обладает каталитической активностью.
Регуляторные субъединицы имеют участки связывания для циклического 3',5'-
АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы. Такой механизм регуляции обратим.
Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации
регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
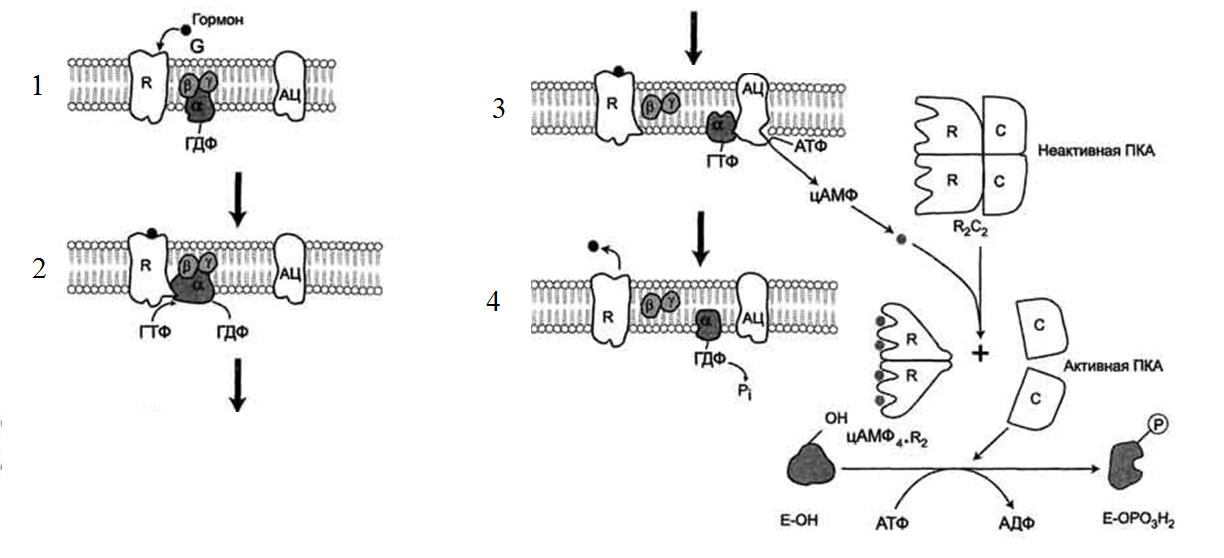
Гормон, взаимодействуя с рецептором на поверхности клеток, приводит к
уменьшению сродства ГТФ-связывающего белка к ГТФ и увеличению сродства к
ГТФ. Присоединение молекулы ГТФ к активному центру G- белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βγ.
Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ
внутриклеточных регуляторных молекул цАМФ, которые и активируют ПК А.
Регуляция каталитической активности ферментов частичным
(ограниченным) протеолизом: некот. ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Пример: активация протеолитического фермента трипсина.
Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по
протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы.
В результате отщепления гексапептида с N-конца формируется активный центр в
оставшейся части молекулы. Трипсин относят к семейству "сериновых" протеаз – активный центр фермента содержит функционально важный остаток Сер.
Частичный протеолиз – пример регуляции, когда активность фермента
изменяется необратимо. Такие ферменты функционируют в течение короткого времени, определяемого временем жизни белковой молекулы.
Частичный протеолиз лежит в основе активации протеолитических ферментов,
белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.
