
- •Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •1. Зависимость скорости ферментативной реакции от количества ферментов.
- •2. Зависимость скорости ферментативной реакции от температуры среды.
- •3. Зависимость скорости ферментативной реакции от рН среды.
- •4. Зависимость скорости ферментативной реакции от количества субстрата.
- •Выражается уравнением Михаэлиса-Ментена
- •Vmах и Km – кинетические характеристики эффективности фермента.
- •Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
- •3. Роль металлов в ферментативном катализе.
- •Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
- •Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
- •Специфические и неспецифическиеингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
Холофермент – фермент, обладающий каталитической активностью, состоящий из
из белковой части – «апофермента» и небелковой – иона металла «кофактора»
Более 25% всех ферментов для проявления полной каталит. активности нуждается в ионах металлов (коферментах)
1. Роль металлов в присоединении субстрата в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов - стабилизаторы молекулы субстрата: для некот. ферментов
субстратом служит комплекс превращаемого вещества с ионом металла.
Например: для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. Сам ион Mg2+ не взаимодействует именно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к АЦ фермента (гексокиназа)
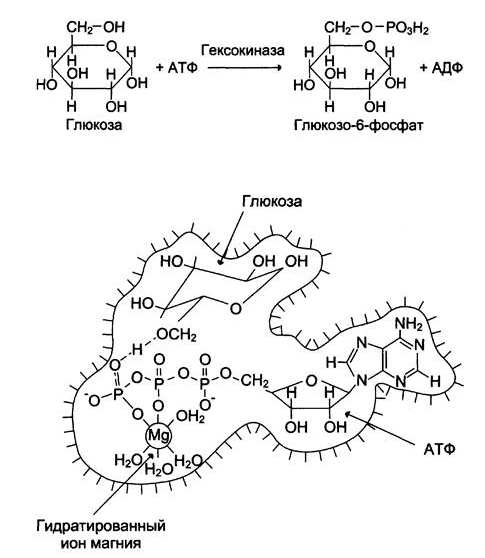
Схематично роль иона Ме можно представить как комплекс: E-S-Me
где: Е – фемрент, S – субстрат, Ме – ион металла
Ионы металла - стабилизаторы АЦ фермента: в некот. случаях ионы Ме
служат "мостиком" между ферментом и субстратом – они стабилизируют АЦ, облегчая присоединение к нему субстрата и протекание хим. реакции.
Ион металла может способствовать присоединению кофермента (это ионы Mg2+,
Mn2+, Zn2+, Co2+). В отсутствие металла эти ферменты активностью не обладают – такие ф. называют "металлоэнзимы".
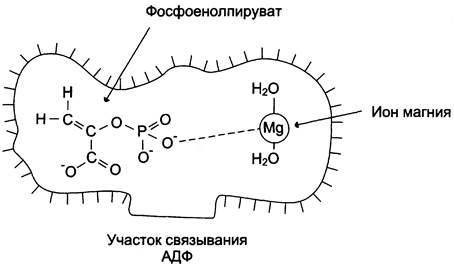
Напимер: фермент пируваткиназа, катализирующий реакцию:

Мg2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата
2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
Некоторые ферменты в отсутствие ионов Ме способны к хим. катализу, ноони нестабильны, т.к. их активность снижается и даже полностью исчезает при небольших изменениях рН, t° и др. незначит. изменениях окр. среды.
Например: для поддержания третичной конформации пируваткиназы необходимы ионы К+. А для стабилизации четвертичной структуры алкогольдегидроггеназы, катализирующей реакцию окисления этанола, необходимы ионы Zn2+
3. Роль металлов в ферментативном катализе.
Участие в электрофильном катализе: эту функцию выполняют ионы Ме с
переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов (Zn2+, Fe2+, Mn2+, Cu2+). В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
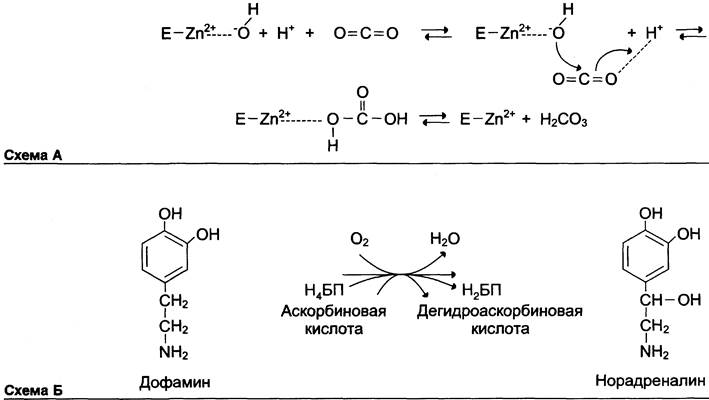
Например: функционирование карбоангидразы – цинкосодержащего фермента, катализир. реакцию обр. угольной кислоты
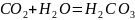
Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН-
ионов из молекулы воды:
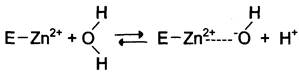
Н+ и ОН- последовательно присоединяются к диоксиду углерода с обр. угольной кислоты:
Участие в ОВР: ионы Ме с переменной валентностью могут также участвовать в
переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
![]()
4. Роль металлов в регуляции активности ферментов: например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализир. реакции фосфорилирования белков. Ионы Са2+ также изменяют активность ряда кальций кальмодулинзависимых ферментов.
Коферменты локализуются в каталитическом участке АЦ и принимают
непосредственное участие в хим. реакции, выступая в качестве акцептора и донора хим. группировок, атомов, электронов.
Кофермент может быть связан с белковой частью молекулы по-разному:
Ковалентными связями – тогда называется простетической гр.
(FAD, FMN, биотин, липоевая кислота).
Нековалентными связями – кофермент взаимодействует с ф. только на
время хим. реакции и может рассматриваться как второй субстрата (NAD+, NADP+)
Но, например, тиаминдифосфат (кофермент) присоединяется к ферменту
нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы
Роль апофермента и кофермента:
Апофермент обеспечивает специфичность действия и отвечает за выбор типа
хим. превращения субстрата.
Один и тот же кофермент, взаимодействуя с различными апоферментами, может
участвовать в разных хим. превращениях субстрата. (Пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования АК)
К коферментам относят следующие соединения:
Производные витаминов
Гемы, входящие в состав цитохромов, каталазы, пероксидазы,
гуанилатциклазы, NO-синтазы и являющиеся простетической гр. ферментов
Нуклеотиды – доноры и акцепторы остатка фосфорной кислоты
Убихинон (кофермент Q), участвующий в переносе электронов
и протонов в ЦПЭ
Фосфоаденозилфосфосульфат, участвующий в переносе сульфата
S-аденозилметионин (SAM) – донор метильной группы
Глутатион, участвующий в ОВР
