- •Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •1. Зависимость скорости ферментативной реакции от количества ферментов.
- •2. Зависимость скорости ферментативной реакции от температуры среды.
- •3. Зависимость скорости ферментативной реакции от рН среды.
- •4. Зависимость скорости ферментативной реакции от количества субстрата.
- •Выражается уравнением Михаэлиса-Ментена
- •Vmах и Km – кинетические характеристики эффективности фермента.
- •Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
- •3. Роль металлов в ферментативном катализе.
- •Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
- •Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
- •Специфические и неспецифическиеингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
Кинетика ферментативных реакций – раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды.
Скорость ферментативной реакции – мера каталитической активности фермента, её обозначают как активность фермента.
Математически скорость ферментативной реакции выражается в изменении конц. субстрата S (уменьшение) или продукта P (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.
На начальном этапе [0-t0] скорость реакции прямо пропорциональна времени и имеет линейную зависимость. Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной к кривой профиля реакции. Чем больше угол наклона, тем больше изменение скорости реакции
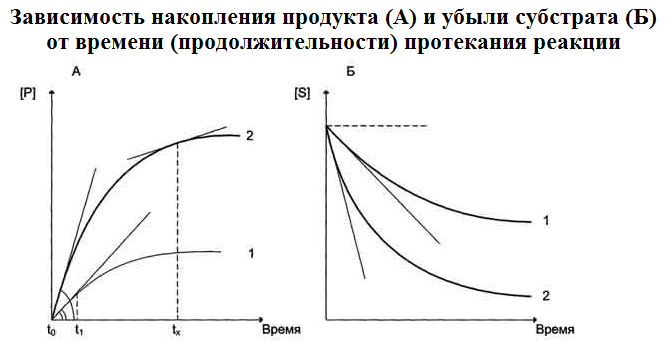
В реакциях, катализируемых ферментами 1 и 2, начальная скорость реакции,
катализируемой ф1, ниже, чем скорость реакции, катал. ф2, так как тангенс угла наклона касательной к кривой профиля реакции, проведённой из "О" точки у второго фермента выше, как в случае накопления продукта (А), так и убыли субстрата (Б).
Скорость в любой момент времени t определяется тангенсом угла наклона
касательной к профилю реакции в момент времени t.
Период времени ферментативной реакции [t0-t1] характеризуется линейным
накоплением продукта (или убылью субстрата) в зависимости от длительности реакции.
Период ферментативной реакции [t1 - tx] характеризуется нелинейным
накоплением продукта (или убылью субстрата) в зависимости от времени реакции
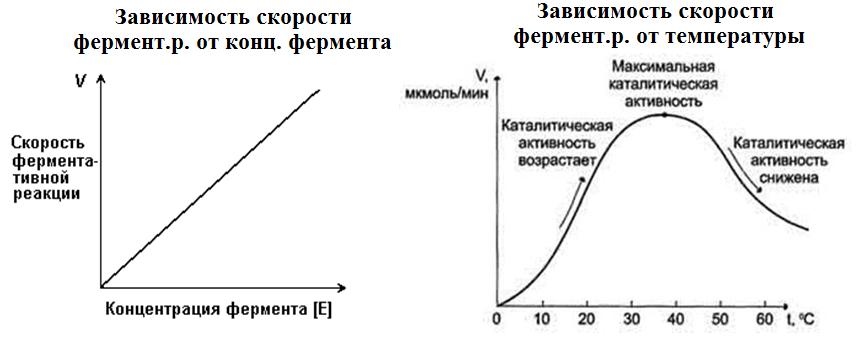
1. Зависимость скорости ферментативной реакции от количества ферментов.
При проведении ферментат. реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента.
Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: международная единица активности (ME)

2. Зависимость скорости ферментативной реакции от температуры среды.
С повышением температуры:
Ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ
Повышается энергия реагирующих молекул
Скорость хим. р., катализируемой ферментами, имеет свой температурный
оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы.
Для большинства ферментов человека оптимальна температура 37-38 °С.
В природе есть термостабильные ферменты (Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивир. при Т до 95°С)
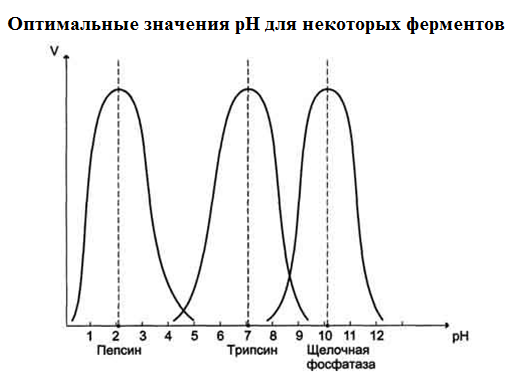
3. Зависимость скорости ферментативной реакции от рН среды.
Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функц. гр. АК остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента, нарушается присоединение субстрата, кофакторов и коферментов к активному центру.
Также рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру.
При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.